PD-1抑制剂联合一线化疗方案对晚期驱动基因阴性肺腺癌的效果及安全性分析
2024-05-16陈艳妮张建红李健李瑶逯震芳陈亮
陈艳妮 张建红 李健 李瑶 逯震芳 陈亮
对于大多晚期肺腺癌患者,虽失去最佳手术时机,但可根据驱动基因突变情况来特异性选取靶向治疗药物,继而有效控制病灶进展,延长生存期限[1]。而对于驱动基因阴性的晚期肺腺癌患者,因无有效靶向治疗药物,故多以传统含铂双药化疗治疗为主,亦可通过诱导癌细胞凋亡等机制来达到良好抗肿瘤效果[2]。但近年有调查发现,随着治疗时间的延长,部分患者对化疗药物产生耐药,降低化疗效果,缩短中位生存时间[3]。因此,需联合其他治疗方案,期待可不增加毒副作用的同时,提高肺腺癌化疗的疗效。程序性细胞死亡蛋白-1(PD-1)可通过阻断PD-1/细胞程序性死亡-配体1(PD-L1)的通路来激活人体T细胞识别肿瘤细胞的能力,阻止免疫逃逸,继而达到良好抗肿瘤效果,且其与一线化疗方案联合应用已被证实在晚期胃癌和肝癌患者中获得显著临床效益[4-5]。基于此,选取医院收治的晚期驱动基因阴性肺腺癌患者临床病历资料,探讨PD-1抑制剂联合化疗一线治疗晚期驱动基因阴性肺腺癌的效果及安全性,旨在为此类患者治疗方案的优化,提供数据支持和临床依据。
1 资料与方法
1.1 一般资料 回顾性收集北京京煤集团总医院2019年1月至2021年12月收治的60例肺腺癌患者临床病历资料进行研究。依据治疗方式的不同,将30例接受培美曲塞联合顺铂治疗的病历资料纳入对照组,将30例接受培美曲塞、顺铂联合PD-1抑制剂(信迪利单抗)治疗的病历资料纳入观察组。2组患者病理分期、性别比、PD-1表达水平等基线资料比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 2组基线资料比较 n=30
1.2 纳入与排除标准
1.2.1 纳入标准:①符合《肺癌筛查与管理中国专家共识》[6]中诊断标准,且经影像学检查和组织病理学检查确诊为肺腺癌Ⅳ期;②驱动基因检测结果阴性;③治疗前完善血常规、肝肾功能等基线检查,且检查资料完整;④卡士功能状态评分(Karnofsky,KPS)[6]≥60分;⑤预估生存期≥3个月。
1.2.2 排除标准:①合并其他恶性肿瘤;②存在活动性感染疾病;③存在无法控制的胸腔或腹腔积液;④疗效不可评估和疗效不详者。
1.3 方法
1.3.1 对照组:对照组接受培美曲塞联合顺铂治疗。具体:给予患者0.9%氯化钠溶液(华润双鹤药业股份有限公司,国药准字H11021190)500 mL静脉滴注补液,并适当给予护胃止吐药物,为化疗药物应用做好准备;而后取培美曲塞(扬子江药业集团有限公司,国药准字H20143379,规格0.1 g/瓶)500 mg/m2与0.9%氯化钠溶液融合后静脉滴注,时间控制在10 min左右;而后再次给予0.9%氯化钠溶液500 mL静脉滴注补液,并给予托烷司琼(海南灵康制药有限公司,国药准字H20060288,2 mg/瓶)50 mL静脉滴注止吐;而后给予0.9%氯化钠溶液500 mL和顺铂(德州德药制药有限公司,国药准字H37020524,规格10 mg/支)75 mg/m2静脉滴注,时间>2 h;最后给予10%葡萄糖500 ml、维生素C和维生素B6200 mg静脉滴注,化疗完成。化疗于每周第1天进行,1次/周为1个周期,连续进行4个周期。化疗期间叮嘱患者尽量保证高蛋白饮食,并适当给予免疫球蛋白、维生素等药物以增强免疫力。
1.3.2 观察组:观察组在对照组基础上联合PD-1抑制剂:信迪利单抗治疗[信达生物制药(苏州)有限公司,国药准字S20180016,规格100 mg(10 mL)/瓶]取信迪利单抗200 mg静脉滴注,每3周1次为1个周期,连续用药4个周期。
1.4 观察指标
1.4.1 临床疗效:根据《实体瘤疗效评价标准》[7],于治疗第4个周期时评定临床疗效。具体:完全缓解(CR):目标病灶均消失且维持时间≥4周;部分缓解(PR):目标病灶直径总和减少≥30%且维持时间≥4周;疾病进展(PD):目标病灶直径总和增加20%或检查发现新发病灶;疾病稳定(SD):目标病灶情况介于PD与PR之间。客观缓解率(ORR)=(CR+PR)/(CR+PR+SD+PD)×100%;疾病控制率(DCR)=(CR+PR+SD)/(CR+PR+SD+PD) ×100%。

1.4.3 肿瘤标志物:于治疗前、治疗4个周期时,取患者空腹静脉血5 mL,经离心机以3 500 r/min离心10 min后取上层血清,通过酶联免疫吸附法(试剂盒购自山东博冠生物技术)测定血清癌胚抗原(CEA)、细胞角蛋白19片段(CYFRA21-1)水平。
1.4.4 不良反应:记录治疗期间粒细胞减少、恶心、甲状腺功能异常、肝功能异常、肺炎、皮疹等不良反应发生情况。
2 结果
2.1 临床疗效 观察组ORR显著高于对照组,差异有统计学意义(P<0.05);2组DCR比较,差异无统计学意义(P>0.05)。见表2。

表2 2组临床疗效比较 n=30,例(%)

表3 2组免疫功能指标比较 n=30,
2.3 肿瘤标志物 治疗前,2组CYFRA21-1、CEA水平对比,差异无统计学意义(P>0.05);治疗后,2组CYFRA21-1、CEA水平均下降,且观察组低于对照组,差异有统计学意义(P<0.05)。见表4。

表4 2组肿瘤标志物比较 n=30,ng/mL,
2.4 2组不良反应比较 观察组甲状腺功能异常、肺炎、皮疹等发生例数显著多于对照组,差异有统计学意义(P<0.05),2组恶心、粒细胞减少、肝功能异常等不良反应发生率比较,差异均无统计学意义(P>0.05)。见表5。
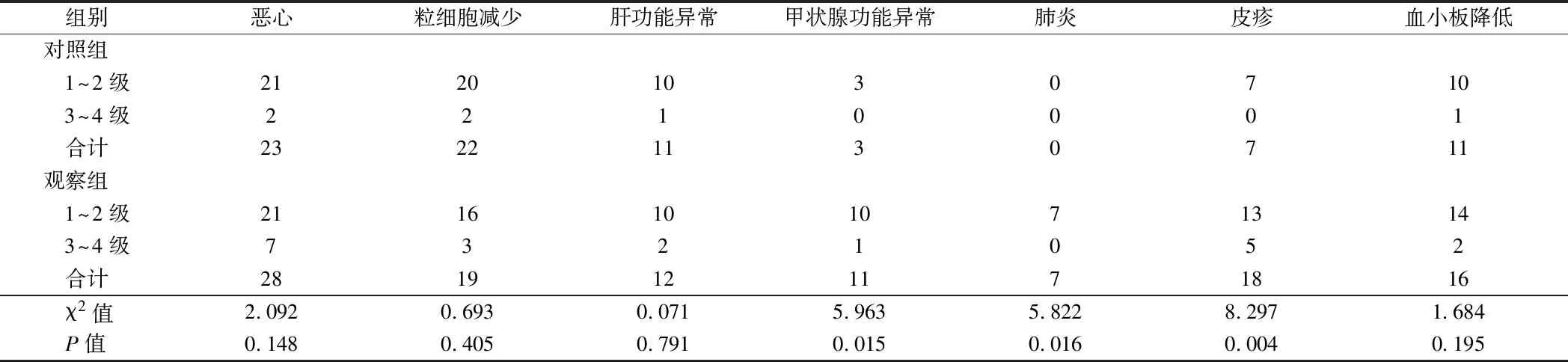
表5 2组不良反应比较 n=30,例
3 讨论
研究发现,免疫逃逸是晚期肺腺癌难以被彻底杀灭的关键,其可通过改变自身微环境和抑制免疫细胞功能来逃避机体的免疫监视,继而促使肺腺癌病灶进一步发展,并诱导转移发生,增加病死率[8]。因此,对于肺腺癌,如何有效杀灭肿瘤细胞的同时,阻止肿瘤免疫逃逸是提高治疗效果的关键所在。而研究指出,化疗可以通过阻断癌细胞DNA和干扰癌细胞有丝分裂来达到良好杀灭癌细胞功效[9-10]。另有研究发现,PD-1抑制剂可通过解除免疫细胞负性调控来有效阻止肿瘤免疫逃逸[11]。且化疗联合PD-1抑制剂已在北京京煤集团总医院晚期驱动基因阴性肺腺癌有所应用,故选取上述患者资料与临床单用一线化疗方案患者资料对比,探讨PD-1抑制剂联合化疗一线治疗晚期驱动基因阴性肺腺癌的效果。
而从本研究结果中可看出,经过治疗,观察组ORR显著高于对照组,2组CYFRA21-1、CEA水平均下降,且观察组降低更为显著,证实PD-1抑制剂联合化疗一线治疗可在晚期驱动基因阴性肺腺癌患者中取得确切疗效。分析原因在于:培美曲塞联合顺铂是肺腺癌一线化疗方案,前者可通过阻止肺腺癌细胞DNA原料合成,继而减缓癌细胞DNA复制和分裂的速度,诱导癌细胞周期停滞与凋亡;而后者可直接作用于肺腺癌细胞的DNA上,通过干扰癌细胞DNA的复制和破坏细胞膜上结构来达到良好抗肿瘤效果[12]。而PD-1抑制剂(信迪利单抗)可通过阻断肿瘤细胞的PD-L1与免疫细胞膜表面的PD-1结合来避免机体负性免疫应答,继而有效阻止免疫逃逸发生,且其还可有效恢复机体对肿瘤细胞的免疫杀伤功能,避免肿瘤细胞的进一步发展和转移[13]。因而将PD-1抑制剂与一线化疗方案联合应用,可起到良好协同共助作用,使治疗效果提升。

综上所述,PD-1抑制剂联合化疗一线治疗可有效降低晚期驱动基因阴性肺腺癌患者肿瘤标志物水平,改善免疫功能,疗效确切。
