长期摄入水解单宁对鼠类生殖的影响
2024-05-15于飞李佳鑫
于飞 李佳鑫


摘 要:水解单宁(hydrolyzed tannin)是橡子内主要的单宁酸类型,对以橡子为主要食物来源的鼠类的生存繁衍有重要影响.为探究长期取食水解单宁对鼠类的生殖激素与生殖器官产生的影响.选择72只(雌雄个体各36只)4周龄的健康昆明小鼠,随机分为4组,分别为对照组(水解单宁比例为0)、低单宁组(水解单宁比例为2%)、中单宁组(水解单宁比例为7%)和高单宁组(水解单宁比例为12%),用不同水解单宁含量的饲料饲喂42 d后解剖取样.结果显示,高含量水解单宁显著降低了雄鼠存活率;中、高含量水解单宁对生殖激素的稳定产生负面效应;高含量水解单宁造成生殖器官损伤,导致小鼠卵巢与睾丸生理结构改变,降低了正常卵泡数量和精子的发生.试验验证了长期摄入高含量水解单宁打破了鼠类的生殖激素平衡且造成了生殖器官的损伤.
关键词:精子质量;昆明小鼠;水解单宁;生殖毒性;生殖激素
中图分类号:Q14 文献标志码:A文章编号:1000-2367(2024)03-0131-08
在我国多数林区,栎树的种子(橡子)是森林生态系统中鼠类的主要食物来源,食物对动物的生存和繁殖有重要影响,因此橡子的丰度和种类对鼠类种群的波动具有直接作用[1-2].林区中数量庞大的鼠类,是乔木种子主要的捕食者与扩散者,但鼠类对种子的过度取食也会抑制种子的扩散[2].同时,种子作为动物的主要食物来源,其内部的化学物质也影响着动物的行为方式与生理活动[3-4].许多植物为了促进自身再生和扩大生存空间,进化出富含糖分或脂质的果实以及较大的种子[4-5].此外,植物也进化出了一系列防止或减少动物过度取食的特性,如大年结实(间接防御)[5]、种子的硬壳(物理防御)[5]或高含量的单宁酸(化学防御)[5].研究发现,大量摄入含有单宁酸的植物种子将导致鼠类体质量下降、生理异常甚至死亡[6].
单宁酸是植物体内主要的次生代谢产物之一,广泛分布于植物的根、茎、叶及种子中[7].它还是植物的重要化学防御武器,用以防御病虫害、抵御病原微生物和减少动物取食[7-8].橡子中的单宁酸主要类型为水解单宁.研究表明水解单宁具有卓越的抗菌能力,适量摄入能改善动物肠道菌群的生态,对维持动物肠道的健康起着重要作用[9];水解单宁还是抗生素的理想替代物,在食物中添加水解单宁对哺乳动物的腹泻、寄生虫等疾病有治疗作用[10-12].此外,水解单宁还具有抗肿瘤特性,有研究指出水解单宁通过减少炎症和增加细胞凋亡的机制,在大鼠体内发挥抗肿瘤作用[13].
目前水解单宁对动物生殖影响的研究主要集中在生殖激素调节、精子质量、体外胚胎生产与生殖能力等方面[14-16].MANZOOR等[14]发现,水解单宁可以通过调节生殖激素,有效调节卵巢卵泡的健康和发育.YIN等[17]指出,猪卵母细胞体外成熟期间,用10 μg/mL水解单宁处理可提高卵母细胞的胞浆成熟度,而100 μg/mL水解单宁处理降低了卵母细胞的核成熟度.目前,相关研究较多关注短期试验(试验时长小于30 d),且是针对单一性别的研究,关于水解单宁对同种动物的雌雄个体的长期效应研究不足.因此本试验采用ELISA
收稿日期:2023-03-10;修回日期:2023-03-28.
基金项目:国家自然科学基金(U1904105);河南省高校科技创新人才项目(22HASTIT033).
作者简介(通信作者):于飞(1986-),男,山西晋中人,河南师范大学副教授,博士生导师,研究方向为森林生态学,E-mail:yufei@htu.cn.
引用本文:于飞,李佳鑫.长期摄入水解单宁对鼠类生殖的影响[J].河南师范大学学报(自然科学版),2024,52(3):131-138.(Yu Fei,Li Jiaxin.Effects of long-term consumption of hydrolyzed tannin on the reproductive of rodents[J].Journal of Henan Normal University(Natural Science Edition),2024,52(3):131-138.DOI:10.16366/j.cnki.1000-2367.)
与石蜡切片的方法,对昆明小鼠的血清生殖激素浓度与生殖器官的生理結构进行研究,旨在研究水解单宁长期饲喂鼠类对雌雄两性的生殖激素(雌二醇、促黄体生成素、促卵泡素及睾酮)与生殖器官(卵巢与睾丸)的影响.因野外条件下鼠类个体差异(年龄、体质量、遗传背景、生存经历等)较大[18],采用野生鼠类研究其生理特征常有一定的局限性,若不了解个体差异或无大量样本进行试验,则得出的结论不具有普遍性.因此本研究拟在环境可控且稳定的动物试验室中进行,选择昆明小鼠为试验对象,并对试验样本的生理指标(年龄、体质量、行为指标等)进行严格筛选,以减少试验结果的误差.
1 材料与方法
1.1 试验动物
2022年6月于河南斯克贝斯生物科技股份有限公司购买4周龄SPF级昆明小鼠,选择72只(36只雌性,36只雄性)初始体质量在22~28 g之间的小鼠,试验室内适应性饲养7 d后开始干预试验,个体单独置于长、宽、高分别为290 mm、180 mm、160 mm的聚丙烯饲养笼内饲养,采用玉米芯垫料,温度设定为(25±2) ℃,相对湿度设定为(50±5)%,光周期12 h:12 h(8:00开始光照,20:00关闭光照),自由饮水、取食.所有饲养及解剖试验操作均依照河南师范大学科研试验动物伦理指导方法进行.
1.2 试验饲料
人工饲料需模拟橡子的水解单宁含量,因此收集橡子进行水解单宁含量的测定.2020年8至10月于济源市愚公林场收集到栓皮栎、锐齿槲栎和蒙古栎3种橡子,采用分光光度法检测收集橡子的水解单宁含量,3种橡子水解单宁比例分别为(7.27±1.55)%、(8.42±1.38)%和(11.55±1.39)%.(如表1).
表1 种子水解单宁含量
Tab. 1 Hydrolyzed tannins content of seeds
种子种类水解单宁含量/%
栓皮栎(7.27±1.55)a种子种类水解单宁含量/%锐齿槲栎(8.42±1.38)a种子种类水解单宁含量/%蒙古栎(11.55±1.39)b
注:数据以均值±标准差表示,不同种类种子标有相同字母表示没有显著差异(p>0.05),不同种类种子间标有不同字母表示存在显著差异(p<0.05).
经文献查阅,发现有些橡子的水解单宁含量较低(0~2%)[19],因此本试验将人工饲料的水解单宁含量设计为0、2%、7%与12%.使用试验鼠生长繁殖饲料(粉料)(购自江苏省协同医药生物工程有限责任公司)作为对照组饲料的原料.分别在粉料中加入水解单宁(购自天津市致远化学试剂有限公司),配置成0、2%、7%、12%水解单宁含量的人工饲料,加入蒸馏水压制成颗粒,60 ℃低温烘干制成对照组、低单宁组、中单宁组、高单宁组饲料.
1.3 笼养试验与取样
2022年6月16日至8月30日,在小鼠适应性饲养均无异常情况后进行干预试验.随机分为4组,每组18只(9只雌性,9只雄性)独笼饲养,分别用0、2%、7%、12%水解单宁含量的饲料饲养42 d,自由取食并供给充足饮水.期间每天早上8:00记录各组小鼠的存活率,将存活小鼠于饲养第42 d解剖取样.
解剖取样前,将小鼠在不禁止饮水的情况下禁食12 h,用质量分数2%戊巴比妥钠腹腔注射0.3 mL/100 g进行麻醉,麻醉后用进行心脏取血,血液保存于离心管并竖直静置于4 ℃冰箱8 h.静置后的血液在微型高速冷冻离心机4 ℃,3 000 r/min的条件下,离心10 min,吸取上层血清于新的离心管,保存于超低温冰箱(-80 ℃).脱颈处死小鼠后解剖,迅速取雌鼠卵巢和雄鼠睾丸.将卵巢与睾丸完全浸泡于盛有质量分数4%多聚甲醛溶液的离心管内固定,以便制作组织切片.
1.4 数据测定及统计分析
为适应检测范围,提高检测的灵敏度和准确性,将小鼠血清稀释5倍后用ELISA法测定血清中雌二醇、促黄体生成素、促卵泡生成素和睾酮的浓度.将卵巢和睾丸用石蜡切片法制作组织切片,HE染色后电子显微镜观察组织结构.使用单因素方差分析(One-way ANOVAs)分析小鼠存活率和生殖激素浓度.所有数据均采用SPSS 21进行分析,数据以均值±标准差表示,用Origin 8.0软件进行作图.
2 结果与分析
2.1 水解单宁对存活率的影响
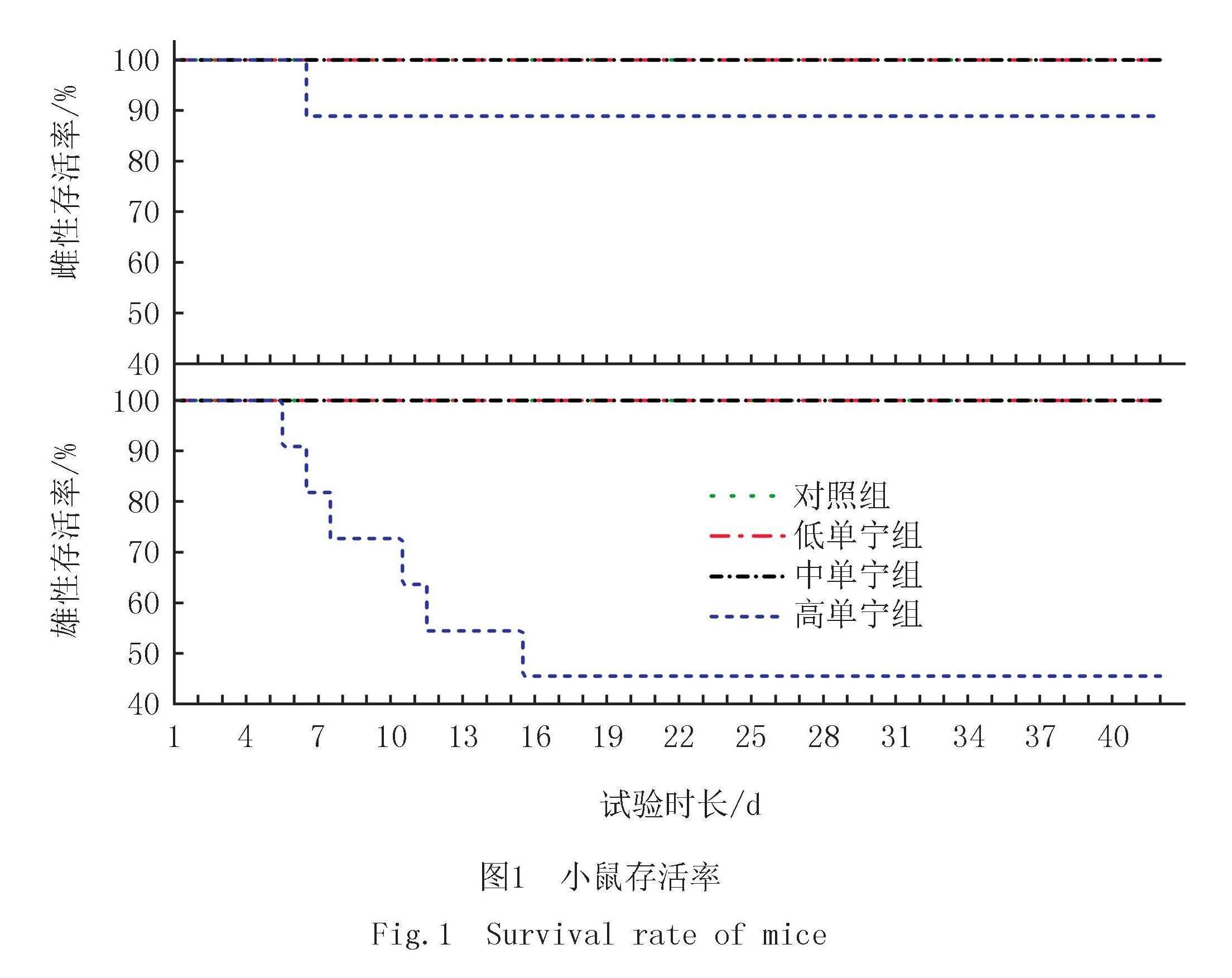
试验进行42 d后,对照组、低单宁组和中单宁组的存活率为100.0%,高单宁组出现了小鼠死亡现象,雌性高单宁组的存活率为88.9%,雄性高单宁组的存活率为45.5%(图1),水解单宁含量对雌性小鼠存活率无显著影响(p=0.751),对雄性小鼠存活率具有显著影响(p=0.037).这说明中、低含量水解单宁(2%和7%)的食物对小鼠没有致死性,而高含量水解单宁(12%)的食物对其则有致死作用,且雄鼠较雌鼠对水解单宁含量的变化更敏感.
2.2 水解单宁对生殖激素的影响
2.2.1 雌二醇(E2)
水解单宁含量对小鼠血清中E2稀释5倍后浓度存在显著影响(p<0.001).稀释5倍后雌鼠E2濃度最高的是对照组,其浓度为7.918 nmol/L,最低的是低单宁组,其浓度为5.039 nmol/L,中单宁组和高单宁组的E2浓度分别为5.472 nmol/L和5.681 nmol/L.雌鼠对照组与低单宁组(p<0.001)、中单宁组(p<0.001)和高单宁组(p<0.001)间存在显著差异(图2).稀释5倍后雄鼠E2浓度最低的是对照组,其浓度为4.002 nmol/L,最高的是低单宁组,其浓度为7.260 nmol/L,中单宁组和高单宁组的E2浓度分别为4.805 nmol/L和4.362 nmol/L.雄鼠低单宁组与对照组(p<0.001)、中单宁组(p<0.001)和高单宁组(p<0.001)间存在显著差异(图2).结果表明水解单宁对雌鼠的E2分泌有显著负效应,但低含量水解单宁能促进雄鼠E2的分泌.
2.2.2 促黄体生成素(LH)
水解单宁含量对雌鼠血清中LH稀释5倍后浓度存在显著影响(p=0.006).稀释5倍后雌鼠LH浓度最高的是低单宁组,其浓度为1.025 nmol/L,最低的是对照组,其浓度为0.589 nmol/L,而中单宁组和高单宁组LH浓度分别为0.709 nmol/L和0.769 nmol/L.雌鼠低单宁组与对照组(p=0.001)、中单宁组(p=0.008)和高单宁组(p=0.016)间存在显著差异(图3).水解单宁含量对雄鼠LH稀释5倍后浓度不存在显著影响(p=0.857)(图3),稀释5倍后雄鼠LH浓度最高的是高单宁组,其浓度为0.838 nmol/L,最低的是中单宁组,其浓度为0.774 nmol/L,而对照组和低单宁组的LH浓度分别为0.825 nmol/L和0.810 nmol/L.结果表明水解单宁对雄鼠LH浓度则无显著干扰,仅在低含量时促进雌鼠LH的分泌.
2.2.3 促卵泡生成素(FSH)
水解单宁含量对雌鼠血清中FSH稀释5倍后的浓度不存在显著影响(p=0.054)(图4).稀释5倍后雌鼠FSH浓度最高的是低单宁组,其浓度为9.094 nmol/L,最低的是对照组,其浓度为6.176 nmol/L,中单宁组和高单宁组的FSH浓度居分别为7.405 nmol/L和7.439 nmol/L.水解单宁含量对稀释5倍后雄鼠血清中FSH的浓度存在显著影响(p=0.039),稀释5倍后雄鼠FSH浓度最高的是低单宁组,其浓度为9.112 nmol/L,最低的是对照组,其浓度为5.995 nmol/L,中单宁组和高单宁组的FSH浓度分别为7.677 nmol/L和7.358 nmol/L,雄鼠对照组与低单宁组间存在显著差异(p=0.006)(图4).试验结果表明,水解单宁对雌鼠的FSH分泌无显著影响,但对雄鼠FSH的分泌有显著正效应.
2.2.4 睾酮(T)
水解单宁含量对小鼠血清中T稀释5倍后浓度存在显著影响(雌性p=0.028,雄性p<0.001).稀释5倍后雌鼠T浓度最高的是低单宁组,其浓度为3.228 nmol/L,最低的是对照组,其浓度为2.244 nmol/L,中单宁组和高单宁组的T浓度分别为2.649 nmol/L和2.482 nmol/L.雌鼠低单宁组与对照组(p=0.004)和高单宁组(p=0.015)间存在显著差异(图5).稀释5倍后雄鼠T浓度最高的是对照组,其浓度为3.285 nmol/L,最低的是低单宁组,其浓度为2.088 nmol/L,中单宁组和高单宁组的T浓度分别为3.089 nmol/L和2.661 nmol/L.雄鼠对照组与低单宁组(p=0.006)和高单宁组(p=0.033)间存在显著差异,低单宁组与中单宁组(p=0.001)和高单宁组(p=0.025)间存在显著差异(图5).结果显示,低含量的水解单宁促进雌鼠T的分泌,但水解单宁会降低雄鼠T的分泌.
2.3 水解单宁对生殖器官的影响
观察小鼠卵巢切片,发现与对照组相比,低单宁组卵巢中健康生长的卵泡数量无明显差异,且能观察到初级和次级卵泡(图6(a,b)),中、高单宁组初级卵泡数量、健康的生长卵泡数量减少,高单宁组闭锁卵泡数量增多且卵巢呈现萎缩状态(图6(c,d)).
观察小鼠睾丸切片,发现对照组与低单宁组生精小管状态相似(图7(a,b)),中、高单宁组观察到观察到多数生精小管呈空心管状,生精细胞层与腔内精细胞数量减少,且生精细胞排列杂乱(图7(c,d)).
3 讨 论
3.1 水解单宁与存活率
研究结果发现,食物中水解单宁含量的升高会降低小鼠的存活率,这与先前的研究结果一致[20].本研究新发现雄鼠相较于雌鼠对水解单宁的变化更加敏感,摄入高含量的水解单宁,雄鼠的死亡率更高.分析原因之一可能是由于雌性在生理周期时体内各激素水平变化,对雌性动物起到保护作用[21],另一种原因可能是单宁酸作为一种植物雌激素的衍生物,具有雌激素或抗雌激素活性[22],更易参与雌性生理调节过程.
3.2 水解单宁与生殖激素
E2是一种雌激素,具有促进卵泡发育和排卵,促进精子的产生,调节性激素的平衡及维持生殖器官的健康等作用[23].本研究结果显示雌鼠血清中的E2浓度随着食物中水解单宁含量的升高显著降低,而雄鼠的E2浓度仅在低单宁组表现为显著升高,其他组别无显著变化.E2在雌性体内主要由颗粒细胞和卵泡壁细胞分泌,在雄性体内主要由睾丸间质细胞分泌[24],且E2的代谢过程需要肝脏、肾脏、胆管与肠道参与[24].分析认为,雌鼠体内E2浓度降低主要由于高含量水解单宁造成卵巢的损伤导致的(图6),卵巢内正常发育的卵泡细胞减少直接导致E2的分泌量下降.而低含量水解单宁则促进了雄鼠睾丸的发育与睾丸间质细胞的生长[25],因此对雄鼠E2的分泌产生正效应.
LH和FSH都是由垂体前叶分泌的激素,二者共同作用,在雌鼠体内具有促进卵泡发育和排卵,促进雌激素的合成,以及生成和维持黄体等作用[26],在雄鼠体内具有促进睾丸间质细胞合成,促进睾酮合成,以及促进睾丸中精子发生的作用[27],二者经常联合检测以鉴别生殖疾病的类型.研究结果表明低含量水解单宁对小鼠LH或FSH分泌影响显著,而高含量水解单宁对小鼠体内二者分泌影响不显著(图3,图4).两种激素的分泌调控机制复杂,受到下丘脑-垂体-性腺轴控制,并通过负反馈机制进行调节,此外一些神经调节物质和激素也可以影响LH和FSH的分泌[28],因此水解单宁对小鼠LH和FSH的调节机制需结合生殖器官状态进一步分析.本研究发现,低含量水解单宁促进雌鼠T的分泌,但抑制了雄鼠T的分泌,伴随单宁含量的增加,雄鼠T浓度呈现不规则波动.
3.3 水解单宁与生殖器官
研究发现,高含量水解单宁对小鼠生殖器官产生了负面影响.具体而言,高含量水解单宁导致雌鼠卵巢萎缩,健康卵泡数量减少,闭锁卵泡数量增多,导致雄鼠生精小管呈现空心管状,生精细胞层与腔内精细胞数量减少,生精细胞排列杂乱.分析认为,当饮食中含有低含量的水解单宁时,鼠类可以通过调节体内生殖激素水平来维持其生殖器官的正常发育[29-30];当饮食中含有中等含量的水解单宁时,水解单宁的负面作用更加明显且鼠类的激素调节能力减弱,导致生殖器官与生殖细胞的正常发育受到抑制;当饮食中含有高含量的水解单宁时会表现出明显的抗营养效应,从而影响蛋白质的吸收率[31],此外,水解单宁易于吸收,高含量的水解单宁摄入会导致胃黏膜损伤和肝脏解毒负担,并对其他器官造成损伤,引起多器官衰竭.因此,低含量的水解单宁对生殖器官无明显影响;中等含量的水解单宁会抑制雌鼠卵泡和雄鼠精子的生长发育;高含量的水解单宁可能导致生殖器官早衰甚至萎缩,从而降低雌鼠受孕能力和雄鼠精子数量.
4 结论及展望
研究结果表明高含量水解单宁降低了鼠类存活率且具有性别差异,雄鼠的死亡率更高,进一步分析发现水解单宁干扰了生殖激素的互补性和综合作用,并对卵巢和睾丸造成损伤,下一步将针对雄鼠的精子质量及胚胎的生长发育进行深入研究.本研究仍存在一些不足之处,如水解单宁对野外鼠类与小鼠影响的差异性,子代的出生率与存活率对鼠类数量的影响等尚未探究.未来可探索更大时空尺度上橡子单宁酸含量的年际变化和鼠类种群数量波动规律,在水解单宁与子代性别比例、生殖毒性、乳汁营养和长期效應的影响方面仍然需要大量研究.
参 考 文 献
[1] JULIANO S A.Food limitation of reproduction and survival for populations of Brachinus(Coleoptera:Carabidae)[J].Ecology,1986,67(4):1036-1045.
[2]STEELE M A,YI X F.Squirrel-seed interactions:the evolutionary strategies and impact of squirrels as both seed predators and seed dispersers[J].Frontiers in Ecology and Evolution,2020,8:259.
[3]NAZARENO A G,KNOWLES L L,DICK C W,et al.By animal,water,or wind:can dispersal mode predict genetic connectivity in riverine plant species?[J].Frontiers in Plant Science,2021,12:626405.
[4]YANG X F,YAN C,GU H F,et al.Interspecific synchrony of seed rain shapes rodent-mediated indirect seed-seed interactions of sympatric tree species in a subtropical forest[J].Ecology Letters,2020,23(1):45-54.
[5]VANDER WALL S B.How plants manipulate the scatter-hoarding behaviour of seed-dispersing animals[J].Philosophical Transactions of the Royal Society of London Series B,Biological Sciences,2010,365(1542):989-997.
[6]ZHANG Y H,BARTLOW A W,WANG Z Y,et al.Effects of tannins on population dynamics of sympatric seed-eating rodents:the potential role of gut tannin-degrading bacteria[J].Oecologia,2018,187(3):667-678.
[7]ALJBORY Z,CHEN M S.Indirect plant defense against insect herbivores:a review[J].Insect Science,2018,25(1):2-23.
[8]BERAN F,KLLNER T G,GERSHENZON J,et al.Chemical convergence between plants and insects:biosynthetic origins and functions of common secondary metabolites[J].The New Phytologist,2019,223(1):52-67.
[9]BONELLI F,TURINI L,SARRI G,et al.Oral administration of chestnut tannins to reduce the duration of neonatal calf diarrhea[J].BMC Veterinary Research,2018,14(1):227.
[10]CHOI J,LIU G C,GOO D,et al.Effects of tannic acid supplementation on growth performance,gut health,and meat production and quality of broiler chickens raised in floor pens for 42 days[J].Frontiers in Physiology,2022,13:1082009.
[11]劉汉锁,龙沈飞,尚庆辉,等.水解单宁酸的作用机制及其在畜禽生产中的应用进展[J].动物营养学报,2019,31(9):3991-3999.
LIU H S,LONG S F,SHANG Q H,et al.Mechanism of action hydrolyzed tannic acid and its application in livestock and poultry production[J].Chinese Journal of Animal Nutrition,2019,31(9):3991-3999.
[12]WANG M W,HUANG H J,HU Y P,et al.Effects of dietary microencapsulated tannic acid supplementation on the growth performance,intestinal morphology,and intestinal microbiota in weaning piglets[J].Journal of Animal Science,2020,98(5):skaa112.
[13]DO CARMO M A V,FIDELIS M,DE OLIVEIRA P F,et al.Ellagitannins from jabuticaba(Myrciaria jaboticaba) seeds attenuated inflammation,oxidative stress,aberrant crypt foci,and modulated gut microbiota in rats with 1,2 dimethyl hydrazine-induced colon carcinogenesis[J].Food and Chemical Toxicology,2021,154:112287.
[14]MANZOOR F,NISA M U,HUSSAIN H A,et al.Effect of different levels of hydrolysable tannin intake on the reproductive hormones and serum biochemical indices in healthy female rats[J].Scientific Reports,2020,10(1):20600.
[15]SPINACI M,MUCCILLI V,BUCCI D,et al.Biological effects of polyphenol-rich extract and fractions from an oenological oak-derived tannin on in vitro swine sperm capacitation and fertilizing ability[J].Theriogenology,2018,108:284-290.
[16]SPINACI M,BUCCI D,MUCCILLI V,et al.A polyphenol-rich extract from an oenological oak-derived tannin influences in vitro maturation of porcine oocytes[J].Theriogenology,2019,129:82-89.
[17]YIN Z,SUN J T,CUI H D,et al.Tannin supplementation improves oocyte cytoplasmic maturation and subsequent embryo development in pigs[J].Antioxidants,2021,10(10):1594.
[18]HARPER J M,LEATHERS C W,AUSTAD S N.Does caloric restriction extend life in wild mice?[J].Aging Cell,2006,5(6):441-449.
[19]李園,沈友笔,王明卉,等.鼠类对栓皮栎和锥栗种子的贮藏:验证高单宁假说[J].兽类学报,2021,41(3):338-343.
LI Y,SHEN Y B,WANG M H,et al.Seed-hoarding preferences of rodents for cork oak(Quercus variabilis) and Henry's chestnut(Castanea henryi):testing the high-tannin hypothesis[J].Acta Theriologica Sinica,2021,41(3):338-343.
[20]钟亮,余义博,朱红娟,等.单宁酸对青海田鼠食物摄入量与小肠结构的影响[J].草业科学,2021,38(3):562-570.
ZHONG L,YU Y B,ZHU H J,et al.Effects of tannic acid on food intake and micro-morphology of the small intestine in Lasiopodomys fuscus[J].Pratacultural Science,2021,38(3):562-570.
[21]张萌萌.雌激素与雌激素受体骨代谢调节作用[J].中国骨质疏松杂志,2019,25(5):704-708.
ZHANG M M.Estrogen and estrogen receptors on bone metabolism regulation[J].Chinese Journal of Osteoporosis,2019,25(5):704-708.
[22]FRAGA C G,GALLEANO M,VERSTRAETEN S V,et al.Basic biochemical mechanisms behind the health benefits of polyphenols[J].Molecular Aspects of Medicine,2010,31(6):435-445.
[23]MIRAOUI H,DWYER A A,SYKIOTIS G P,et al.Mutations in FGF17,IL17RD,DUSP6,SPRY4,and FLRT3 are identified in individuals with congenital hypogonadotropic hypogonadism[J].American Journal of Human Genetics,2013,92(5):725-743.
[24]SIMPSON E R,CLYNE C,RUBIN G,et al.Aromatase:a brief overview[J].Annual Review of Physiology,2002,64:93-127.
[25]LIU J,LI J,LIANG J,et al.Low-dose tannic acid modulates testicular development,spermatogenesis,and reproductive hormone synthesis in immature rats[J].Food Funct,2020,11(6):5195-5203.
[26]王晨,汪娟,杨凤娜,等.中成药联合米非司酮治疗子宫肌瘤的网状Meta分析[J].中草药,2022,53(21):6820-6831.
WANG C,WANG J,YANG F N,et al.Network Meta-analysis of Chinese patent medicine combined with mifepristone in treatment of uterine fibroid[J].Chinese Traditional and Herbal Drugs,2022,53(21):6820-6831.
[27]VELDHUIS J D,ROEMMICH J N,RICHMOND E J,et al.Somatotropic and gonadotropic axes linkages in infancy,childhood,and the puberty-adult transition[J].Endocrine Reviews,2006,27(2):101-140.
[28]PINILLA L,AGUILAR E,DIEGUEZ C,et al.Kisspeptins and reproduction:physiological roles and regulatory mechanisms[J].Physiological Reviews,2012,92(3):1235-1316.
[29]陳静,尤瑞国,刘慧敏,等.柠檬醛对小鼠生长性能、肌内脂肪含量及脂肪酸代谢酶的影响[J].河南农业大学学报,2021,55(4):721-726.
CHEN J,YOU R G,LIU H M,et al.Effects of citral on growth performance,intramuscular fat content and fatty acid metabolizing enzymes in mice[J].Journal of Henan Agricultural University,2021,55(4):721-726.
[30]BIONDI L,RANDAZZO C L,RUSSO N,et al.Dietary supplementation of tannin-extracts to lambs:effects on meat fatty acids composition and stability and on microbial characteristics[J].Foods,2019,8(10):469.
[31]D'ARCHIVIO M,FILESI C,VAR R,et al.Bioavailability of the polyphenols:status and controversies[J].International Journal of Molecular Sciences,2010,11(4):1321-1342.
Effects of long-term consumption of hydrolyzed tannin on the reproductive of rodents
Yu Fei, Li Jiaxin
(College of Life Sciences, Henan Normal University, Xinxiang 453007, China)
Abstract: Hydrolyzed tannin, the predominant type of tannic acid in acorns, has a significant impact on the survival and reproduction of rodents that primarily feed on acorns. The aim of this experiment was to explore the impact of long-term hydrolyzed tannin consumption on the reproductive hormones and reproductive organs of rodents. 72 four-week-old healthy Kunming mice(36 males and 36 females) and randomly divided them into four groups:control group(with 0% hydrolyzable tannin content), low-tannin group(with 2% hydrolyzable tannin content), medium-tannin group(with 7% hydrolyzable tannin content), and high-tannin group(with 12% hydrolyzable tannin content). After being fed with different levels of hydrolyzable tannin-containing diets for 42 days, the mice were dissected for sampling. The results showed that:High levels of hydrolyzed tannin significantly reduced the survival rate of male mice. Moderate to high levels of hydrolyzed tannin had a negative impact on the stable production of reproductive hormones. High levels of hydrolyzed tannin caused damage to the reproductive organs, leading to changes in the physiological structure of the ovaries and testes in mice, and a reduction in the number of normal follicles and spermatogenesis. The experiment confirmed that long-term intake of high levels of hydrolyzed tannins disrupted the hormonal balance of rodents and caused damage to their reproductive organs.
Keywords: sperm quality; Kunming mice; hydrolyzed tannin; reproductive toxicity; reproductive hormones
[责任编校 刘洋 杨浦]
