沿黄稻区土壤菌群结构与生态功能研究
2024-05-15田莹莹郭琦陈星儒孙向辉赵京
田莹莹 郭琦 陈星儒 孙向辉 赵京

摘 要:为了解沿黄稻区不同基质土壤的微生物组成,采集了河滩砂质土壤(sand soil,SS)和毗邻稻田土壤(paddy soil,PS).利用16S rRNA基因高通量测序技术揭示沿黄稻区土壤菌群的组成及其潜在的生态功能.Alpha多样性分析显示两种土壤的菌群丰富度和多样性指数无显著性差异.进一步的物种组成分析,发现unclassified_f Micrococcaceae、鞘氨醇单胞菌属(Sphingomonas)、norank_f noorank_o Vicinamibacterales、norank_f Vicinamibacterales在SS和PS中广布,与土壤基质类型无关丰度,但芽孢杆菌属(Bacilllus)、硫杆菌属(Thiobacillus)在PS中的相对丰度显著高于SS.基于FAPROTAX数据库的功能热图分析显示PS(尤其是P2_1、P3_1)中芳香烃降解功能序列的相对丰度高于SS,结合菌群相对丰度结果推测类诺卡氏菌属(Nocardioides)、unclassified_f_Nocardioidaceae是该差异产生的关键.SS中光养微生物丰度显著高于PS,尤以卟啉杆菌(Porphyrobacter)、unclassified_f_Rhodobacteraceae、红细菌(Rhodobacter)为主的不产氧光合细菌的丰度较高,其中红细菌科(Rhodobacteraceae)是参与SS生物膜形成的重要微生物.研究表明土壤类型对沿黄稻区菌群组成有一定的影响,并驱动了菌群生态功能分异的形成.
关键词:壤菌群结构;生态功能;稻田土壤;砂质土壤
中图分类号:S158 文献标志码:A文章编号:1000-2367(2024)03-0139-11
河南沿黄稻区每年经历湿地田、旱地的两熟制管理方式,常年的稻麦轮作方式,人为干扰强烈,土壤有机质含量较高[1].黄河滩地为砂质土壤,有机质含量相对较低,人为干扰少,每年7至10月的黄河主汛期,多数滩地被季节性淹没[2],其他时间河床裸露干燥,呈旱地特征,并着生以莎草科为主的湿生草本植物.黄河滩地与毗邻稻田具有相似的干湿交替周期,但二者又有截然不同的土地管理方式,主要是黄河滩地取样点位于近河岸处,受上游来水影响大,且无耕作历史.因此,上述两种土样可为微生物菌群与生态功能研究提供良好的材料.
土壤微生物在生态系统物质循环和能量转化过程中发挥着重要作用,其中微生物群落结构与土壤性质互为影响.土地利用方式可以改变土壤质量和养分循环,又进一步影响着土壤微生物组成[3].不稳定有机碳是维持土壤微生物群落的重要功能性環境因子,并影响着土壤有机碳变化和贮存[4].河岸土地利用类型的不同也会导致土壤微生物群落组成差异,其中土壤硝酸盐(NO-3)和水分含量是参与氮循环微生物群落的主要驱动因素[5].农业、非农业用地与原生草地相比,其共存的微生物在群落结构和功能上有所不同[6].植被类型不同,如以小麦、玉米替代向日葵单作也会显著影响根际微生物群落组成[7].JANGID等[8]研究发现,湿地转变为农田后引起细菌丰度和种类的显著变化,并确定土地利用变化是微生物群落组成的主要决定因素.微生
收稿日期:2023-06-02;修回日期:2023-09-08.
基金项目:国家自然科学基金(21906041);河南省科技攻关项目(232102320100,212102310079);河南省高等学校重点科研项目(21A610003);河南工学院博士基金项目(9001/KQ1811).
作者简介(通信作者):田莹莹(1988-),女,河南许昌人,河南工学院讲师,博士,研究方向为污染控制与生态修复研究,E-mail:tyy@hait.edu.cn.
引用本文:田莹莹,郭琦,陈星儒,等.沿黄稻区土壤菌群结构与生态功能研究[J].河南师范大学学报(自然科学版),2024,52(3):139-149.(Tian Yingying,Guo Qi,Chen Xingru,et al.Soil microbial community structure and eco-function in the rice zone along the Yellow River[J].Journal of Henan Normal University(Natural Science Edition),2024,52(3):139-149.DOI:10.16366/j.cnki.1000-2367.2023.06.02.0007.)
物参与特定的土壤生化反应[9],反过来影响土壤生态系统的多功能性[10-12],包括土壤养分循环、植物生长、温室气体产生等方面.研究表明,氨氧化细菌在农业生态系统的硝化过程中起主导作用[5].水稻-蔬菜长期轮作导致土壤微生物组结构均匀化,微生物的硝化和反硝化能力增加,潜在的N2O排放增加[9].研究显示,微生物多样性受土地利用类型改变的影响较小,而微生物组成和结构对土地利用类型的响应相对更敏感[6,13].在黄河流域生态保护和高质量发展背景下,从机理上科学认识沿黄稻区土壤微生物群落结构与生态功能有助于更好地理解土壤内部物质循环过程与驱动机制,对于制定科学合理的农田可持续发展模式起着至关重要的作用.
本研究以沿黄流域(原阳段)黄河滩地和稻田土为研究对象,利用高通量测序技术揭示沿黄稻区菌群结构、多样性和差异物种,并基于BugBase、FAPROTAX数据库预测菌群表型和功能.研究结果为认识和理解沿黄稻区土壤微生物、功能及元素循环机制提供重要参考.
1 材料和方法
1.1 研究区域及土壤样品的采集
于2021年11月初采用梅花形5点采样法采集位于河南省原阳县沿黄稻区表层1 cm的嫩滩砂质土(sand soil,SS; 34°55′1.59″ E,113°40′25.01″ N)和稻田土(paddy soil,PS; 35°01′28.442″ E, 113°39′45.714″ N).每个土壤类型采集3个点,其中SS样品记为S1_1、S2_1和S3_1,PS样品记为P1_1、P2_1和P3_1.采样点S1_1距离河岸约200 m(有植被覆盖),S2_1距离河岸约50 m(有0.5 cm淤泥层覆盖),S3_1为近河岸约1 m(受黄河水涨落影响最大).PS采样点距河岸直线距离约12 km,各点间直线距离100 m.在水稻地上部分收割后采样,采集时尽量避开植株根系.所有土壤样品采集后立即放置在冷藏箱中保存,并及时运回实验室分析,其中用于土壤理化性质分析的土样置于4 ℃暂存并于48 h内分析完毕,用于高通量测序的样品在处理前置于-80 ℃冰箱保存.
1.2 土壤理化性质的测定
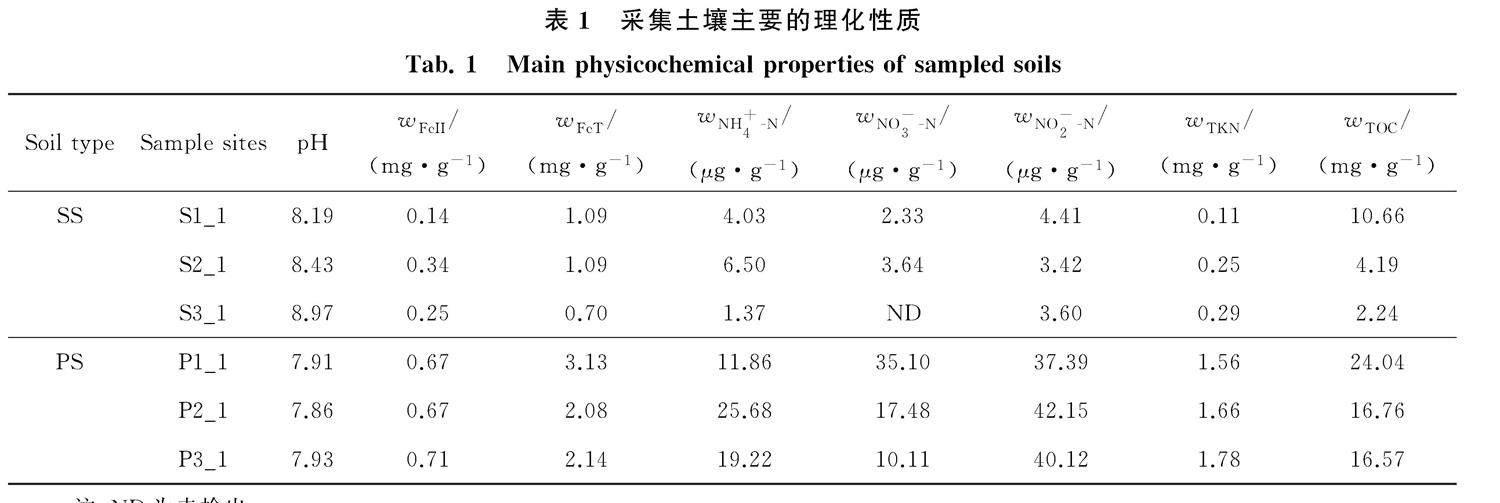
取适量风干土样,采用水土质量比2.5∶1,摇床振荡30 min,静置后用便携式pH计测定土壤pH值.土壤中的二价铁(FeII)采用邻菲罗啉比色法测定,总铁(FeT)利用盐酸羟胺还原后采用邻菲罗啉比色法测定.土壤总有机碳(TOC)采用湿式重铬酸钾分光光度法测定.土壤铵态氮(NH+4-N)、硝态氮(NO-3-N)、亚硝态氮(NO-2-N)的测定利用2 mol/L KCl溶液浸提,其中NH+4-N采用靛酚蓝比色法,NO-3-N采用紫外分光光度法,NO-2-N采用磺胺/盐酸萘乙二胺分光光度法测定.土壤全氮(TKN)利用凯氏定氮法测定[14].
1.3 DNA的提取,PCR扩增与高通量测序
按E.Z.N.A.soil DNA kit(Omega Bio-tek,Norcross)试剂盒说明书步骤提取基因组DNA,使用NanoDrop 2000超微量蛋白质核酸分析仪(Thermo Fisher Scientific,USA)测定提取出的DNA浓度和纯度.将提取好的DNA样品利用16S rRNA基因V3-V4区扩增引物进行PCR扩增,引物序列为338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3').使用质量分数2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City)进行回收产物纯化.
纯化后的产物送至上海美吉生物医药科技有限公司,使用Illumina Miseq PE300平台进行高通量测序和分析.使用NEXTFLEX Rapid DNA-Seq Kit进行建库.使用Fastq软件对原始测序序列进行质控,并用Flash软件进行拼接.使用Qiime2(v2020.2)软件,利用DADA2算法对序列进行ASV聚类并剔除嵌合体.基于Silva 16S rRNA 数据库(v138),利用RDP classifier贝叶斯算法对ASV代表序列进行物种分类学注释(置信度阈值0.7),获得物种分类学注释结果.各样品的16S rRNA基因测序结果上传至国家微生物科学数据中心(https://nmdc.cn/),登录号NMDC40024174~NMDC40024179.
1.4 数据分析
基于细菌群落及土壤理化因子数据利用R语言Psych数据包绘制相关性热图.基于美吉云平台,利用ggplot 2包绘制物种丰度图,利用Kruskal-Wallis秩和检验、多重比较方差分析检验菌群的alpha多样性,利用主坐标分析(PCoA)、Bray-Curtis距离进行beta多样性分析,与BugBase数据库比对预测微生物表型;并与FAPROTAX数据库比对预测优势菌属的功能.
2 结果和分析
2.1 沿黄滩地和稻田土主要理化性质
对比SS和PS的主要理化性质,发现除pH外,PS中的FeII、FeT、NH+4-N、NO-3-N、NO-2-N、TKN和TOC的含量均显著高于SS.PS中pH的平均值为7.90,低于SS的8.53.研究表明,土壤有机质含量有随pH升高而降低的趋势,二者间呈极显著的负相关关系(R =-0.530~-0.332,P<0.001).本研究中,TOC与pH显著负相关(R=-0.881,P=0.02).
2.2 沿黄滩地和稻田土中菌群结构
将16S rRNA基因测序结果(去除叶绿体和线粒体)按样本最小序列数抽平,构建ASV集(ASV_all).将相对丰度小于0.01的Genus合并,共有60属.alpha多样性指数反应群落内物种数量及其相对丰度,有丰富度指数(如Chao指数)和物种多样性指数(如Shannon、Simpson指数)等.Chao指数值越高,说明物种数目较多;Shannon指数值越高,说明群落多样性越高;Simpson指数值越高,则说明群落多样性越低.分析表明(图1),SS物种数目较多而多样性低,但二者的3个指数值均无显著性差异(P>0.05).对微生物组beta多样性以主坐标分析(PCoA)进行计算并可视化.SS各点分散,PS各点距离近,表明SS的群落结构差异较大,而PS的菌群组成较为相似,这与SS样点间生境差异大有关.主成分轴PC1和PC2分别解释了49.24%和23.06%的结构差异(图2).
去除至少在4个样本中相对丰度都小于0.001 7的ASV,得到相对丰度前35的属,以此绘制相对丰度热图(图3(a)),其中前35属在总序列中的平均相对丰度为0.439 4±0.030 4.由于S1_1、S2_1、S3_1样点理化性质(如NH+4-N、TOC、pH等)差异较大,使得SS中组成物种的重现性不如PS高.两种类型土壤中的优势细菌在门水平上都分属于放线菌门(Actinobacteriota)和变形菌门(Proteobacteria),且相对丰度无差异.属水平上,菌群的相对丰度有所不同.Unclassified_f Micrococcaceae、鞘氨醇单胞菌属(Sphingomonas)、norank_f noorank_o Vicinamibacterales和norank_f Vicinamibacterales为土壤中的广布属,相对丰度与土壤类型无关.SS中unclassified_f_Planococcaceae、黄杆菌属(Flavobacterium)、副球菌属(Paracoccus)、unclassified_f_Comamonadaceae、红细菌属(Rhodobacter)、Nodosilinea_PCC_7104相对丰度高于PS;PS中類诺卡氏菌属(Nocardioides)、unclassified_f_Nocardioidaceae、硫杆菌属(Thiobacillus)、unclassified_f_Intrasporangiaceae、芽孢杆菌属(Bacillus)、norank_f_Anaerolineaceae、norank_f_Caldilineaceae、norank_f_norank_o_SJA-15、norank_f_norank_o_norank_c_MB-A2-108、Gaiella、norank_f_Sutterelleaceae相对丰度高于SS(图3(b)).norank_f_Anaerolineaceae、norank_f_Caldilineaceae、norank_f_norank_o_SJA-15、norank_f_norank_o_norank_c_KD4_96属绿弯菌门(Chloroflexi),在PP中的丰度显著高于SS.Chlorolema也为Chloroflexi中的一属,但仅在S1_1中有较高的相对丰度.此外,Porphyrobacter、Unclassified_f_Rhodobacteraceae、Rhodobacter作为不产氧光合细菌,能通过H2、硫化物、FeII等还原物质提供电子供体还原CO2进行光合自养生长,因而在低有机质的SS中呈现较高的相对丰度.
进一步地用线性判别(LEfSe)分析确定了组间属水平上丰度差异显著的21属(P<0.05).如附录图S1,norank_f_Caldilineaceae、norank_f_norank_o_SJA-15、norank_f_Anaerolineaceae、norank_f_norank_o_norank_c_KD4_96、norank_f_Steroidobacteraceae、norank_f_Sutterellaceae、Thiobacillus等的丰度在PS中显著高于SS,而unclassified_f_Comamonadaceae、norank_f_Rhizobiales_Incertae_Sedis、Porphyrobacter、unclassified_f_Rhodobacteraceae、Paracoccus、微小杆菌属(Exiguobacterium)、unclassified_f_Planococcaceae、Flavobacterium等的丰度在PS中显著低于SS.
2.3 细菌优势组成物种功能预测分析
BugBase表型预测结果显示,35个土壤优势菌属涵盖了全部7个类型的微生物群落,除厌氧、生物膜形成外的其他功能菌的比例在SS和PS之间无显著性差异(图4(a)).选取与生物膜形成和氧需求相关的类型分析各自组成细菌的贡献度,如图4(b-e)).科水平上,土壤优势菌中的严格厌氧菌包括norank_o Vicinamibacterales、Vicinamibacteraceae,其在PS中相对丰度显著高于滩地土.鞘脂单胞菌科(Sphingomonadaceae)、类诺卡氏菌科(Nocardioidaceae)、norank_o_norank_c_MB-A2-108、Rhizobiales_Incertae_Sedis为两种土壤中贡献度前四的好氧菌.相对优势兼性厌氧菌包括微杆菌科(Microbacteriaceae)、嗜氢菌科(Hydrogenophilaceae)、红细菌科(Rhodobacteraceae),其中Hydrogenophilaceae在PS中相对丰度高,Rhodobacteraceae在SS中相对丰度高,并是参与SS生物膜形成的重要类群.
为研究土壤优势菌属在生物地球化学循环中的作用,利用FAPROTAX预测确定了12个功能类群(图5).它们主要参与土壤碳、硫元素的转化和提供能量,其中化能异养型、需氧化能异养型功能类群占绝对优势.氧化硫和硫化物的类群在两种土壤中的比例差异显著(P<0.01),其他类群无差异.此外,P2_1,P3_1中具PAHs降解功能的细菌比例相对升高.S3_1中光养生物占优势,包括光合自养和光合异养两类,分别为能产生氧气的蓝藻(主要是浮丝藻属)和不产生氧气的光合细菌(主要是Porphyrobacter、unclassified_f_Rhodobacteraceae、Rhodobacter)贡献,尤以光合异养功能细菌为主.
3 讨 论
3.1 沿黄流域土壤细菌群落结构分析
本研究中SS与PS的土壤类型不同,孕育了某些特定的微生物类群.SS中unclassified_f_Planococcaceae的优势序列(ASV2)与动球菌属(Planococcus sp.)相似性高.Planococcus为好氧菌,GAN等[15]从盐碱土壤中分离得到的Planococcus最适pH为9.0.SS为砂质土,透气性良好,pH值接近9.0,可能是unclassified_f_Planococcaceae相对丰度高的关键.Paracoccus广泛存在于多种生境,对土壤中多环芳烃(PAHs)、邻苯二甲酸二甲酯等污染有较好的降解作用[16-17].脱氮副球菌(Paracoccus denitrificans)是Paracoccus的模式种,也是重要的土壤好氧反硝化菌.SS中Paracoccus丰度高于PS,说明SS可能形成独特的环境,较OMs丰富、N源充足的PS更适宜Paracoccus的生长繁殖.Flavobacterium也是两种类型土壤中的差异物种.研究发现,Flavobacterium是土壤中鱼腥藻属(Anabaena sp.)PCC7120的重要伴生菌,具有适应寡营养的特性,可能是SS中相对丰度高的原因之一[18].
PS中类诺卡氏菌Nocardioides、Bacillus、Thiobacillus丰度显著高于SS.土壤中Nocardioides的某些种参与N、S元素循环[19-20].Bacillus是水稻田常见的组成微生物[21-22].枯草芽孢杆菌(Bacillus subtilis)DBM与矿物成分(高岭石、针铁矿)形成的复合体提高了矿物本身对铜(Cu)和铅(Pb)的吸附能力,并保护了DBM免受重金属毒害[23].Thiobacillus是自然生境中重要的化能自养菌,主要参与氧化硫化物(H2S,S2O2-3)或单质硫为硫酸.本研究中Thiobacillus与pH极显著负相关(P<0.01),与FeII、FeT正相关(P<0.05),表明偏酸性環境和高含量FeII会更适宜氧化亚铁硫杆菌(Thiobacillus ferrooxidans)生存,说明T. ferrooxidans可能是Thiobacillus中的优势种之一.此外,Thiobacillus与NH+4-N显著正相关,其优势序列ASV42与环境样本中一反硝化Thiobacillus(登录号MG801484.1)相似性(>99%)高,说明ASV42可能具有脱N作用.因此,推测T. ferrooxidans、T. denitrificans是本研究中Thiobacillus的重要组成物种.此外,Bacillus、Thiobacillus是重要的发酵型铁环原微生物[24],有效改善石灰性土(pH 7.5~8.5)缺铁状况[25].土壤中Thiobacillus丰度可直接影响C、N、Fe、S元素转化.Thiobacillus是PS中的优势菌,因此在稻田干湿周期中Thiobacillus与土壤元素转化的关系的研究对稻田的精细化管理具有重要的指导意义.
光养微生物有光合产氧和光合不产氧两类.与PS相比,SS中光合自养微生物总的相对丰度高,其中又以光合不产氧细菌的丰度占优势.SS中Symphothece PCC 702、Planthorix为光合产氧细菌,Chloronema、Rhodobacter和unclassified_f_Rhodobacteraceae为厌氧不产氧光合细菌.研究发现,Porphyrobacter属中也包含有好氧不产氧的光合类群[26].SS中Porphyrobacter、Chloronema、Rhodobacter和unclassified_f_Rhodobacteraceae相对丰度高,主要是因为光辐射作用下,它们能以H2、硫化物、FeII等还原物质提供的电子供体还原CO2光合自养生长,因而在有机质低的滩地环境中较异养代谢微生物呈现出一定的生存优势.Rhodobacter是稻田土中常见的优势光合细菌,大多能随外界氧气、有机质浓度的改变进行好氧、微需氧或光合厌氧代谢[27].C是植物必需的六种大量元素之首.土壤中的C固存与土壤肥力密切相关.光氧微生物是土壤有机碳的重要生产者.为提高沿黄稻田有机碳含量,结合测序结果,可在沿黄稻田干湿周期分别接种好氧Porphyrobacter和厌氧Chloronema、Rhodobacter实现生物固碳以减少外源有机肥使用量.
3.2 土壤优势物种的功能及生物地球化学作用
土壤菌群组成与其环境适应性有关,并影响着生境内元素的生物地球化学循环.基于BugBase表型预测的结果显示,优势菌属包括了全部的7类表型.严格厌氧功能菌是PS和SS中的重要差异类群,具体为,norank_o Vicinamibacterales、Vicinamibacteraceae在PS中相对丰度显著高于SS.Microbacteriaceae、Hydrogenophilaceae、Rhodobacteraceae是优势兼性厌氧菌,此外,Rhizobiales_Incertae_Sedis、Rhodobacteraceae与生物膜形成相关,它们在SS中的相对丰度均高于PS.基于FAPROTAX数据库预测确定了12个功能类群,它们主要参与土壤碳、硫等的转化和提供能量.化能异养和需氧化能异养型微生物在总微生物类群中占绝对优势.氧化硫和硫化物的微生物在两类土壤中的比例有极显著差异.SS中光养微生物的相对丰度普遍高于PS,尤以S3_1(Porphyrobacter、unclassified_f_Rhodobacteraceae、Rhodobacter构成)为最高.光合自养微生物的存在提高了光能利用率,供给了部分有机碳源,对维持生境内稳定的菌群结构起重要作用.PS中具硫、硫化物氧化和PAHs降解功能的微生物的比例也相对较高.T. ferrooxidans、T. denitrificans为Thiobacillus的重要组成物种,通过代谢硫和硫化物影响体系内Fe、N元素的转化.微生物降解作用是环境中PAHs去除的主要途径[28].与焦化厂污染的荒地相比,农田土壤理化特性增加了PAHs降解菌和总细菌群落的多样性,与低分子量PAHs相关的降解菌主要隶属于变形杆菌,与高分子PAHs相关的降解菌主要隶属于放线菌[28].FAPROTAX功能热图分析结果显示,PS(尤其是P2_1、P3_1)中PAHs降解功能微生物的相对丰度高于SS.Sphingomonas生境广,适应性强,对复杂结构的难降解芳香化合物有特异作用,在生物聚合物的生产方面有优越性.本研究中Sphingomonas丰度在两种不同利用方式的土壤中无显著性差异,说明PS中可能有其他的具芳香烃功能的微生物存在.研究发现,农业土壤中Nocardioides也是具降解PAHs功能的微生物的重要类群之一[29].本研究中Nocardioides、unclassified_f_Nocardioidaceae在P2_1、P3_1中的相对丰度显著高于其他样点,与PAHs降解功能的热图分析结果一致,表明Nocardioides、unclassified_f_Nocardioidaceae可能是促使PAHs降解的关键类群.
unclassified_f Micrococcaceae为两种类型土壤中的绝对优势属.本研究中unclassified_f Micrococcaceae的优势代表序列ASV1和ASV3与节杆菌属(Arthrobacter sp.)相似性達100%.Arthrobacter菌株严格好氧,具有高效降解有机污染物和吸附重金属的能力[30].Arthrobacter sp.ADH-2在10 h内对100 mg/L阿特拉津的降解率为99.9%[31].研究显示,unclassified_f Micrococcaceae是健康与发病烟田微生物的主要差异物种之一,在健康烟田土壤中的相对丰度是发病土壤的2倍[32].此外,unclassified_f Micrococcaceae也是间作甘蔗植株中特有的内生菌之一[33].
生态系统中存在多元素的耦合作用,因此,参与碳、硫等元素代谢的微生物往往也介导了生境内的N转化过程.Paracoccus denitrificans厌氧条件下以H2作为电子供体,利用CO2、HCO-3等无机碳源,还原硝酸盐到亚硝酸盐到氧化氮(NO、N2O)和N2[34].该过程是生物地球化学氮循环中重要的反硝化反应,方程式为:①5H2+2NO-3→N2+4H2O+2OH-;H2+0.35NO-3+0.35H++0.052CO2→0.17N2+1.1H2O+0.010C5H7O2N[34].好氧条件下,P. denitrificans对溶解性硝酸盐、亚硝酸盐的去除以同化作用为主,少部分经由反硝化作用去除[35].学者们也发现了同时具有异养硝化-好氧反硝化功能的菌株,为P. denitrificans用于废水短程脱氮提供参考[36].某些Rhodobacter菌株以NO-3-N为电子受体,有机碳源为电子供体光合异养生长,是沉积物中一种关键的反硝化菌[37].研究报道,Rhodobacter是汾河下游水体中nir S型反硝化细菌群落的3个主导菌属之一,在下游某些采样点的相对丰度可高于98%,其相对丰度与NO-3-N负相关[38].本研究中Rhodobacter与NO-3-N也显著负相关,说明所调查区域的Rhodobacter中可能存在反硝化脱氮菌株.T. denitrificans利用元素硫为电子供体从水生环境中去除NO-3,是重要的硫自养反硝化菌.溶解性有机质作为一种微生物光敏剂驱动T. denitrificans发生光电反硝化反应[39].
4 结 论
本研究利用高通量测序技术揭示了沿黄稻区SS和PS土样中的菌群结构、多樣性及差异物种,发现两种土样中的菌群丰富度和多样性指数差异不显著,但部分菌群相对丰度差异显著.unclassified_f Micrococcaceae、Sphingomonas为土壤中的广布种;Bacilllus、Thiobacillus在PS中的相对丰度显著高于SS;PS中光合细菌的相对丰度则显著低于SS.特别地,与硫代谢相关的Thiobacillus,推测主要由T. denitrificans和T. ferrooxidans组成,而Rhodobacteraceae则是土壤优势菌属中重要的促生物膜形成微生物.基于BugBase、FAPROTAX数据库的菌群表型和功能预测结果显示,SS和PS均包括了7类表型和12类地化循环相关微生物,其中厌氧、氧化硫或硫化物功能的类群在土壤中的相对丰度差异显著.
但本研究样本量较少,对SS和PS土壤微生物的差异性认识可能不全面.未来,需要更全面的研究以揭示土壤类型、土地利用方式等影响下的微生物群落结构与功能.
附录见电子版(DOI:10.16366/j.cnki.1000-2367.2023.06.02.0007).
参 考 文 献
[1] 孙建权,胡宁,王书玉,等.水稻旱直播高产栽培技术初探[J].种业导刊,2009(10):22-25.
SUN J Q,HU N,WANG S Y,et al.Preliminary study on high-yield cultivation techniques of dry direct seeding of rice[J].Journal of Seed Industry Guide,2009(10):22-25.
[2]李荣容,王鹏,韦诗涛,等.黄河中下游汛期洪水的分期识别[J].人民黄河,2017,39(11):24-29.
LI R R,WANG P,WEI S T,et al.Flood season staged in middle and lower Yellow River[J].Yellow River,2017,39(11):24-29.
[3]LI Y T,XIE X H,ZHU Z J,et al.Land use driven change in soil organic carbon affects soil microbial community assembly in the riparian of Three Gorges Reservoir Region Applied Soil Ecology,2022,176:104467.
[4]ZHANG H K,FANG Y Y,ZHANG B G,et al.Land-use-driven change in soil labile carbon affects microbial community composition and function[J].Geoderma,2022,426:116056.
[5]MAFA-ATTOYE T G,BASKERVILLE M A,OFOSU E,et al.Riparian land-use systems impact soil microbial communities and nitrous oxide emissions in an agro-ecosystem[J].The Science of the Total Environment,2020,724:138148.
[6]BISSETT A,RICHARDSON A E,BAKER G,et al.Long-term land use effects on soil microbial community structure and function[J].Applied Soil Ecology,2011,51:66-78.
[7]WEN X Y,DUBINSKY E,WU Y,et al.Wheat,maize and sunflower cropping systems selectively influence bacteria community structure and diversity in their and succeeding crop's rhizosphere[J].Journal of Integrative Agriculture,2016,15(8):1892-1902.
[8]JANGID K,WILLIAMS M A,FRANZLUEBBERS A J,et al.Land-use history has a stronger impact on soil microbial community composition than aboveground vegetation and soil properties[J].Soil Biology and Biochemistry,2011,43(10):2184-2193.
[9]SIM J X F,DOOLETTE C L,VASILEIADIS S,et al.Pesticide effects on nitrogen cycle related microbial functions and community composition[J].The Science of the Total Environment,2022,807:150734.
[10]SHEN J E,TAO Q,DONG Q,et al.Long-term conversion from rice-wheat to rice-vegetable rotations drives variation in soil microbial communities and shifts in nitrogen-cycling through soil profiles[J].Geoderma,2021,404:115299.
[11]CHEN W Q,WANG J Y,CHEN X A,et al.Soil microbial network complexity predicts ecosystem function along elevation gradients on the Tibetan Plateau[J].Soil Biology and Biochemistry,2022,172:108766.
[12]TANG Q A,XIA Y Q,TI C P,et al.Partial organic fertilizer substitution promotes soil multifunctionality by increasing microbial community diversity and complexity[J].Pedosphere,2023,33(3):407-420.
[13]張俊,黄煦旸,彭宇琦.“双碳”目标下黄河流域种植业碳足迹的时空异质效应[J].河南农业大学学报,2023,57(5):884-896.
ZHANG J,HUANG X Y,PENG Y Q.Spatio-temporal heterogeneity of planting carbon footprint in Yellow River Basin under the carbon peaking and carbon neutrality targets[J].Journal of Henan Agricultural University,2023,57(5):884-896.
[14]荣国华,周景云,吴鸿宇,等.流动分析仪与凯氏定氮仪测定土壤全氮含量之比较研究[J].水土保持研究,2023,30(1):204-208.
RONG G H,ZHOU J Y,WU H Y,et al.Comparative study on determination of total nitrogen content in soil by flow analyzer and Kjeldahl nitrogen analyzer[J].Research of Soil and Water Conservation,2023,30(1):204-208.
[15]GAN L Z,ZHANG H M,TIAN J W,et al.Planococcus salinus sp. nov.,a moderately halophilic bacterium isolated from a saline-alkali soil[J].International Journal of Systematic and Evolutionary Microbiology,2018,68(2):589-595.
[16]毛健,骆永明,滕应,等.一株副球菌对污染土壤中多环芳烃的降解研究[J].土壤,2009,41(3):448-453.
MAO J,LUO Y M,TENG Y,et al.Biodegradation of PAHs by Paracoccus aminovorans HPD-2 in contaminated soil[J].Soils,2009,41(3):448-453.
[17]朱晓慧,刘虹,郭茹鑫,等.黑土微生物群落对副球菌属(Paracoccus sp.)QD15-1修复邻苯二甲酸二甲酯污染土壤的响应[J].环境污染与防治,2020,42(2):182-186.
ZHU X H,LIU H,GUO R X,et al.Response of microbial community in black soil to remediation of dimethyl phthalate contaminated soil by Paracoccus sp.QD15-1[J].Environmental Pollution & Control,2020,42(2):182-186.
[18]荆瑞勇,王丽艳,孙强,等.东北旱田土壤中Anabaena伴生细菌的分离与鉴定[J].微生物学通报,2020,47(1):130-139.
JING R Y,WANG L Y,SUN Q,et al.Isolation and identification of bacteria associated with Anabaena from upland soils in northeast China[J].Microbiology China,2020,47(1):130-139.
[19]CUI Y S,WOO S G,LEE J,et al.Nocardioides daeguensis sp. nov.,a nitrate-reducing bacterium isolated from activated sludge of an industrial wastewater treatment plant[J].International Journal of Systematic and Evolutionary Microbiology,2013,63(Pt_10):3727-3732.
[20]LACHMAYR K,ODUARAN E.Investigation of Nocardioides sp. metabolic,structural,biochemical properties,and its potential role in the sulfur cycle[J].The FASEB Journal,2015,29(S1):1944-1956.
[21]曹梦雨,桑世飞,王亚男,等.水稻全基因组磷脂酶家族蛋白筛选及其生物信息学分析[J].河南师范大学学报(自然科学版),2022,50(3):143-149.
CAO M Y,SANG S F,WANG Y N,et al.Genome wide screening and bioinformatics analysis of rice phospholipase family proteins[J].Journal of Henan Normal University(Natural Science Edition),2022,50(3):143-149.
[22]DING M J,SHANG N J,XIAO Z X,et al.Bacillus aciditolerans sp. nov.,isolated from paddy soil[J].International Journal of Systematic and Evolutionary Microbiology,2019,69(4):1155-1161.
[23]BAI J,CHAO Y,CHEN Y M,et al.The effect of interaction between Bacillus subtilis DBM and soil minerals on Cu(II)and Pb(II)adsorption[J].Journal of Environmental Sciences,2019,78(4):328-337.
[24]田瑩莹,王强,赵京,等.黄河滩地和稻田土中铁还原菌、不产氧光合细菌分布机制[J].微生物学报,2023,63(2):805-820.
TIAN Y Y,WANG Q,ZHAO J,et al.Distribution mechanism of iron-reducing bacteria and oxygen-producing photosynthetic bacteria in Yellow River beach and paddy soil[J].Acta Microbiologica Sinica,2023,63(2):805-820.
[25]GHORBANZADEH N,LAKZIAN A,HAGHNIA G H,et al.Isolation and identification of ferric reducing bacteria and evaluation of their roles in iron availability in two calcareous soils[J].Eurasian Soil Science,2014,47(12):1266-1273.
[26]LI X L,KOBLEK M,FENG F,et al.Whole-genome sequence of a freshwater aerobic anoxygenic phototroph,Porphyrobacter sp. strain AAP82,isolated from the Huguangyan maar lake in southern China[J].Genome Announcement,2013,1(2):e0007213.
[27]ZAVALA N,BAEZA L,GONZALEZ S,et al.The effects of different carbon sources on the growth of Rhodobacter sphaeroides[J].Advances in Microbiology,2019,9(8):737-749.
[28]DU J Q,LIU J X,JIA T,et al.The relationships between soil physicochemical properties,bacterial communities and polycyclic aromatic hydrocarbon concentrations in soils proximal to coking plants[J].Environmental Pollution,2022,298:118823.
[29]LU C,HONG Y,LIU J A,et al.A PAH-degrading bacterial community enriched with contaminated agricultural soil and its utility for microbial bioremediation[J].Environmental Pollution,2019,251:773-782.
[30]李娟,CONSTANTINE UWAREMEW,冷艳,等.节杆菌属细菌处理有机物和重金属污染物的研究进展[J].环境科学与技术,2017,40(10):89-97.
LI J,UWAREMWE C,LENG Y,et al.Progress on the study of biodegradation of organic pollutants and adsorption of heavy metals with Arthrobacter strains[J].Environmental Science & Technology,2017,40(10):89-97.
[31]韩鹏,洪青,何丽娟,等.阿特拉津降解菌ADH-2的分离、鉴定及其特性研究[J].农业环境科学学报,2009,28(2):406-410.
HAN P,HONG Q,HE L J,et al.Isolation,identification and characterization of an atrazine-degrading bacteria ADH-2[J].Journal of Agro-Environment Science,2009,28(2):406-410.
[32]陈乾锦,林书震,李红丽,等.邵武烟田土壤微生物群落结构变化与烟草青枯病发生关系初报[J].中国烟草学报,2019,25(4):64-71.
CHEN Q J,LIN S Z,LI H L,et al.A preliminary report on relationship between variation of microbial community structure in soil and occurrence of tobacco bacterial wilt in tobacco field in Shaowu[J].Acta Tabacaria Sinica,2019,25(4):64-71.
[33]肖健,陳思宇,孙妍,等.甘蔗间作不同豆科作物对甘蔗植株内生细菌多样性的影响[J].热带作物学报,2021,42(11):3188-3198.
XIAO J,CHEN S Y,SUN Y,et al.Effect of intercropping with different legume crops on endophytic bacterial diversity of sugarcanes[J].Chinese Journal of Tropical Crops,2021,42(11):3188-3198.
[34]RICHARDSON D J,SAWERS G,VAN SPANNING R J M.Periplasmic electron-transport systems in bacteria[M].Amsterdam:Elsevier,2013.
[35]刘道玉,范立民,王琼,等.脱氮副球菌的好氧反硝化特性及对养殖水体中氮素的控制[J].农业环境科学学报,2012,31(11):2249-2255.
LIU D Y,FAN L M,WANG Q,et al.The aerobic denitrification characteristics of Paracoccus denitrificans and its nitrogen control for aquaculture water[J].Journal of Agro-Environment Science,2012,31(11):2249-2255.
[36]李海红,佟欣宇,宦臣臣,等.高效异养硝化-好氧反硝化菌株TS-1筛选及降解特性[J].应用与环境生物学报,2020,26(4):791-799.
LI H H,TONG X Y,HUAN C C,et al.Characterizing the heterotrophically nitrifying and aerobically denitrifying TS-1 strain[J].Chinese Journal of Applied and Environmental Biology,2020,26(4):791-799.
[37]ZHOU S L,SUN Y E,LI Z X,et al.Characteristics and driving factors of the aerobic denitrifying microbial community in Baiyangdian Lake,Xiong'an new area[J].Microorganisms,2020,8(5):714.
[38]汪银龙,冯民权,董向前.汾河下游水体nirS型反硝化细菌群落组成与无机氮关系[J].环境科学,2019,40(8):3596-3603.
WANG Y L,FENG M Q,DONG X Q.Community composition of nir S-type denitrifying bacteria in the waters of the lower reaches of the Fenhe River and its relationship with inorganic nitrogen[J].Environmental Science,2019,40(8):3596-3603.
[39]HUANG S F,CHEN M,DIAO Y M,et al.Dissolved organic matter acting as a microbial photosensitizer drives photoelectrotrophic denitrification[J].Environmental Science & Technology,2022,56(7):4632-4641.
Soil microbial community structure and eco-function in the rice zone along the Yellow River
Tian Yingyinga,b, Guo Qia, Chen Xingrua, Sun Xianghuia,b, Zhao Jinga,b
(a. Department of Material Science and Engineering; b. Xinxiang City Engineering Research Center for Wastewater Treatment Energy Saving and Emission Reduction, Henan Institute of Technology, Xinxiang 453003, China)
Abstract: In the present study, samples of riverside sand soil(SS) and adjacent paddy soil(PS) were collected to know the microbial composition of different substrate soils in the rice zone along the Yellow River. The high-throughput sequencing of 16S rRNA gene was used to uncover the soil microbial compositions and to explain microbes' potential eco-function. Alpha diversity analysis showed no significant difference in microbial richness and diversity index between the two soils. Further species analysis showed the ubiquitous distribution of unclassified_f Micrococcaceae, Sphingomonas, norank_f noorank_o Vicinamibacterales and norank_f Vicinamibacterales, whose abundances were independent of soil types. However, the relative abundances of Bacilllus and Thiobacillus were significantly higher in PS than that in SS. The function heatmap analysis based on FAPROTAX database showed that aromatic compound degrading bacteria in PS(especially P2_1 and P3_1) was higher than that in SS. Combined with the results of bacterial relative abundance, Nocardioides and unclassified_f_Nocardioidaceae might be the key genera contributing to aromatic compound degradation. The phototrophic microbes(PMs) in SS were more abundant than that in PS, which were dominant anoxygenic PMs like Porphyrobacter, unclassified_f_Rhodobacteraceae and Rhodobacter. Moreover, Rhodobacteraceae was likely to participate in biofilm formation in SS. Overall, soil microbial compositions along the Yellow River were to some extent impacted by the soil type, driving the differences of their eco-functions.
Keywords: soil microbial community structure; eco-function; paddy soil; sand soil
[責任编校 刘洋 杨浦]
附 录
