miRNA-495 及其成熟体调控恶性肿瘤生物学行为研究进展
2024-05-14刘瑞明张帅衣鹏程魏巍于涛
刘瑞明 张帅 衣鹏程 魏巍 于涛
微小RNA(MicroRNA,miRNA)是胞内长度约为21~22nt 的非编码RNA[1]。大部分miRNA 由RNA 聚合酶Ⅱ转录形成初级miRNA,后经过封端、剪接以及多聚腺苷酸化等处理过程形成成熟miRNA[2]。目前发现的主要作用机制为miRNA 特定序列结合下游信使核糖核酸(Messenger RNA,mRNA)3’末端非翻译区,若两者完全互补结合,会导致mRNA 降解;若两者不完全结合,则阻碍mRNA 翻译进程[3,4]。与正常组织或细胞相比,大量研究表明肿瘤中多种miRNA 异常表达,下游mRNA 含量随之发生反向改变,胞内蛋白含量异常,从而影响肿瘤细胞生物学行为。其中,许多学者对miR-495 及其成熟体调控肿瘤细胞增殖、凋亡、迁移、侵袭等多种生物学行为的效应进行了研究,表明miR-495 具有成为多种肿瘤诊断和治疗靶点的潜力[1~4]。
1 miR-495 结构及其相关研究
miR-495 位于14 号染色体,长度为81nt,转录后形成初级转录产物,被Drosha 酶切割形成miR-495 前体,经核糖核酸酶Dicer 切割后产生miR-495-5p 和miR-495-3p 两个成熟体,长度均为22nt[5]。根据已发表研究显示,与miR-495-5p 相比,miR-495-3p 更为活跃。miR-495-3p 结构序列中的-AAACAAA-可调控多个下游靶基因,从而影响更多肿瘤细胞生物学行为。多数研究结果表明肿瘤细胞和组织中miR-495 含量降低,miR-495调控下游mRNA 影响肿瘤细胞增殖、凋亡、耐药、迁移和侵袭等生物学行为[6~8]。在子宫内膜癌相关研究中的结果表明,与对照组相比,肿瘤细胞中miR-495 含量升高[6]。此外,在膀胱癌相关研究中,Tan 等[7]检测了膀胱癌组织和癌旁组织、膀胱癌细胞和人输尿管上皮永生化细胞中miR-495 含量,结果发现膀胱癌细胞和组织中miR-495 表达升高;然而与之不同的是,Zhou 等[8]检测了膀胱癌细胞和人输尿管上皮永生化细胞中miR-495-3p 含量,发现miR-495-3p 表达降低,因此未来还需要更多研究对此进一步明确。
2 miR-495 前体及成熟体调控肿瘤细胞多种生物学行为
2.1 miR-495 通过多种途径调控肿瘤细胞增殖能力目前已发现的影响肿瘤生长的因素包括细胞凋亡、细胞周期转化以及血管生成等,多项研究发现miR-495 可通过调节上述方式影响肿瘤细胞增殖能力[9~12]。Jiang 等[9]研究发现miR-495 在影响肿瘤细胞凋亡的同时影响骨肉瘤细胞增殖能力,miR-495 在骨肉瘤细胞和组织中较对照组含量降低,miR-495 过表达靶向结合高迁移率族核小体结合域5 抑制骨肉瘤细胞增殖能力、诱导细胞凋亡。Lv 等[10]研究表明miR-495 可影响肾细胞癌周期转化及阻滞,与人肾皮质近曲小管上皮细胞相比,肾细胞癌细胞中miR-495 含量下降,miR-495 过表达通过调控特殊AT 富集序列结合蛋白1 影响肿瘤细胞G0/G1 周期转变以及抑制细胞增殖能力。Li 等[11]研究结果显示miR-495 可影响食管癌血管生成,食管癌组织较癌旁组织中miR-495 表达降低、ATP 酶铜转运α 表达升高,机制实验结果表明miR-495通过负调控ATP 酶铜转运α 调控食管癌细胞耐药能力和血管生成能力。此外,Zhang 等[12]对miR-495 影响肝癌细胞衰老进程进行了研究,在明确miR-495 抑制肝癌细胞增殖以及促进周期转化后进行了细胞染色-β-半乳糖苷酶活性染色实验,发现miR-495 可促进两种肝癌细胞衰老进程。见图1。
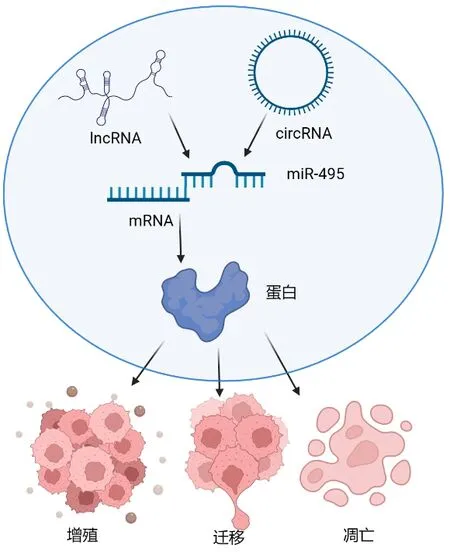
图1 miR-495 通过多种途径调控肿瘤细胞
2.2 miR-495 通过不同途径调控肿瘤细胞迁移和侵袭能力已发生肿瘤细胞远处转移的患者往往处于肿瘤晚期,是导致肿瘤患者死亡的主要原因之一,许多研究发现miR-495 可通过多种方式调控肿瘤细胞迁移和侵袭能力[13~18]。Tan 等[13]对Smad同源物4 功能缺失促进肺癌转移的机制进行了研究,体内外实验结果表明Smad 同源物4 通过调控miR-495、miR-543 进而负调节P21 活化激酶3,促进肺癌细胞转移。上皮间充质转化(Epithelialmesenchymal transition,EMT)是上皮细胞获得间充质特征的过程,与肿瘤远处转移关系密切,被称为肿瘤转移的前过程[14]。研究表明miR-495 通过调控下游mRNA 影响肿瘤EMT 进程[14]。Bai等[15]研究发现结直肠癌细胞和组织中miR-495较对照组含量降低,miR-495 靶向结合膜联蛋白A3 影响p53 通路,进而调控结直肠癌细胞侵袭和EMT。Wang 等[16]发现口腔鳞状细胞癌细胞及组织中miR-495 较对照组含量降低,miR-495 通过胰岛素样生长因子1/AKT 信号轴调节口腔鳞状细胞癌细胞侵袭、迁移以及EMT。此外,肿瘤细胞内Wnt/β-catenin 信号通路过度激活与肿瘤远处转移联系紧密,miR-495 可抑制Wnt/β-catenin 信号通路活性,抑制肿瘤细胞迁移和侵袭能力[17]。Zheng等[18]研究结果对此进行了证明,与对照组相比,非小细胞肺癌组织中miR-495 含量降低,机制研究结果表明miR-495 靶向结合转录因子4 抑制Wnt/β-catenin 信号通路活性,抑制非小细胞肺癌细胞迁移和侵袭能力。见图1。
2.3 miR-495 调控下游mRNA 调控肿瘤细胞耐放化疗能力放化疗作为目前肿瘤治疗的基本方式之一,具有减小术前肿瘤体积以及杀死术后部分逃逸肿瘤细胞等作用。然而,临床上较多肿瘤对放化疗产生抵抗,是导致许多患者预后较差以及5 年生存率较低的原因之一。许多研究同样发现miR-495 调控下游mRNA 可影响肿瘤细胞耐药以及耐辐射能力[19~22]。Feng 等[20]研究结果表明miR-495可影响鼻咽癌细胞对辐射的耐受能力,与对照组相比,鼻咽癌组织中miR-495 含量降低,葡萄糖调节蛋白78 含量上升,进一步的机制研究结果表明miR-495 调控葡萄糖调节蛋白78 表达,提高鼻咽癌细胞抗辐射能力。有研究[21]结果表明miR-495可影响乳腺癌细胞对化疗药物的耐受能力,乳腺癌细胞中miR-495 表达降低,后续实验显示miR-495 通过靶向调控转录因子叉头框C1、转化生长因子β2,进而对乳腺癌细胞耐药能力产生影响。Li等[22]分别检测了胃癌组织与癌旁组织中miR-495和表皮生长因子受体2 含量,结果表明与对照组相比,胃癌组织中miR-495 含量降低、表皮生长因子受体2 含量升高,表皮生长因子受体2 是miR-495 的靶基因,miR-495 通过抑制表皮生长因子受体2 及mTOR 信号通路调节胃癌细胞对化疗药物的敏感性。
2.4 ceRNA 调控miR-495 影响肿瘤进展目前已发现的竞争性内源RNA(Competing endogenous RNA,ceRNA)主要包括长链非编码RNA(Long noncoding RNA,lncRNA)、环 状RNA(Circular RNA,circRNA)[23]。ceRNA 作用机制亦为近年来研究热点,该调控机制是指某些lncRNA、circRNA 具有相同miRNA 结合位点,竞争性结合共同的下游miRNA,被结合的miRNA 生物学效应减弱,即靶向结合下游mRNA 的能力减弱,细胞的生物学行为得以调节[24]。许多研究表明lncRNA 和circRNA调控miR-495 及其下游mRNA 从而形成ceRNA轴,进而影响多种肿瘤发生、发展[25~28]。lncRNA 小核RNA 宿主基因10/miR-495-3p/钙黏蛋白相关蛋白轴的发现来自Yuan 等[25]人的研究,发现小核RNA 宿主基因10 在胃癌组织和细胞中表达升高,miR-495-3p 在胃癌细胞中表达降低,机制实验结果表明小核RNA 宿主基因10 靶向调控miR-495-3p/钙黏蛋白相关蛋白轴激活Wnt/β-catenin 信号通路,促进胃癌进展。Mutalifu 等[26]研究表明胶质瘤组织和细胞中circ-0000215 较对照组含量上调、miR-495-3p 含量下降,circ-0000215 通过调控miR-495-3p/CXC 趋化因子受体2 轴,促进胶质瘤进展。lncRNA 核富集转录本1 作为一种广泛研究的lncRNA,可调控多种肿瘤发生、发展[27]。有研究[28]表明miR-495 是其下游靶点之一,结肠癌细胞中核富集转录本1 含量升高、miR-495-3p 含量降低,机制实验结果表明核富集转录本1 通过抑制miR-495-3p 激活细胞周期蛋白依赖性激酶6,从而促进结肠癌进展。
3 miR-495 前体及其成熟体与肿瘤诊断及预后
有学者发现miR-495 含量与肿瘤诊断以及患者预后关系密切[29,30]。Zhang 等[29]检测了81 例急性髓细胞白血病患者及健康人的外周血中miR-495 含量,结果显示急性髓细胞白血病患者外周血中miR-495 表达降低,诊断性分析结果表明,miR-495 具有成为急性髓细胞白血病早期诊断指标的潜力。Alkhathami[30]的研究表明视皮质轴突蛋白1 和接触蛋白1 与乳腺癌患者绝经状态、淋巴结受累、雌激素受体状态、孕激素受体状态、TNM 分期以及远处转移关系密切,而miR-495 与视皮质轴突蛋白1 和接触蛋白1 含量成反比。
4 小结与展望
恶性肿瘤对人类生命健康造成的危害不言而喻,目前手术切除肿瘤部位辅以放化疗的主流治疗方式已极大提升肿瘤患者5 年生存率,然而面对已发生远处转移的肿瘤患者,该治疗方式效果却不尽人意[31]。令人期待的是,miRNA 调节不同肿瘤细胞生物学行为及其进展的效应已显现出具有成为肿瘤诊断和治疗靶点的潜力[32]。其中,本研究综述的miR-495 及其成熟体被ceRNAs 调控以及可调控多种下游“明星分子”,还可对经典信号通路产生影响,表明该miRNA 在恶性肿瘤发生发展中较为活跃,具有成为多种肿瘤临床诊疗小分子靶点的潜力,见表1。
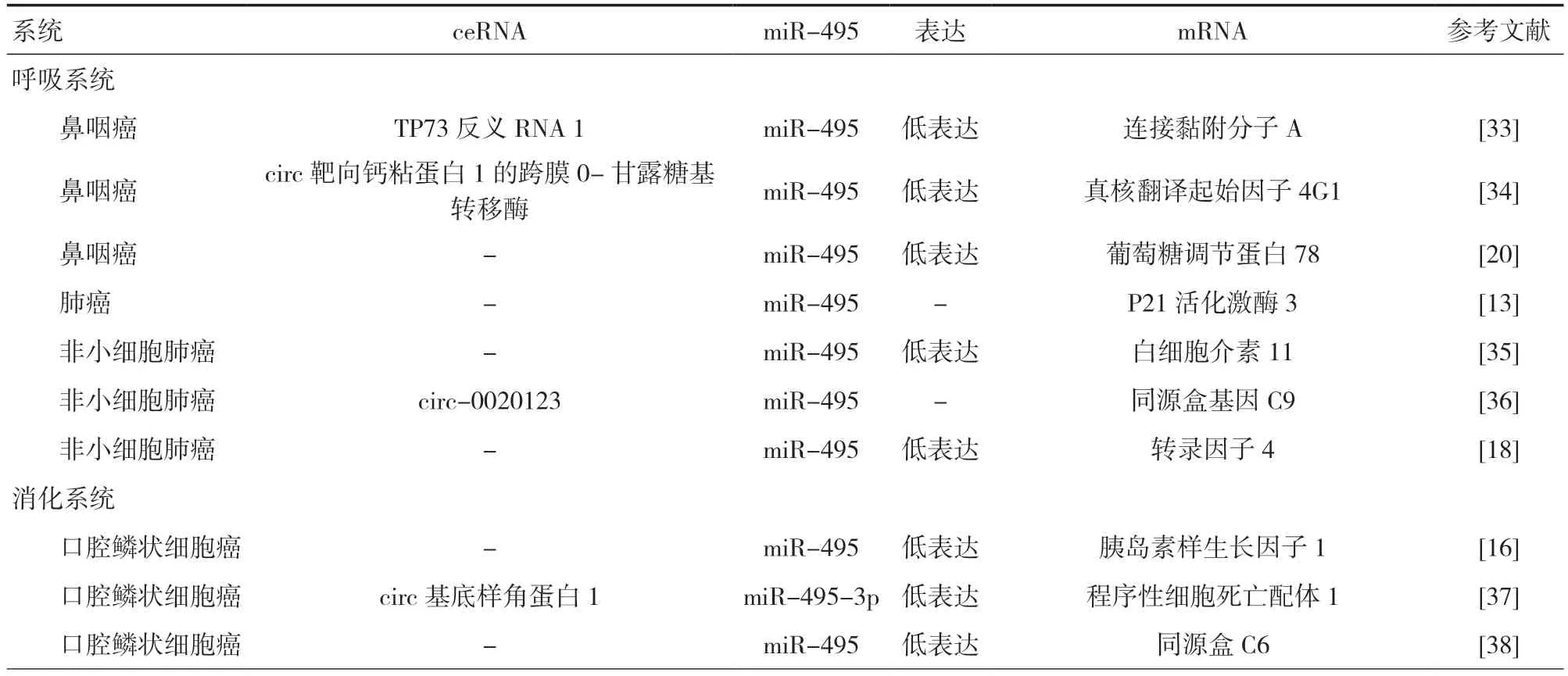
表1 miR-495 及其成熟体调控恶性肿瘤的相关研究
综上,miR-495 及其成熟体在调控恶性肿瘤生物学行为中扮演着重要角色,包括增殖、侵袭、迁移、EMT、耐药、周期转换等,为阐述肿瘤发生发展机制以及新型治疗方式研发提供了良好的切入点。需指出的是,miR-495/mRNA 轴往往同时调控肿瘤细胞多种生物学行为。然而,目前关于miR-495 及其成熟体相关研究具有很大局限性。恶性肿瘤发生发展机制复杂,如果仅从单个miRNA 对此进行全面阐述显然具有极大的片面性。再者,肿瘤细胞内存在广泛的RNA-RNA、RNA-蛋白质调控网络[56],miR-495 上下游所有靶点及其生物学作用是否已经全部阐明,这尚未得知。最后,目前分子治疗发展缓慢,存在较多问题尚未解决,因此如何根据已有研究成果进行有效的临床转化,如miRNA 相关疫苗的研发还存在较多技术难关尚未得到解决,未来需要更多高质量实验对此进行研究。
