产香酵母菌丸麦曲固态发酵系统构建及其生长动力学研究
2024-05-14黄治国张晴雯郑若欣任志强
黄治国,张晴雯,郑若欣,曾 波,任志强,邓 杰,谢 军*
(1.四川轻化工大学 酿酒生物技术及应用四川省重点实验室,四川 宜宾 644000;2.四川国检检测有限责任公司,四川 泸州 646000;3.四川轻化工大学 中国轻工业酿酒生物技术及智能制造重点实验室,四川 宜宾 644000)
中国白酒以酒曲作为糖化发酵剂,并以独特的酿造工艺区别于白兰地、龙舌兰、伏特加等其他世界著名蒸馏酒。《尚书·说命篇》记载“若作酒醴,尔惟麹(曲)糵”表明在几千年前我国先民就已经发现了酒曲的重要性。酒曲历经上千年的发展与创新,已经取得了显著的成就,形成了以大曲、小曲和麸曲为主的常规曲药种类,以及强化曲、纯种曲、液体曲等新型曲药[1]。目前,酒曲存在一些不足,如大曲虽具有丰富的酶系、菌系和物系,但制曲周期长、制曲原料贵、储存过程损失大以及用曲量大等,进而导致酒企生产成本增加;小曲相较于大曲具有生产成本低、酿酒周期短等优点,但小曲中菌群数量远低于大曲,尤其是产香微生物菌群[2-5]。鉴于传统小曲制曲原料主要为大米,形成了粮食供应的竞争问题,麸曲开始逐步替代小曲成为主流用曲之一。麸曲具有强糖化力、强发酵力、高出酒率等优点,但也存在菌群单一、产香力低导致基酒中风味物质远低于大曲酒等缺点[6]。为此,产香酵母菌逐渐成为中国白酒行业的关注焦点之一。从酿酒原料、酿造环境、曲药、糟醅以及窖泥等来源中分离筛选出具有优良发酵和产香特性的酵母菌株,并将其应用于白酒强化发酵是一个研究热点[7-9]。李晓欢等[10]从大曲中筛选优良酿酒酵母(Saccharomyces cerevisiae),并将其接种于小麦粉制作酵母曲,优化制曲工艺后酿酒酵母生物量为7.5×108CFU/g。夏玙等[11]复配麸皮、鲜酒糟、玉米粉并接种异常威克汉姆酵母(Wickerhamomyces anomalus)制作麸曲,优化培养条件后酵母生物量为3.12×108CFU/g。富志磊等[12]应用异常威克汉姆酵母进行白酒模拟固态发酵提升了白酒乙酸乙酯含量。
小麦是中国白酒大曲中主要的制曲原料,属于经验性制曲原料。有研究表明,去除部分皮层的小麦更适合微生物生长[13-14]。传统大曲的制作需要对小麦进行粉碎、润湿、拌料、成型后进行发酵,这导致大曲的制作需要人工进行翻曲、打拢、收堆,存在极大的劳动量需求,难以完全实现机械化。基于此,本研究以丸麦制曲对小麦制曲工艺进行简化。小麦去除皮层再经过局部精制后的小麦籽粒即为“丸麦”,又称“麦仁”。目前,国内已有使用麦仁制曲以及利用麦仁曲制作酱油、面酱、食醋、生物饲料和酿酒的报道[15-17],可见丸麦是一种在发酵行业中具有可行性和实用价值的原料。国外也有类似丸麦曲生产的实例,如日本清酒曲以蒸制熟化的去皮大麦、大米等为原料,接种曲霉菌种(如白曲霉(Aspergillus kawachii)、米曲霉(Aspergillus oryzae)、琉球曲霉(Aspergillus luchuensis))制作而成[18-20]。但大麦皮壳较多,经过去皮处理产生的损耗相对小麦较多[21]。此外,大麦在中国的进口率远超出口率,供销不均,作为制曲原料成本较高[22]。
该研究以丸麦为制曲原料,以产香酵母菌为菌种发酵制备丸麦曲,首先根据浅盘生物反应器原理构建产香酵母丸麦曲固态发酵系统;然后接种产香酵母并监测其在丸麦曲培养过程中生物量的变化建立酵母菌生长动力学模型,以此探索酒曲制作新技术和产香酵母的固态发酵技术可行性,以期对产香酵母固态扩大培养技术提供理论支撑,对中国白酒酒曲产业技术创新提供一定的参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
丸麦(人工剔除不完整粒):新野县优尚佳食品厂。
季也蒙毕赤酵母(Meyerozyma guilliermondii)DQ-10、异常威克汉姆酵母(Wickerhamomyces anomalus)DQ-02、马尔克斯克鲁维酵母(Kluyveromyces marxianus)DQ-03、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)DQ-04:均分离自浓香型白酒大曲,现保藏于酿酒生物技术及应用四川省重点实验室。
1.1.2 试剂
酵母浸粉、蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;无水葡萄糖(分析纯)、琼脂粉(生化试剂):成都市科隆化学品有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基[23]:1%酵母浸粉,2%葡萄糖,2%蛋白胨。115 ℃高压蒸汽灭菌20 min。
计数培养基:YPD培养基中添加2%琼脂及0.01%氯霉素。
1.2 仪器与设备
ZXMP-R1430恒温培养箱:上海智城分析仪器制造有限公司;LabServ-LS-O610干燥箱:美国Thermo Fisher公司。
1.3 方法
1.3.1 丸麦曲固态发酵系统的设计
由于丸麦曲从原料、菌种上均与现有的酒曲存在较大的差异,因此制曲所用设施及环境不能借用现有的制曲设备。为此,本研究特为丸麦曲设计了一套实验室规模的固态发酵生物反应器(以下简称“反应器”),结构图见图1。该反应器是由不锈钢材料支撑的双层浅盘式结构。反应器由盖、物料层(具孔浅盘)、废水层(无孔浅盘)三个部分组成。物料层高45 mm,内径300 mm,物料层的底部均匀分布2 mm孔,制曲时拟填充丸麦基质20 mm,预留20~25 mm顶空。废水层高40 mm,内径300 mm。盖、物料层、废水层皆具有卷边。具孔浅盘与无孔浅盘的卷边外翻,曲边平盖的卷边内扣。盖与物料层卷边之间形成一圈连续而弯曲的通风口。在制曲过程中反应器放置于恒温恒湿的培养箱中,可根据产香酵母菌的生长情况及时调整温度、湿度,尽可能地提高酵母菌在丸麦上的生物量。

图1 双层浅盘式丸麦曲固态发酵生物反应器结构Fig. 1 Structure of double-layer tray bioreactors for Wanmai-Qu solid-state fermentation
1.3.2 丸麦曲的制作工艺
取一环预活化酵母接种于YPD培养基中,在30 ℃、170 r/min的条件下扩大培养24 h。培养结束后使用显微镜进行镜检确保无杂菌后在3 000 r/min条件下离心5 min,收集酵母细胞沉淀。然后,加入等体积的无菌水复悬酵母细胞,得到菌悬液备用。
以无菌水没水浸泡丸麦30 min,沥水,经沸水浴15 s处理后于无菌环境摊晾至室温,而后接种1%菌悬液,混匀,在无菌反应器的具孔浅盘中铺成2 cm厚,于温度30 ℃、相对湿度(relative humidity,RH)80%条件下培养26 h即得到丸麦曲。
1.3.3 酵母菌计数
丸麦曲发酵开始后每隔2 h取样,参考GB/T 4789.15—2016《食品安全国家标准食品微生物学检验霉菌和酵母计数》中的方法[24],对丸麦曲固态发酵过程中酵母菌的活菌进行计数。操作如下:取10 g样品,加入90 mL无菌生理盐水,170 r/min振荡30 min,制成1∶10待测样液。取100 μL待测样液至900 μL无菌生理盐水中,充分振荡,并以此操作进行10倍递增系列梯度稀释。选择适宜稀释度待测样液取100μL涂布于计数培养基上,于30 ℃培养箱中培养2 d进行菌落计数,平行测定3次取平均值。
1.3.4 酵母菌生长动力学模型的建立
为描述丸麦曲固态发酵中酵母菌的生长动力学,采用Logistic模型拟合丸麦曲固态发酵中酵母菌生长过程[25-26],Logistic方程如下:
当t=0时X=X0,该方程的积分式为:
式中:X为菌体浓度,lg(CFU/g);X0为t=0时菌体的初始浓度,lg(CFU/g);Xm为菌体的最大浓度,lg(CFU/g);μm为最大比生长速率,h-1;t为培养时间,h。
1.3.5 数据分析
试验数据采用DPS 6.01、Excel 2016等软件进行数据分析及绘图。
2 结果与分析
2.1 丸麦曲固态发酵系统运行结果
2.1.1 基质三相结构
相较于大曲、小曲以及麸曲的制曲原料,丸麦曲由于具有极高的完整性,属于类似于散料的制曲原料。因此,在制曲过程中丸麦曲料堆实际是一个复杂的气-液-固三相结构(见图2)。
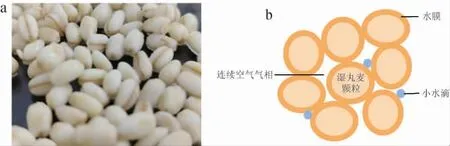
图2 丸麦基质(a)与结构(b)示意图Fig. 2 Schematics of Wanmai substrate (a) and structure (b)
丸麦曲料堆中的三相结构会随着制曲的进行产生波动性变化,如附着于丸麦粒表面的水薄膜是不稳定的,其中肉眼可观测到的游离水随着发酵的进行会因为通风、温度变化等而减少或消失。丸麦颗粒中的水分可能随着酵母菌的生长出现一定范围的波动变化,同时也会参加酵母菌生长、繁殖、代谢过程中的物质传递与反应。丸麦在堆料过程中会自然形成空隙,形成空气流动的通道,为酵母菌生长、繁殖过程中提供足够的氧气,形成了完整的气相结构。根据前期的预试验结果,该基质满足酵母菌丸麦曲制曲的需求,可以进行后续的深入试验。
2.1.2 丸麦曲外观与酵母活菌数
经过丸麦曲固态发酵系统发酵后的四种产香丸麦曲见图3。由图3可知,丸麦曲具有较良好的外观,颗粒分明,基质无明显塌陷,表明丸麦颗粒之间结构相对稳定。颜色呈现较为均匀的浅黄色,具有适闻香气。酵母菌在丸麦颗粒表面的生长较均匀,菌落在胚芽部分较胚乳部分明显集中。这可能是因为胚芽部分提供了更多利于酵母菌生长的营养成分。发酵结束后季也蒙毕赤酵母DQ-10、异常威克汉姆酵母DQ-02、马尔克斯克鲁维酵母DQ-03、汉逊酵母DQ-04四种产香酵母丸麦曲的酵母活菌数(以湿重计)分别达(6.03±0.32)×109CFU/g、(5.49±0.33)×109CFU/g、(4.52±0.25)×109CFU/g、(4.04±0.31)×109CFU/g,表明丸麦曲固态发酵系统运行良好,可以为四株酵母在丸麦表面的生长提供适合的环境且酵母菌可以在丸麦表面生长到较高的密度。

图3 四种产香酵母丸麦曲Fig. 3 Wanmai-Qu fermented with 4 aroma-producing yeasts
2.2 Logistic菌体生长动力学模型建立与验证结果
利用DPS 6.01软件对四种产香酵母丸麦曲固态发酵过程生物量监测值(以干基计)进行拟合,参数估计值见表1。

表1 Logistic方程参数估计值Table 1 Estimation of Logistic equation parameters
将表1参数代入公式(2)即可推导出季也蒙毕赤酵母DQ-10、异常威克汉姆酵母DQ-02、马尔克斯克鲁维酵母DQ-03、汉逊酵母DQ-04在丸麦曲固态发酵中的菌体生长动力学模型,分别为:
上述方程相关系数R2分别为0.963 4、0.968 8、0.979 9、0.983 7,P值均<0.001,表明方程曲线拟合度较好。根据方程可得丸麦曲固态发酵过程中酵母菌活菌数随培养时间变化的拟合值,将拟合值与试验值进行对比,结果见图4。由图4可知,4种产香酵母在丸麦上的生长无明显延滞期,其中酵母活菌数最高值均低于2.1.2中不间断发酵26 h的丸麦曲。这可能是因为监测取样时丸麦颗粒之间相对运动,对颗粒表面的酵母菌施加了剪切力导致部分酵母菌死亡。计算四组试验值与拟合值之间的相对误差可知,二值之间误差均<3%,说明该模型可以较好地描述4种产香酵母菌在丸麦曲固态发酵过程中的生长特征。
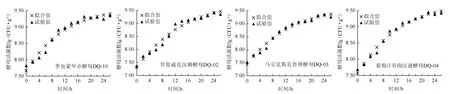
图4 丸麦曲固态发酵过程中酵母菌活菌数的试验值与模型拟合值Fig. 4 Experimental value and fitted value of models for viable counts of yeasts during Wanmai-Qu solid-state fermentation
3 结论
本研究基于产香酵母丸麦曲工艺创新研究目的,搭建了丸麦曲固态发酵系统,创新性地设计了一款用于丸麦曲培养的双层式具盖浅盘生物反应器,可同时满足减少发酵过程中的杂菌污染和收集废水的需求;在构建的发酵系统的基础上探究了不同产香酵母菌的生长情况。分离自浓香型白酒大曲的四种产香酵母在丸麦基质上生长良好,其生长情况均符合Logistic模型,相关系数R2均>0.96,P值均<0.001,模型拟合值与试验值间的相对误差均<3%,说明该模型能较好地反映酵母菌在丸麦上的菌体生长动力学特征。因此,丸麦作为一种颗粒状固态发酵基质,可以供应产香酵母的增殖需求;产香酵母的酒曲化具有一定的可行性。
