人参皂苷生物合成相关的尿苷二磷酸依赖的糖基转移酶研究进展
2024-05-14杨德盈李志新董子舒刘红宁
童 婧,杨德盈,张 倩,李志新,董子舒,刘红宁*,黄 佳*
人参皂苷生物合成相关的尿苷二磷酸依赖的糖基转移酶研究进展
童 婧1,杨德盈2#,张 倩1,李志新1,董子舒1,刘红宁1*,黄 佳1*
1. 江西中医药大学高等研究院,中医基础理论分化发展研究中心,江西省中医病因生物学重点实验室,江西 南昌 330004 2. 广东医科大学附属医院,广东 湛江 524001
人参皂苷是一类具有丰富药理活性的重要天然产物,常见的类型包括达玛烷型(protopanaxadiol type,PPD-type/proto-panaxatriol type,PPT-type)、齐墩果烷型(oleanane type,OA-type)和奥克悌隆型(ocotillol type,OCT-type),可广泛应用于医药、农业和工业生产等领域。尿苷二磷酸(Uridine diphosphate,UDP)依赖的糖基转移酶(UDP-glycosyltransferases,UGTs)是催化人参皂苷生成的关键酶,对人参皂苷结构的形成及药理作用的发挥具有重要意义。综述了人参皂苷的分布、结构多样性和生物合成途径,并基于几种常见人参皂苷类型重点阐述了与糖基化反应相关的UGTs,以期为人参皂苷生物合成相关研究提供参考。
糖基化;糖基转移酶;人参皂苷;天然产物;达玛烷型;齐墩果烷型;生物合成
人参属植物属于五加科多年生草本植物,包含8种(人参、西洋参、三七、假人参、姜状三七、竹节参、屏边三七和三小叶人参)和3变种(狭叶竹节参、珠子参和羽叶参),主要分布在东亚地区[1]。其中在中国,人参属植物集中分布在东北三省,以吉林为重要产区,其产量约占全国85%,每年可达3万t,产值高达600亿元[2]。人参皂苷是人参属植物的主要活性成分,属于三萜类糖苷化合物。几千年来,人参、西洋参及三七等一直作为传统中药材、食品和膳食补充剂而被广泛使用[3]。现代药理学研究表明,人参皂苷具有抗炎、抗肿瘤、解热镇痛、增强免疫力和改善心血管等药理活性[4]。除用于食品、医药和保健品外,人参皂苷作为底料来源还被广泛应用于化妆品生产[5],而在农业活动中,植物体内的人参皂苷能够吸引传粉昆虫辅助授粉或对动物有拒食作用[6]。由于较高的药理价值和广泛的生物活性,人参皂苷在诸多应用方面具有广阔的商业前景。然而作为人参皂苷的主要来源,人参的野生资源逐渐匮乏,质量也受连作障碍、病虫害的影响逐渐下降[7]。同时,部分极具药理活性的人参皂苷,如稀有人参皂苷Rg3、人参皂苷Rh2等,在植物中含量极低,难以满足临床应用和工农业生产的需求[7]。近年来,随着植物次生代谢途径及其关键酶的研究不断深入,采用合成生物学技术异源合成人参皂苷是一种环保高效的方法[8-11]。由尿苷二磷酸(Uridine diphosphate,UDP)依赖的糖基转移酶(UDP-glycosyltransferases,UGTs)介导的糖基化是人参皂苷生物合成途径的最后一步,对人参皂苷的药理活性和结构多样性具有重要作用[12]。因此,本文总结了参与人参皂苷生物合成相关的UGTs,为进一步阐明人参皂苷生物合成途径和合成生物学在人参皂苷生产中的应用提供参考。
1 人参皂苷在植物中的分布和结构多样性
1.1 分布
截至目前,从11种人参属植物中分离出约300种人参皂苷,仅在人参的根、叶、花和果实中就已发现了200余种[13-14]。现常应用高效液相色谱(HPLC)与质谱联用技术检测植物中人参皂苷化合物及转录组水平,以分析影响人参皂苷质量和分布的因素。
1.1.1 人参皂苷的种类和含量与物种有关 Yan等[15]基于HPLC特征图谱比较人参属药材人参、西洋参和三七的成分及其含量,发现三者体内含有许多共有成分,如人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rb2、人参皂苷Rb3、人参皂苷Rd等,但各单体成分含量存在差异。例如,人参皂苷Rg1、人参皂苷Re、人参皂苷Rd、人参皂苷Rb14个共有单体成分含量均以三七最高,西洋参次之,人参最少。除共有成分外,它们也各含特征成分,如人参含人参皂苷Rf,西洋参含拟人参皂苷F11,三七含三七皂苷R1、三七皂苷R2[16-19]。
1.1.2 人参皂苷的含量与栽培时间和生长环境有关 Xie等[20]采用超高效液相色谱-四极杆飞行时间质谱(UPLC-QTOF-MS)和多元统计分析技术,对不同参龄和生长环境的人参属植物人参、三七、西洋参和高丽参进行代谢谱分析,得到的UPLC-QTOF-MS光谱和数据反映植物质量信息的同时,进一步证明了人参皂苷可在同一植物物种内因地理位置和栽培年龄不同而发生细微变化。
1.1.3 人参皂苷在人参中的积累和分布具有组织特异性且在人参根中的分布呈现异质性 Zhang等[21]通过UPLC-二极管阵列检测器(PDA)测定人参3个器官和4个组织中8种主要人参皂苷含量,发现叶片中皂苷积累最多,根茎次之,根中最少,但总体上随栽培年限而增加,尤其在根中周皮内皂苷含量是其他组织的2倍以上。
在一定程度上,不同品种、组织、栽培年龄和环境条件下的人参皂苷呈现出规律性分布。因此,了解不同物种、不同培养方式及不同部位人参皂苷的分布对寻找关键合成酶、阐明人参皂苷合成途径和解析调控机制具有重要意义。
1.2 结构多样性
根据苷元不同,人参皂苷可分为达玛烷型(dammarane type,DM-type)、齐墩果烷型(oleanolic acid type,OA-type)和奥克悌隆型(ocotillol type,OCT-type,图1)。在自然界中齐墩果烷型和奥克悌隆型含量相对较少,齐墩果烷型主要为人参皂苷Ro(1),奥克悌隆型主要包括拟人参皂苷F11(2)和人参皂苷MR2(3)[22]。在生物体内以达玛烷型为主,按C3、C6、C20位上糖基位置、数量和类型的差异分为原人参二醇型(protopanaxadiol type,PPD-type)和原人参三醇型(protopanaxatriol type,PPT-type)。PPD型人参皂苷由UGTs催化PPD型人参皂苷元C3-、C20-OH糖基化而形成,包括人参皂苷Rb1(4)、Rd(5)、Rb2(6)、Rb3(7)等;PPT型人参皂苷则由UGTs催化PPT型人参皂苷元C6-、C20-OH糖基化而形成,包括人参皂苷Rg1(8)、人参皂苷Rf(9)、人参皂苷Re(10)、人参皂苷Rg2(11)、三七皂苷R1(12)、三七皂苷R2(13)等[23]。目前已鉴定的稀有人参皂苷(图1)也基本属于达玛烷型人参皂苷,包括PPD型,如人参皂苷Rg3(14)、人参皂苷Rh2(15)、人参皂苷F2(16)、CK(17)、Gyp17(18)、Gyp75(19);PPT型,如人参皂苷F1(20)、人参皂苷Rh1(21)。此外,还有一类结构较为特殊的稀有人参皂苷—多双键型稀有人参皂苷,主要包括人参皂苷Rg5(22)、人参皂苷Rh3(23)、人参皂苷Rh4(24)、人参皂苷Rk1(25)、人参皂苷Rk2(26)、人参皂苷Rk3(27)等,在一定程度上丰富了人参皂苷的化学结构和药理活性[11]。
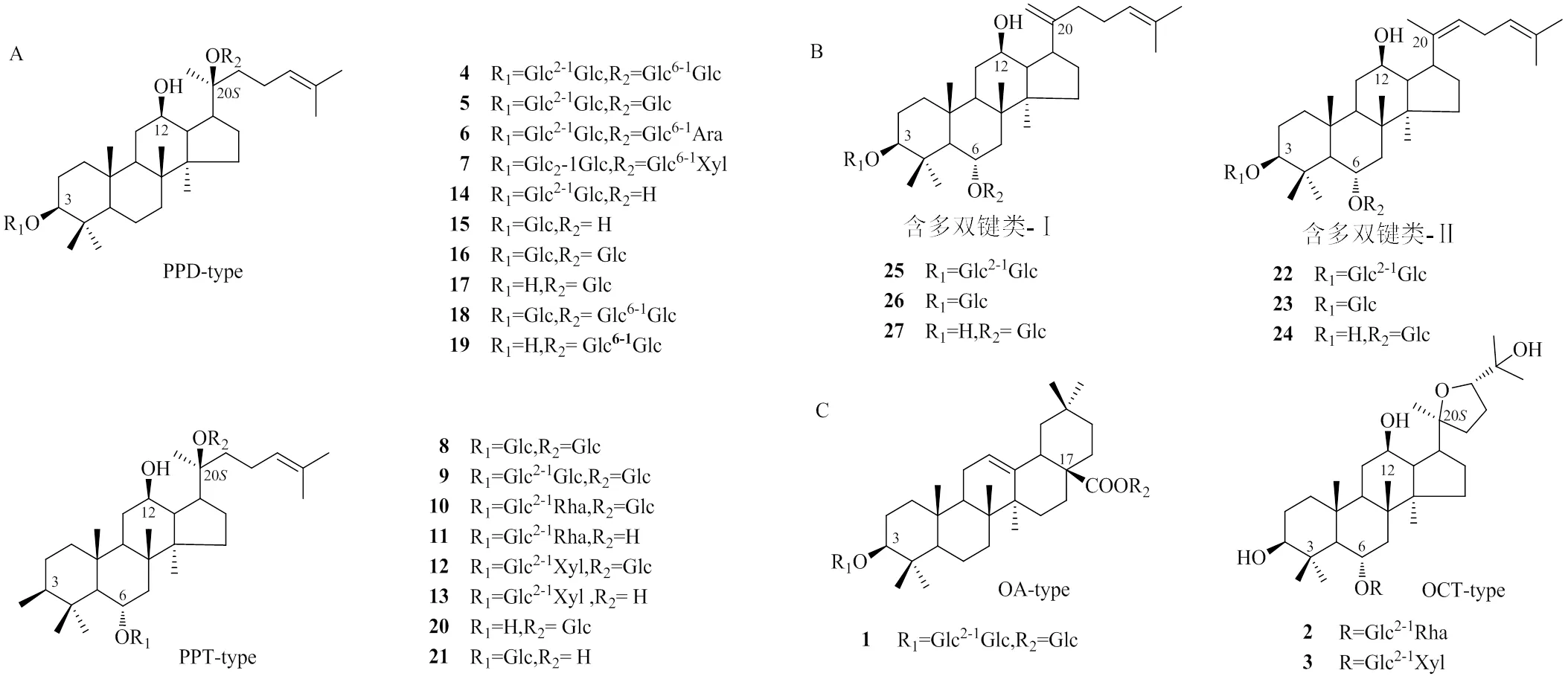
A-PPD型人参皂苷,PPT型人参皂苷;B-含多双键Ⅰ类稀有人参皂苷,含多双键Ⅱ类稀有人参皂苷;C-齐墩果烷型人参皂苷,奥克悌隆型人参皂苷
2 人参皂苷生物合成途径
人参皂苷与其他三萜类化合物生物合成途径类似,均起始于异戊烯焦磷酸(isopentenyl pyrophosphate,IPP)及其异构体二甲基烯丙基焦磷酸(dimethylallyl diphosphate,DMAPP)。IPP和DMAPP可由乙酰辅酶A经胞质中的甲羟戊酸途径(mevalonate pathway,MVA)或丙酮酸和甘油醛3-磷酸经质体中的2--甲基--赤藓糖醇-4-磷酸途径(2--methyl--erythritol-4-phosphate,MEP)合成,人参皂苷的形成以MVA途径为主。首先,2分子IPP和一分子DMAPP在法尼基焦磷酸合酶(farnesyl pyrophosphate synthase,FPPS)作用下合成法尼基焦磷酸(farnesyl diphosphate,FPP),然后2分子FPP在角鲨烯合酶(squalene synthase,SQS)作用下经“头尾缩合”形成角鲨烯(squalene,SQ),随后在鲨烯环氧化酶(squalene epoxidase,SQE)作用下形成2,3-氧化鲨烯(2,3-oxidosqualene),再经不同氧化角鲨烯环化酶(oxidosqualene cyclases,OSCs)进一步催化得到不同的人参皂苷骨架。
在人参属植物中,已鉴定出2种OSC参与人参皂苷生物合成:一为达玛烯二醇合酶(dammarenediol synthase,DS),负责形成达玛烷型骨架—达玛烯二醇(dammarenediol,DM),随后在原人参二醇合酶(PPDS,CYP716A47)作用下生成PPD,再经原人参三醇合酶(PPTS,CYP716A54)催化形成PPT[24-25];另一种为β-香树素合酶(β-amyrin synthase,β-AS),负责形成齐墩果烷型骨架—β-香树脂醇(β-amyrin),该骨架经齐墩果酸合酶(oleanolic acid synthase,OAS)催化可形成齐墩果酸[26]。奥克悌隆型骨架则可经2种途径形成:由2,3-氧化鲨烯通过SQE催化环氧化生成的2,3,22,23-二氧化角鲨烯(2,3,22,23-dioxidosqualene,DOC),进一步经OSC、CYP450催化生成奥克悌隆型人参皂苷元或者由PPD在SQE、CYP的催化作用下生成[27-28]。
人参皂苷上游生物合成途径已基本阐明,下游途径则包括细胞色素P450酶(cytochromeP450,CYP450)催化羟基化生成人参皂苷元,UDP糖基转移酶(UDP-glycosyltransferases,UGTs)进一步催化糖基化形成多种人参皂苷[29-30],见图2。
3 人参皂苷生物合成相关UGTs
目前已分离鉴定得到的糖基转移酶(glycosyltransferases,GTs)数量庞大,种类繁多,广泛存在于有机体中。根据已收集的GTs氨基酸序列的一致性,碳水化合物活性酶数据库(CAZy,http://www.cazy.org/)将GTs分为116个家族,其中GT1是最大的一个家族,能以UDP-葡萄糖(UDP-glucose,UDP-Glc)、UDP-木糖(UDP-xylose,UDP-Xyl)、UDP-鼠李糖(UDP-rhamnose,UDP-Rha)、UDP-阿拉伯糖(UDP-arabinose,UDP-Ara)和葡萄糖醛酸(UDP-glucuronic acid,UDP-GlcA)等为糖供体,也被称为UGTs。目前,UGT71、UGT73、UGT74、UGT85、UGT91和UGT94家族中多个UGTs已被鉴定具有催化合成人参皂苷的生物活性[31]。参与人参皂苷生物合成相关的UGTs见表1。已完成功能验证的UGTs主要集中在达玛烷型人参皂苷,并且糖供体以UDP-葡萄糖为主,UDP-木糖、UDP-鼠李糖的研究相对较少,具有较大研究潜力。
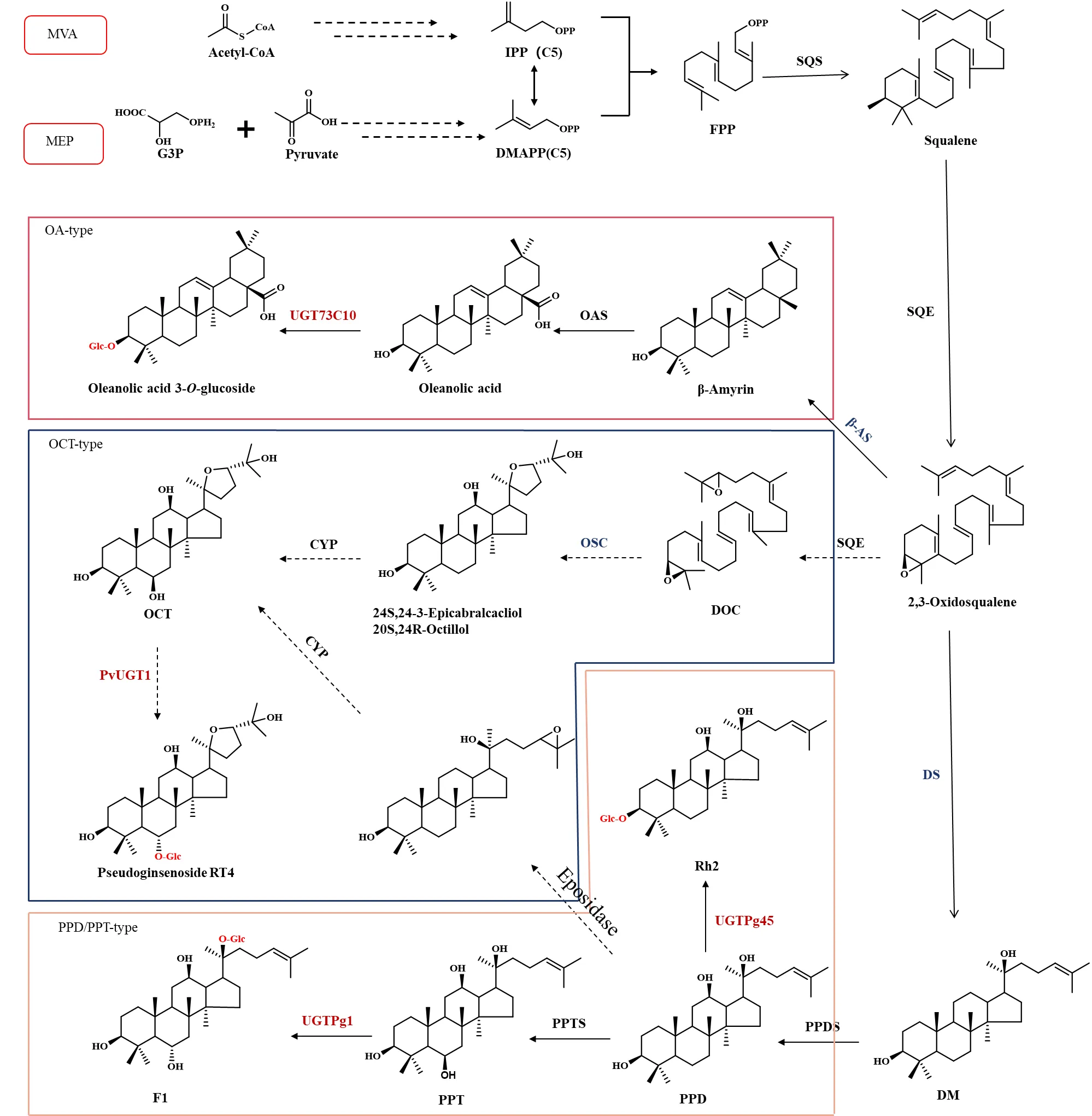
G3P-油醛-3-磷酸;GPP-香叶基焦磷酸;IPP-异戊烯基焦磷酸;DMAPP-二甲基烯丙基焦磷酸;FPP-法尼基焦磷酸;SQS-鲨烯合酶;SQ-鲨烯;SQE-鲨烯环氧酶;2,3-氧化鲨烯;DS-达玛烯二醇合酶;DM-达玛烯二醇;PPDS-原人参二醇合酶;PPTS-原人参三醇合酶;UGTs-UDP-葡萄糖基转移酶;β-AS-β-香树素合酶;OAS-齐墩果酸合酶;DOC-2,3,22,23-二氧化角鲨烯;CYP450-细胞色素P450酶。
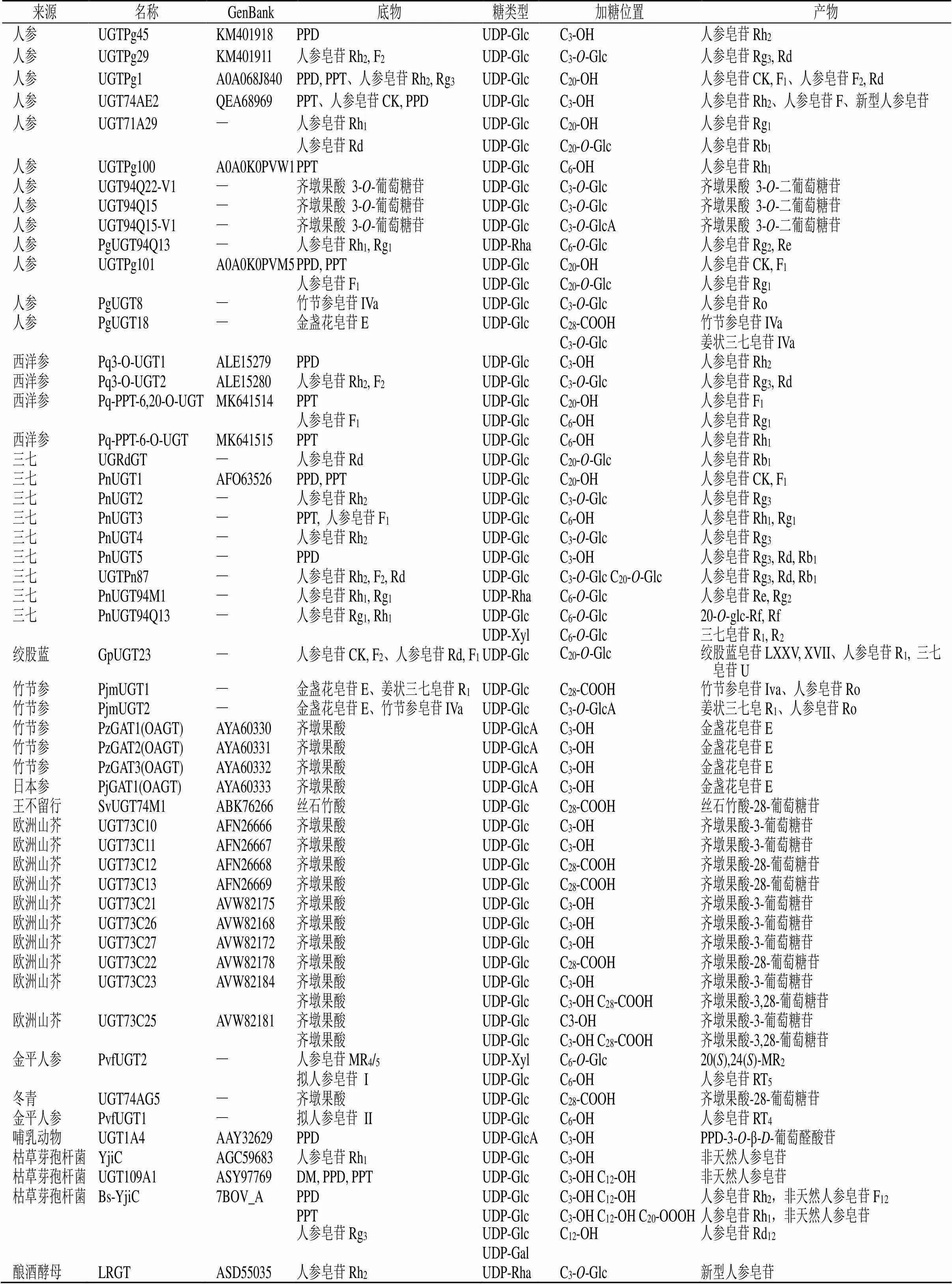
表1 公共数据库获得的参与人参皂苷糖基化的UGTs
3.1 植物UGTs
3.1.1 达玛烷型 达玛烷型人参皂苷是五加科植物人参C. A. Mey.、西洋参L、三七(Burkill) F. H. Chen ex C. H. Chow和葫芦科植物绞股蓝(Thunb.) Makino的主要活性成分。目前已从人参属植物中鉴定出数10种参与达玛烷型人参皂苷生物合成的UGTs,主要集中在UGT71、UGT74和UGT94家族,见图3。
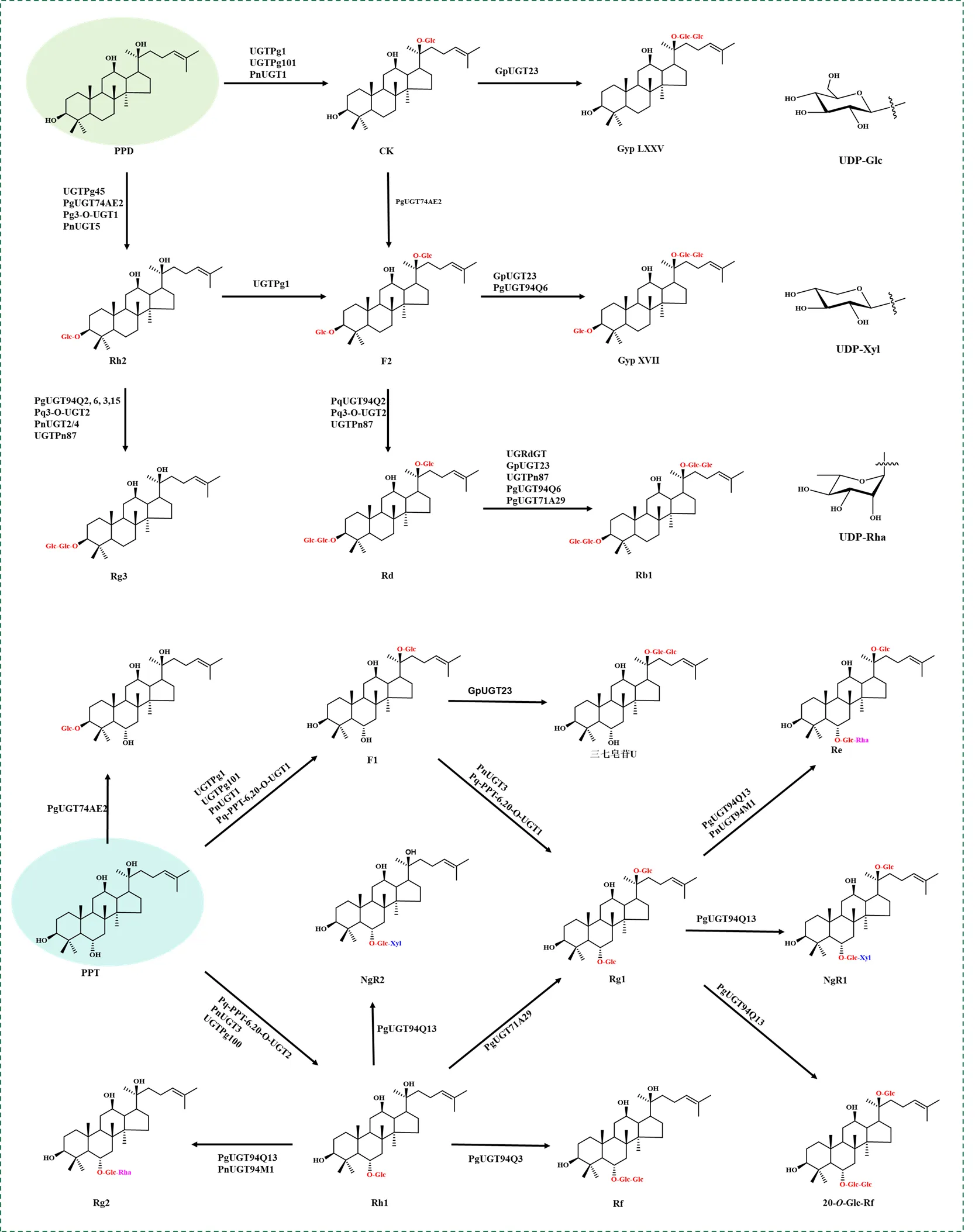
图3 植物UGTs催化达玛烷型人参皂苷元的糖基化反应
人参中已分离并鉴定的UGTs,催化人参皂苷的羟基发生糖基化时大多数表现出明显的区域选择性,但可以接受不同的底物作为糖受体。Jung等[32]对人参转录组进行测序和重新组装,表征出具有明显区域选择性的糖基转移酶PgUGT74AE2,只在C3-OH催化PPD和CK分别生成人参皂苷Rh2和F2。张婷婷等[33]发现PgUGT74AE2还能以PPT为底物,特异性地催化C3-OH发生糖基化,生成一种新型原人参三醇型皂苷3--β--吡喃葡萄糖-达玛-24-烯-3β, 6α, 12β, 20()-三醇。Wang等[34]通过相关表达序列和cDNA数据库克隆出UGTPg1(PgUGT71A53),该酶具有区域选择性,仅催化人参皂苷的C20-OH发生糖基化。同时Yan等[35]发现UGTPg1能以PPD、Rh2、Rg3和PPT为底物,分别生成人参皂苷CK、F2、Rd和F1。与底物杂泛性不同,少数UGTs则具有受体特异性。Wang等[34]克隆出具有受体特异性的糖基转移酶UGTPg45(PgUGT74AE4),仅能以PPD为底物,特异性地催化C3-OH发生糖基化,生成人参皂苷Rh2。此外,人参中氨基酸序列高度相似的UGTs,功能并不完全相同甚至基本不同。Lu等[36]发现PgUGT71A29与UGTPg1在氨基酸水平上高度相似,PgUGT71A29除了能催化人参皂苷Rh1的C20-OH发生糖基化生成人参皂苷Rg1外,还能催化人参皂苷Rd的C20--Glc发生糖基化生成人参皂苷Rb1。Wei等[37]从人参中分离出2个与UGTPg1高度相似的UGTs:UGTPg100(PgUGT71A54)能催化PPT的C6-OH发生糖基化生成人参皂苷Rh1;UGTPg101(PgUGT71A55)除了催化PPD和PPT的C20-OH发生糖基化生成人参皂苷CK及F1外,还能进一步催化F1的C6-OH发生糖基化生成人参皂苷Rg1。
上述UGTs主要催化单个糖基转移至人参皂苷或苷元的羟基,但大多数人参皂苷会在同一羟基上经连续糖基化反应延长糖链。Jung等[32,38]发现PgUGT94Q2(UGTPg29)能进一步在Rh2和F2的C3--Glc上进行糖基化,分别生成人参皂苷Rg3和Rd,这是首个被鉴定出能够催化人参皂苷糖链延伸的糖基转移酶。除UGT94Q2外,Yang等[39]通过分析UGT94家族的多样性,表征出一系列能在糖链上进行糖基化生成多糖苷的UGT94Qs:PgUGT94Q15能催化人参皂苷Rh2的C3--Glc发生糖基化生成人参皂苷Rg3;PgUGT94Q3能催化人参皂苷Rh1的C6--Glc和人参皂苷Rh2的C3--Glc发生糖基化,分别生成人参皂苷Rf、Rg3;PgUGT94Q6能催化人参皂苷Rh2的C3--Glc发生糖基化生成人参皂苷Rg3,同时能催化人参皂苷Rd、CK的C20--Glc发生糖基化分别生成人参皂苷Rb1、绞股蓝皂苷LXXV。除以葡萄糖作为糖供体外,Li等[40]从人参中鉴定出PgUGT94Q13能以鼠李糖为糖供体,在人参皂苷Rh1和人参皂苷Rg1的C6--Glc上进行糖基化,分别生成人参皂苷Rg2和人参皂苷Re,从而解决了人参皂苷Rg2和人参皂苷Re完整的生物合成途径。
西洋参的活性成分在生物合成过程中同样涉及多种UGTs。Lu等[41-42]从西洋参中分离得到2个催化PPD型人参皂苷的UGTs:Pq3--UGT1能够催化PPD的C3-OH发生糖基化,生成人参皂苷Rh2;Pq3-O-UGT2能够在人参皂苷Rh2、F2的C3--Glc上进行糖基化,生成人参皂苷Rg3、Rd。Feng等[43-44]通过克隆得到2个催化PPT型人参皂苷的UGTs:Pq-PPT-6,20--UGT1能催化PPT的C20-OH发生糖基化生成人参皂苷F1,又能进一步催化F1的C6-OH生成人参皂苷Rg1;Pq-PPT-6--UGT能催化PPT的C6-OH发生糖基化生成人参皂苷Rh1。
三七中也含有丰富的人参皂苷,如人参皂苷Rf、Rg1、Rg2、Re、Rd、Rb1等,UGTs对这些皂苷起着重要的修饰作用。Yue等[45]从三七悬浮细胞中分离纯化得到UGRdGT,该酶催化人参皂苷Rd的C20--Glc发生糖基化形成Rb1。Jiang等[46]从三七基因组中鉴定出5个参与人参皂苷生物合成的糖基转移酶(PnUGT1-PnUGT5):PnUGT1能催化PPD和PPT的C20-OH发生糖基化,分别生成人参皂苷CK、F1,与人参UGTPg100和UGTPg101功能一致;PnUGT3能催化PPT和F1的C6-OH发生糖基化,分别生成人参皂苷Rh1和人参皂苷Rg1,与人参中UGTPg1和UGTPg101功能一致;PnUGT5能催化PPD的C3-OH发生糖基化生成人参皂苷Rh2,PnUGT2和PnUGT4则能进一步催化人参皂苷Rh2的C3--Glc发生糖基化生成人参皂苷Rg3,与人参中UGTPg45和UGTPg29功能一致。除以葡萄糖为糖供体外,Hou等[47]还在三七中发现了以鼠李糖为糖供体的糖基转移酶PnUGT94M1,能在人参皂苷Rh1、Rg1的C6--Glc上进行糖基化,分别生成人参皂苷Re、人参皂苷Rg2,此前这2种人参皂苷完整的生物合成途径仅在人参中得到解析,该酶的发现为人参皂苷的体外合成提供了新思路。此外,三七中部分糖基转移酶表现出明显的糖供体杂泛性。Li等[48]从人参和三七中获得10个UGTs(PgUGT94Q12、PgUGT94Q13、PnUGT94Q14、PnUGT94Q27、PgUGT94Q10-V1、PgUGT94Q11-V1、PgUGT94Q11-V2、PnUGT94Q14-V1、PnUGT94Q14-V2、PnUGT94Q14-V3),均能以UDP-Xyl为糖供体催化人参皂苷Rg1和人参皂苷Rh1的C6--Glc发生糖基化分别生成三七皂苷NgR1和NgR2,同时能以UDP-Glc为糖供体生成人参皂苷20--Glc-Rf和Rf,其中以PgUGT94Q13效率较高。Li等[49]通过体外酶促反应证实三七中UGTPn87能以UDP-Glc为糖供体在PPD的C3-、C20--Glc上进行糖基化,同时还能以UDP-Xyl为糖供体。
绞股蓝为葫芦科植物,其主要活性成分为绞股蓝皂苷,但大部分绞股蓝皂苷与人参皂苷非常相似,Huang等[50]通过基因组共性分析和转录组测序发现绞股蓝皂苷Ⅲ、Ⅳ、Ⅷ、Ⅻ分别与人参皂苷Rb1、Rb3、Rd、F2同源。不仅如此,绞股蓝中人参皂苷的含量是人参的5倍且易培养,是个很好的替代资源,因此研究绞股蓝中参与人参皂苷生物合成的UGTs具有重要意义。Rahimi等[51]从绞股蓝中分离出GpUGT23,能够催化人参皂苷CK、F2、Rd和F1的C20--Glc发生糖基化,分别生成绞股蓝皂苷LXXV、XVII、人参皂苷Rb1和三七皂苷U。除上述已完成功能验证的UGTs外,绞股蓝中大多数参与人参皂苷生物合成的UGTs仍未实现功能表征。Liang等[52]通过绞股蓝转录组的杂交测序,推测出GpUGT35是绞股蓝皂苷生物合成的主要候选酶,属于UGT94家族,与PgUGT94Q2同源性高达50%。Zhang等[53]通过转录组和蛋白组初步推定UGT73B、UGT76B1、UGT74F2、UGT91C1和UGT91A1参与人参皂苷次生代谢,其中UGT74F2、UGT91A1和UGT91C1具有较高活性,但相关功能机制有待进一步探讨。
3.1.2 齐墩果烷型 齐墩果烷型人参皂苷属于五环三萜类皂苷,以竹节参为代表,包括齐墩果酸、人参皂苷Ro及人参皂苷Ro合成途径中的4种中间代谢物(金盏花皂苷E、齐墩果酸-28--葡萄糖苷、姜状三七皂苷R1和竹节参皂Ⅳa)。
在齐墩果烷型人参皂苷生物合成途径中,UGTs可催化人参皂苷元C3-OH和C28-COOH发生一步或连续多步糖基化反应。Tang等[54]从竹节参和日本参中鉴定了4个编码OAGT(、、和)的基因,均能对齐墩果酸的C3-OH进行葡萄糖醛酸化生成金盏花皂苷E。Zhang等[55]在人参中发现2个UGTs:PgUGT8能催化齐墩果酸、金盏花皂苷E、人参皂苷R1的C28-COOH发生葡萄糖醛酸化,分别生成齐墩果酸-28--葡萄糖苷、竹节参皂苷Ⅳa和人参皂苷Ro;PgUGT18能够催化金盏花皂苷E、竹节参皂Ⅳa的C3--Glc发生糖基化,分别生成人参皂苷R1和人参皂苷Ro。Meesapyodsuk等[56]在王不留行中发现与PgUGT8同源的糖基转移酶UGT74M1能催化丝石竹酸的C28-COOH形成葡萄糖酯。Yang等[39]在人参中发现UGT94Q15、UGT94Q15-V1和UGT94Q22-V1均可在齐墩果酸 3--葡萄糖苷的C3--Glc上进行糖基化,生成齐墩果酸3--二葡萄糖苷,其中UGT94Q15-V1还可催化金盏花皂苷E的C3--GlcA发生糖基化生成姜状三七皂苷R1。Tang等[57]从竹节参中鉴定出2个参与齐墩果烷型人参皂苷生物合成的糖基转移酶:PjmUGT1能催化金盏花皂苷E和姜状三七皂苷R1的C28-COOH发生糖基化,分别生成竹节参皂苷Ⅳa和人参皂苷Ro;PjmUGT2能催化金盏花皂苷E和竹节参皂苷Ⅳa的C3--Glc发生糖基化,分别生成姜状三七皂苷R1和人参皂苷Ro。Augustin等[58]从欧洲山芥的cDNA文库中筛选得到BvUGT1,能催化齐墩果酸发生糖基化,随后分离得到3个P型UGTs(UGT73C9、UGT73C10和UGT73C12)和2个G型UGTs(UGT73C11和UGT73C13)。其中UGT73C10和UGT73C11能作用于C3-OH且催化活性和特异性较高,催化产物中几乎只有3-单葡萄糖苷;UGT73C12和UGT73C13能作用于C28-COOH但催化活性和特异性较低,催化产物可形成少量3,28-二葡萄糖苷,在一定条件下UGT73C13还可产生齐墩果酸三糖苷;UGT73C9则无催化活性。Erthmann等[59]从欧洲山芥中选择相关基因异种表达后筛选得到6个UGT73Cs:UGT73C21、UGT73C22、UGT73C23、UGT73C25、UGT73C26和UGT73C27,其中UGT73C21、UGT73C26、UGT73C27仅能催化齐墩果酸C3-OH发生糖基化,而UGT73C22、UGT73C23、UGT73C25可作用于齐墩果酸C28-COOH。Ji等[60]从梅叶冬青转录组中克隆出UGT74AG5,能特异性地催化齐墩果酸C28-COOH发生糖基化,生成齐墩果酸28--葡萄糖苷,见图4。

图4 植物UGTs催化的齐墩果烷型和奥克梯隆型人参皂苷元的糖基化反应
3.1.3 奥克悌隆型 奥克悌隆型是人参皂苷的一个亚型,由达玛烷骨架和四氢呋喃环构成,通常在C3和C6位形成糖苷,是一类较罕见的人参皂苷,根据其C20和C24位绝对构型的不同可分为(20,24)-/ (20,24)-/(20,24)-/(20,24)-奥克悌隆型人参皂苷。与其他人参皂苷类型相比,奥克悌隆型人参皂苷集中分布在西洋参及金平人参中,包括PF11,RT2、RT4、RT5、Vina-ginsenoside R1(VR1)、VR2、VR5、VR6、Majonoside R1(MR1)、MR2和Yesanchinoside A、Yesanchinoside B、Yesanchinoside C[61],但自然界中含量相对较低。目前主要通过半合成方法,氧化环合次级达玛烷型人参皂苷得到奥克梯型人参皂苷,例如Wang等[62]将达玛烷型人参皂苷Rg2、Rg3分别转化为拟人参皂苷F11、GQ。此外,生物合成技术的发展为奥克悌隆型人参皂苷的异源合成提供了更简便的可行思路。
然而,目前人们对奥克悌隆型人参皂苷生物合成糖基转移酶知之甚少。Zhuang等[63]通过对金平人参转录组进行测序,推测并发现了4组基因:unigene0045236与三七中PnUGT1基因序列相同,unigene0071620与欧洲山芥中UGT73C11、UGT73C10基因序列高度同源,unigene0063740、unigene0063744与UGT74M1关系密切。近年来,Peng等[64]通过体外酶促反应,从金平人参中确定了2类参与奥克悌隆型人参皂苷MR2生物合成的关键UGTs:PvfUGT1能催化20(),24()-拟人参皂苷元Ⅱ和20(),24()-拟人参皂苷元I的C6-OH发生糖基化,分别生成假人参皂苷RT4和RT5;PvfUGT2能以木糖为糖供体,特异性地在C6--Glc催化RT4和RT5生成20(),24()-MR2,见图4。
此外,PvfUGT2与PgUGT94Q13、UGTPn12、UGTPn87具有高度同源性,但因关键氨基酸残基的差异而表现出不同功能,相关催化机制有待进一步研究。
3.2 动物UGTs
UGTs也普遍存在于动物体内,在药物解毒和药物清除等方面发挥着重要作用[65-66]。Li等[67]通过重组同工酶分析,在人肝微粒体中发现了能够实现PPD葡萄糖醛酸化的糖基转移酶:UGT1A4能在C3-OH催化PPD生成PPD-3--β--葡萄糖醛酸苷,且活性最高,UGT1A3次之。Chen等[68]对绞股蓝皂苷(与PPD结构相似)进行代谢分析,进一步证明UGT1A4能催化C3-OH发生葡萄糖醛酸化(图5)。目前动物来源的UGTs报道相对较少,且主要集中在葡萄糖醛酸化。
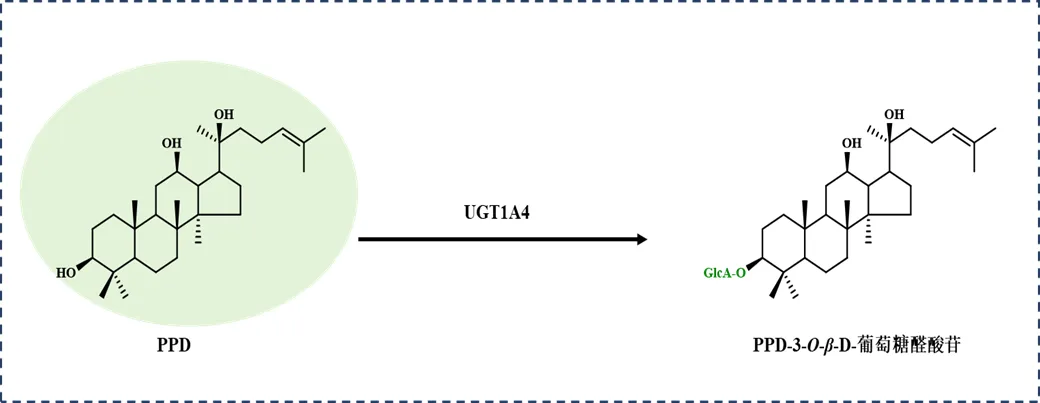
图5 人源UGT催化的人参苷元糖基化反应
3.3 微生物UGTs
除植物与动物外,近年来也不断有研究报道细菌和真菌中含有新的UGTs,如枯草芽孢杆菌、地衣芽孢杆菌、鼠李糖乳酸杆菌等。其中枯草芽孢杆菌主要负责人参皂苷的糖基化反应:Luo等[69]从枯草芽孢杆菌CCTCC AB 2012913中克隆并鉴定出YjiC1,能催化人参皂苷Rh1的C3-OH发生糖基化,合成非天然人参皂苷3--β--吡喃葡萄糖-6--β--吡喃葡萄糖-20()-原人参三醇(3--β--Glc-6--β--Glc-PPT),这是首个从枯草芽孢杆菌中鉴定出来的糖基转移酶。Liang等[70]从枯草芽孢杆菌CTCC 63501中克隆得到UGT109A1,除催化DM的C3-、C20-OH生成非天然人参皂苷3--β--吡喃葡萄糖-达玛-24-烯-3β,20()-二醇(3β--Glc-DM)、3,20-di--β--吡喃葡萄糖-达玛-24-烯-3β,20()-二醇(3β,20-二--Glc-DM)外,还能催化PPD/PPT的C3-、C12-OH发生糖基化生成3,12-二--β--吡喃葡萄糖-达玛-24-烯-3β,12β,20()-三醇(3β,12β-二--Glc-PPD)和3,12-di--β--吡喃葡萄糖-达玛-24-烯-3β,6,12β,20()-四醇(3β,12β-二--Glc-PPT)。这是首次在自然界中发现能够催化人参皂苷C12-OH糖基化的UGTs。Zhang等[71]进一步研究UGT109A1对PPT型人参皂苷Re、Rf、Rh1和R1的作用,发现在人参皂苷Re、R1的C12-OH上无糖基化产物,这或许与C20--Glc的阻碍有关,相关机制有待深入研究。Dai等[72-73]从枯草芽孢杆菌168中分离出与UGT109A1氨基酸序列相似度高达94.39%的糖基转移酶Bs-YjiC,能催化PPD的C3-OH发生糖基化生成天然人参皂苷Rh2及催化PPD的C3-、C12-OH生成非天然人参皂苷F12;催化PPT的C6-OH发生糖基化生成天然人参皂苷Rh1,也能催化PPT的C3-、C6-和/或C12-OH生成4种非天然人参皂苷(3--β--Glc-PPT、3--β--Glc-6--β--Glc-PPT、3--β--Glc-12--β--Glc-PPT、3--β--Glc-6--β--Glc-12--β--Glc-PPT)。Hu等[74]还首次发现Bs-YjiC能选择性地催化人参皂苷Rg3的C12-OH发生糖基化,生成非天然人参皂苷Rd12。与UGT109A1严格的糖供体特异性不同,Dai等[75]发现糖基转移酶Bs-YjiC表现出糖供体杂泛性,能以UDP-葡萄糖、UDP-半乳糖(UDP-galacose,UDP-Gal)和UDP-葡萄糖醛酸为供体催化人参皂苷发生糖基化。除枯草芽孢杆菌外,Wang等[76]从鼠李糖乳酸杆菌中鉴定出糖基转移酶LRGT,能连续催化人参皂苷Rh2的C3--Glc发生糖基化,生成2种新型人参皂苷:葡萄糖基人参皂苷Rh2,该分子式和相对分子质量与人参皂苷Rg3相同,在人参皂苷Rh2的C3--Glc以C6-C1键连接单个葡萄糖基,是人参皂苷Rg3的异构体(C2-C1);二葡萄糖基人参皂苷Rh2则在人参皂苷Rh2的C3-OH以C6-C1键连接2个葡萄糖基。Zhuang等[77]在酿酒酵母中发现UGT51能催化PPD的C3-OH发生糖基化,生成人参皂苷Rh2(图6)。内生细菌与真菌内不断被发现与鉴定的UGTs,极大促进了新型人参皂苷生物合成途径的完善,为体外大规模合成新型人参皂苷提供了更多新的思路。
4 合成生物学在人参皂苷生产中的应用
利用合成生物学技术高效生产人参皂苷的核心是对其生物合成途径中的关键酶进行挖掘。近年来,随着催化人参皂苷生物合成的糖基转移酶逐步被发现,基于合成生物学原理,设计和改造微生物,异源合成天然或非天然产物被认为是较有潜力的替代方法。Zhou等[78]在合成PPD的酵母菌株中过表达和基因,生产出效价为7.0 mg/L的非天然人参皂苷3β,12β-二--Glc-PPT,并发现的K73A突变可显著提高3β,12β-二--Glc-PPD产量。Wang等[79]通过体内定向进化提高了UGTPg45的受体特异性和催化活性,将其引入酿酒酵母细胞工厂中,相同PPD底盘细胞中人参皂苷Rh2的产量提高了70%。Li等[48]通过蛋白工程技术系统优化了高产PPT的酵母菌株,能为异源生物合成途径增加前体供应,导入PgUGTA54基因后建立了生产人参皂苷Rg1、三七皂苷R1、三七皂苷R2的细胞工厂,得到的产物滴度分别为1.95、1.62、1.25 g/L。由此可见,以酿酒酵母、解脂耶氏酵母等为底盘细胞,引入UGT基因是酵母细胞工程生产人参皂苷的一种有效方法,具有反应条件简单温和,催化效率和区域选择性较高及成本相对较低等优势[80-81]。
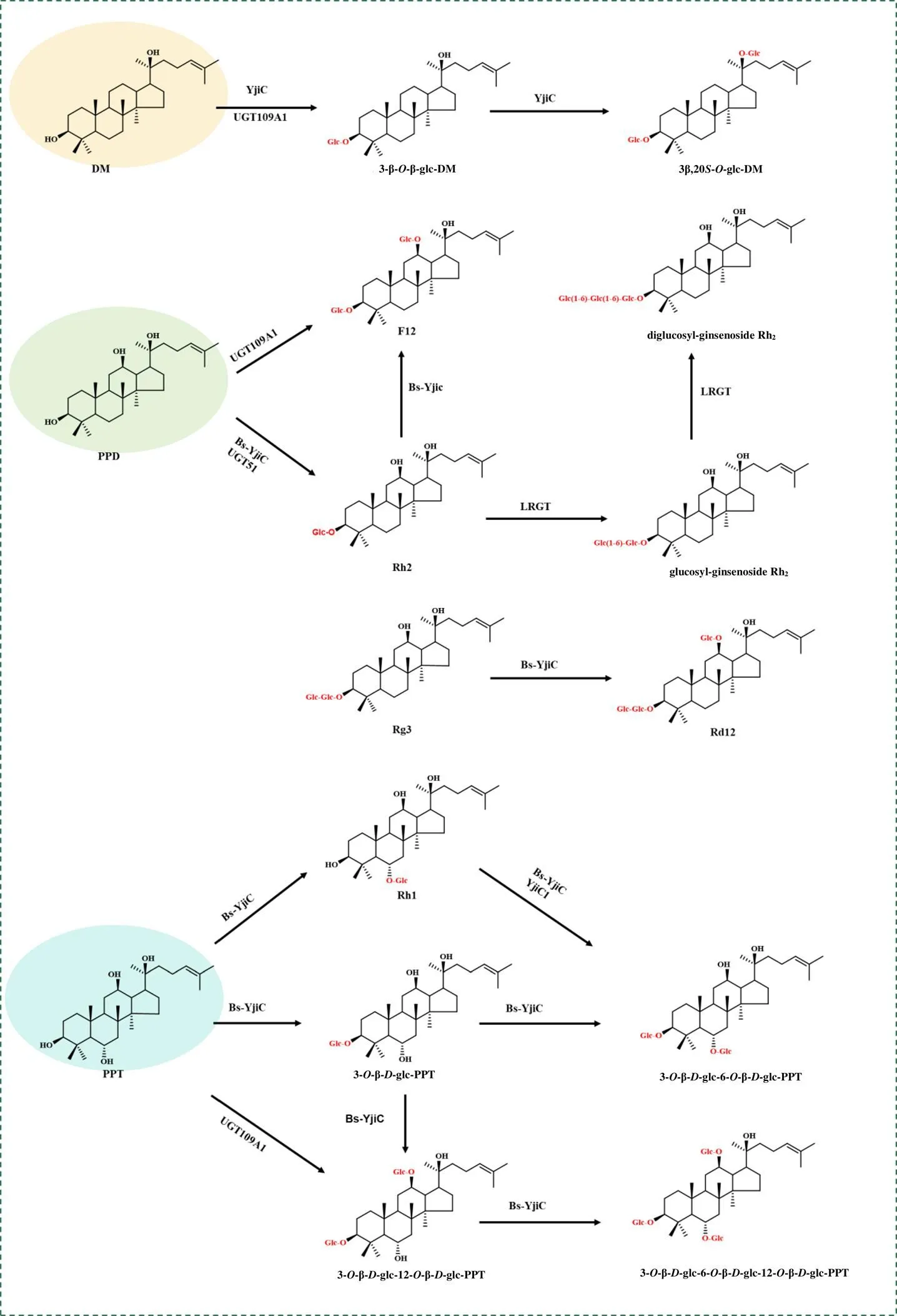
图6 原核生物UGTs催化的人参苷元糖基化反应
不仅如此,随着UGTs晶体结构不断被解析,相关功能的特异性和杂泛性已能从结构生物学角度得到初步阐明。UGTs的N端和C端分别是识别受体底物和糖供体的2个Rossmann折叠。N端的保守基序(即UGTs的配体结合口袋)与UGTs识别底物、催化位点有关,例如UGT71、74和94家族的N端均含有一个保守基序以确保与特定底物结合,并且有研究表明替换或突变配体结合口袋的残基及交换结构域可以改善UGTs的催化性能及底特异性[3, 82]。C端的高度保守序列(PSPG基序)被认为是激活糖结合的位点,其中第44位谷氨酰胺对葡萄糖具有一定偏好性,而半乳糖转移酶活性则需要组氨酸[12, 83]。尽管单个残基在识别糖供体时可能起着决定性作用,但通常需要多个氨基酸进行识别,因此研究不同偏好的UGTs结构有助于加深对糖供体特异性的了解。这都为UGTs提高特异性或催化活性以量产人参皂苷奠定理论基础。
随着人参皂苷的生物合成途径被逐渐解析,关键UGTs的研究发现和功能表征越发深入,蛋白质工程、合成生物学和代谢工程技术进一步优化,微生物细胞工厂极有可能成为人参皂苷大规模生物合成的突破点。
5 结语与展望
糖基化在人参皂苷的生物合成过程中起着重要的修饰作用,能够提高产物生物活性,丰富其结构多样性。UGTs的不断发现及对其种类和功能的深入研究,可有效厘清各种类型人参皂苷的生源途径。除用于生源途径解析外,基于合成生物学技术,只需将糖基转移酶基因导入异源底盘微生物中便可实现目标人参皂苷的从头合成。目前基于基因测序技术和生物信息学分析的迅速发展,已有相当一部分UGTs实现功能表征,但UGTs数量庞大、种类繁多,已完成功能鉴定的糖基转移酶与之相比极其有限,仍需发现新的UGTs来合成人参皂苷[84]。此外,在人参皂苷生物合成过程中,大多数UGTs可以催化不同底物发生糖基化,在微生物异源系统中设计合成人参皂苷时,提高UGTs的催化效率和特异性仍是关键。
目前,糖基化合物定性主要通过质谱分析、核磁共振等方法对糖基化修饰的类型及位置展开分析,其中-糖苷最为常见,-糖苷次之,-和-糖苷较少,研究的关键在于尽可能全面地对大量未知代谢物进行结构阐明,提高质谱检测的灵敏度仍是优化糖基化合物定性的可行方案之一。同时联用非靶向代谢组学方法有助于对代谢物及植物次生代谢途径进行深入挖掘,从而高效助力合成生物学的发展。随着基因组测序、代谢工程及合成生物学等技术不断优化,多种方法学的创新融合,不仅能更全面地解析UGTs的催化功能,而且在糖基化合物定性的准确性等方面有较大提高[85]。同时人参皂苷生物合成途径中UGTs活性的提升和底盘细胞的改造,有望进一步提高微生物细胞工厂异源合成人参皂苷的效率和产量,使人参皂苷的工业化生产成为可能。
利益冲突 所有作者均声明不存在利益冲突
[1] 鲁歧, 富力, 李向高. 人参属植物分类学的研究进展 [J]. 吉林农业大学学报, 1992, 14(4): 107-111.
[2] Li X Y, Sun L W, Zhao D Q. Current status and problem-solving strategies for ginseng industry [J]., 2019, 25(12): 883-886.
[3] Hou M Q, Wang R F, Zhao S J,. Ginsenosides ingenus and their biosynthesis [J]., 2021, 11(7): 1813-1834.
[4] Valdés-González J A, Sánchez M, Moratilla-Rivera I,. Immunomodulatory, anti-inflammatory, and anti-cancer properties of ginseng: A pharmacological update [J]., 2023, 28(9): 3863.
[5] He N, Zhao S Q, He Y F,. Current status of research on ginseng cosmetics [J]., 2018, 16(4): 609-616.
[6] Gershenzon J, Dudareva N. The function of terpene natural products in the natural world [J]., 2007, 3(7): 408-414.
[7] 李铭莹, 林霖, 王岩, 等. 人参皂苷抗肿瘤机制及其纳米药物递送系统的研究进展[J]. 中草药, 2024, 55(2): 688-696.
[8] Zhang J J, Su H, Zhang L,. Comprehensive characterization for ginsenosides biosynthesis in ginseng root by integration analysis of chemical and transcriptome [J]., 2017, 22(6): 889.
[9] Zhuravlev Y N, Koren O G, Reunova G D,.natural populations: Their past, current state and perspectives [J]., 2008, 29(9): 1127-1136.
[10] Tansakul P, Shibuya M, Kushiro T,. Dammarenediol-II synthase, the first dedicated enzyme for ginsenoside biosynthesis, in[J]., 2006, 580(22): 5143-5149.
[11] 李冰, 张传波, 宋凯, 等. 生物合成稀有人参皂苷的研究进展 [J]. 中国生物工程杂志, 2021, 41(6): 71-88.
[12] Zhou C, Gong T, Chen J J,. The glycosyltransferases involved in triterpenoid saponin biosynthesis: A review [J]., 2022, 38(3): 1004-1024.
[13] Chu L L, Huy N Q, Tung N H. Microorganisms for ginsenosides biosynthesis: Recent progress, challenges, and perspectives [J]., 2023, 28(3): 1437.
[14] Yang W Z, Hu Y, Wu W Y,. Saponins in the genusL. (Araliaceae): A systematic review of their chemical diversity [J]., 2014, 106: 7-24.
[15] 严华, 张慧秀, 白宗利, 等. 基于特征图谱的人参属药材西洋参、人参、三七的比较 [J]. 世界中医药, 2021, 16(6): 887-895.
[16] 刘洋. 西洋参质量等级标准研究 [D]. 吉林: 吉林农业大学, 2019.
[17] 刘永利, 雷蓉, 王晓蕾, 等. 基于中药质量标志物的人参、西洋参、三七及相关中成药质量控制方法研究 [J]. 中国药学杂志, 2019, 54(17): 1402-1410.
[18] 莫秀丽, 任红红, 高晴晴, 等. 不同干燥方式对人参果浆中稀有皂苷生成的影响[J]. 中草药, 2023, 54(24): 8200-8205.
[19] 赵立春. 人参化学成分的提取及测试方法的优化研究 [D]. 北京: 中国农业科学院, 2019.
[20] Xie G X, Plumb R, Su M M,. Ultra-performance LC/TOF MS analysis of medicinalherbs for metabolomic research [J]., 2008, 31(6/7): 1015-1026.
[21] Zhang Y C, Li G, Jiang C,. Tissue-specific distribution of ginsenosides in different aged ginseng and antioxidant activity of ginseng leaf [J]., 2014, 19(11): 17381-17399.
[22] Kim Y J, Zhang D B, Yang D C. Biosynthesis and biotechnological production of ginsenosides [J]., 2015, 33(6 Pt 1): 717-735.
[23] 张浩然, 叶安琪, 张跃伟, 等. 人参皂苷衍生化及生物活性研究进展[J]. 中草药, 2022, 53(14): 4554-4567.
[24] Han J Y, Kim H J, Kwon Y S,. The Cyt P450 enzyme CYP716A47 catalyzes the formation of protopanaxadiol from dammarenediol-II during ginsenoside biosynthesis in[J]., 2011, 52(12): 2062-2073.
[25] Han J Y, Hwang H S, Choi S W,. Cytochrome P450 CYP716A53v2 catalyzes the formation of protopanaxatriol from protopanaxadiol during ginsenoside biosynthesis in[J]., 2012, 53(9): 1535-1545.
[26] Han J Y, Kim M J, Ban Y W,. The involvement of β-amyrin 28-oxidase (CYP716A52v2) in oleanane-type ginsenoside biosynthesis in[J]., 2013, 54(12): 2034-2046.
[27] Christensen L P. Ginsenosides chemistry, biosynthesis, analysis, and potential health effects [J]., 2009, 55: 1-99.
[28] Shan H, Segura M J, Wilson W K,. Enzymatic cyclization of dioxidosqualene to heterocyclic triterpenes [J]., 2005, 127(51): 18008-18009.
[29] Kim Y J, Zhang D B, Yang D C. Biosynthesis and biotechnological production of ginsenosides [J]., 2015, 33(6 Pt 1): 717-735.
[30] Augustin J M, Kuzina V, Andersen S B,. Molecular activities, biosynthesis and evolution of triterpenoid saponins [J]., 2011, 72(6): 435-457.
[31] Khorolragchaa A, Kim Y J, Rahimi S,. Grouping and characterization of putative glycosyltransferase genes fromMeyer [J]., 2014, 536(1): 186-192.
[32] Jung S C, Kim W, Park S C,. Two ginseng UDP-glycosyltransferases synthesize ginsenoside Rg3 and rd [J]., 2014, 55(12): 2177-2188.
[33] 张婷婷, 梁会超, 巩婷, 等. 人参糖基转移酶PgUGT74AE2催化生成新型人参三醇皂苷研究 [J]. 药学学报, 2018, 53(9): 1565-1570.
[34] Wang P P, Wei Y J, Fan Y,. Production of bioactive ginsenosides Rh2 and Rg3 by metabolically engineered yeasts [J]., 2015, 29: 97-105.
[35] Yan X, Fan Y, Wei W,. Production of bioactive ginsenoside compound K in metabolically engineered yeast [J]., 2014, 24(6): 770-773.
[36] 卢骏. 甘草和人参不定根代谢调控及糖基转移酶UGT71A29的功能研究 [D]. 天津: 天津大学, 2019.
[37] Wei W, Wang P P, Wei Y J,. CharacterizationofUDP-glycosyltransferases catalyzing protopanaxatriol and biosyntheses of bioactive ginsenosides F1 and Rh1in metabolically engineered yeasts [J]., 2015, 8(9): 1412-1424.
[38] Jung S C, Kim W, Park S C,. Two ginseng UDP-glycosyltransferases synthesize ginsenoside Rg3and rd [J]., 2014, 55(12): 2177-2188.
[39] Yang C S, Li C J, Wei W,. The unprecedented diversity of UGT94-family UDP-glycosyltransferases inplants and their contribution to ginsenoside biosynthesis [J]., 2020, 10(1): 15394.
[40] Li C J, Yan X, Xu Z Z,. Pathway elucidation of bioactive rhamnosylated ginsenosides inand theirhigh-level production by engineered[J]., 2022, 5(1): 775.
[41] Lu C, Zhao S J, Wang X S. Functional regulation of a UDP-glucosyltransferase gene (Pq3-O-UGT1) by RNA interference and overexpression in[J]., 2017, 129(3): 445-456.
[42] Lu C, Zhao S J, Wei G N,. Functional regulation of ginsenoside biosynthesis by RNA interferences of a UDP-glycosyltransferase gene inand[J]., 2017, 111: 67-76.
[43] Feng P C, Li G X, Wang X S,. Identification and RNAi-based gene silencing of a novel UDP-glycosyltransferase from[J]., 2021, 144(3): 567-576.
[44] 冯鹏程. 西洋参Pq-PPT-6, 20--UGT和Pq-PPT-6--UGT糖基转移酶基因的克隆与功能分析 [D]. 长春: 吉林大学, 2019.
[45] Yue C J, Zhong J J. Purification and characterization of UDPG: Ginsenoside Rd glucosyltransferase from suspended cells of[J]., 2005, 40(12): 3742-3748.
[46] Jiang Z Q, Tu L C, Yang W F,. The chromosome-level reference genome assembly forand insights into ginsenoside biosynthesis [J]., 2021, 2(1): 100113.
[47] Hou M Q, Nie F, Zhao J N,. New glycosyltransferases inperfect main ginsenosides biosynthetic pathways [J]., 2023, 71(1): 963-973.
[48] Li X D, Wang Y M, Fan Z J,. High-level sustainable production of the characteristic protopanaxatriol-type saponins fromspecies in engineered[J]., 2021, 66: 87-97.
[49] Li Y T, Li J X, Diao M X,. Characterization of a group of UDP-glycosyltransferases involved in the biosynthesis of triterpenoid saponins of[J]., 2022, 11(2): 770-779.
[50] Huang D, Ming R H, Xu S Q,. Chromosome-level genome assembly ofprovides insights into gypenoside biosynthesis [J]., 2021, 28(5): dsab018.
[51] Rahimi S, Kim J, Mijakovic I,. Triterpenoid-biosynthetic UDP-glycosyltransferases from plants [J]., 2019, 37(7): 107394.
[52] Liang T T, Zou L Q, Sun S J,. Hybrid sequencing of thetranscriptome provides new insights into gypenoside biosynthesis [J]., 2019, 20(1): 632.
[53] Zhang Y M, Chen Q C, Huang Y H,. Gene excavation and expression analysis of CYP and UGT related to the post modifying stage of gypenoside biosynthesis in(Thunb.) Makino by comprehensive analysis of RNA and proteome sequencing [J]., 2021, 16(12): e0260027.
[54] Tang Q Y, Chen G, Song W L,. Transcriptome analysis ofidentifies genes encoding oleanolic acid glucuronosyltransferase involved in the biosynthesis of oleanane-type ginsenosides [J]., 2019, 249(2): 393-406.
[55] Zhang H, Hua X, Zheng D R,.biosynthesis of oleanane-type ginsenosides inusing two types of glycosyltransferases from[J]., 2022, 70(7): 2231-2240.
[56] Meesapyodsuk D, Balsevich J, Reed D W,. Saponin biosynthesis incDNAs encoding beta-amyrin synthase and a triterpene carboxylic acid glucosyltransferase [J]., 2007, 143(2): 959-969.
[57] Tang J R, Chen G, Lu Y C,. Identification of two UDP-glycosyltransferases involved in the main oleanane-type ginsenosides invar.[J]., 2021, 253(5): 91.
[58] Augustin J M, Drok S, Shinoda T,. UDP-glycosyltransferases from the UGT73C subfamily incatalyze sapogenin 3--glucosylation in saponin-mediated insect resistance [J]., 2012, 160(4): 1881-1895.
[59] Erthmann P Ø, Agerbirk N, Bak S. A tandem array of UDP-glycosyltransferases from the UGT73C subfamily glycosylate sapogenins, forming a spectrum of mono- and bisdesmosidic saponins [J]., 2018, 97(1/2): 37-55.
[60] Ji X Y, Lin S M, Chen Y Y,. Identification of α-amyrin 28-carboxylase and glycosyltransferase fromand production of ursolic acid 28--β--glucopyranoside in engineered yeast [J]., 2020, 11: 612.
[61] Liu J, Xu Y R, Yang J J,. Discovery, semisynthesis, biological activities, and metabolism of ocotillol-type saponins [J]., 2017, 41(3): 373-378.
[62] Wang J R, Yau L F, Zhang R,. Transformation of ginsenosides from notoginseng by artificial gastric juice can increase cytotoxicity toward cancer cells [J]., 2014, 62(12): 2558-2573.
[63] Zhang G H, Ma C H, Zhang J J,. Transcriptome analysis ofvar.discovers putative ocotillol-type ginsenosides biosynthesis genes and genetic markers [J]., 2015, 16(1): 159.
[64] Peng S F, Li X B, Jiang W W,. Identification of two key UDP-glycosyltransferases responsible for the ocotillol-type ginsenoside majonside-R2 biosynthesis invar. fuscidiscus [J]., 2023, 257(6): 119.
[65] Lee H, Heo J K, Lee G H,. Ginsenoside rc is a new selective UGT1A9 inhibitor in human liver microsomes and recombinant human UGT isoforms [J]., 2019, 47(12): 1372-1379.
[66] Oda S, Fukami T, Yokoi T,. A comprehensive review of UDP-glucuronosyltransferase and esterases for drug development [J]., 2015, 30(1): 30-51.
[67] Li J, He C Y, Fang L X,. Identification of human UDP-glucuronosyltransferase 1A4 as the major isozyme responsible for the glucuronidation of 20(S)-protopanaxadiol in human liver microsomes [J]., 2016, 17(3): 205.
[68] Chen J, Qin L, Wu X D,. Identification of human UDP-glucuronosyltransferase involved in gypensapogenin C glucuronidation and species differences [J]., 2023, 24(2): 1454.
[69] Luo S L, Dang L Z, Zhang K Q,. Cloning and heterologous expression of UDP-glycosyltransferase genes fromand its application in the glycosylation of ginsenoside Rh1[J]., 2015, 60(1): 72-78.
[70] Liang H C, Hu Z F, Zhang T T,. Production of a bioactive unnatural ginsenoside by metabolically engineered yeasts based on a new UDP-glycosyltransferase from[J]., 2017, 44: 60-69.
[71] Zhang T T, Gong T, Hu Z F,. Enzymatic synthesis of unnatural ginsenosides using a promiscuous UDP-glucosyltransferase from[J]., 2018, 23(11): 2797.
[72] Dai L H, Li J, Yao P Y,. Exploiting the aglycon promiscuity of glycosyltransferase Bs-YjiC fromand its application in synthesis of glycosides [J]., 2017, 248: 69-76.
[73] Dai L H, Liu C, Li J,. One-pot synthesis of ginsenoside Rh2 and bioactive unnatural ginsenoside by coupling promiscuous glycosyltransferase from168 to sucrose synthase [J]., 2018, 66(11): 2830-2837.
[74] Hu Y M, Li H, Qu Y Y,. Biocatalytic synthesis of a novel bioactive ginsenoside using UDP-glycosyltransferase from168 [J]., 2020, 10(3): 289.
[75] Dai L H, Qin L J, Hu Y M,. Structural dissection of unnatural ginsenoside-biosynthetic UDP-glycosyl- transferase Bs-YjiC fromfor substrate promiscuity [J]., 2021, 534: 73-78.
[76] Wang D D, Kim Y J, Baek N I,. Glycosyltransformation of ginsenoside Rh2 into two novel ginsenosides using recombinant glycosyltransferase fromand itsapplications [J]., 2021, 45(1): 48-57.
[77] Zhuang Y, Yang G Y, Chen X H,. Biosynthesis of plant-derived ginsenoside Rh2 in yeast via repurposing a key promiscuous microbial enzyme [J]., 2017, 42: 25-32.
[78] Zhou C, Gong T, Chen J J,. Production of a novel protopanaxatriol-type ginsenoside by yeast cell factories [J]., 2023, 10(4): 463.
[79] Wang P P, Wei W, Ye W,. Synthesizing ginsenoside Rh2 incell factory at high-efficiency [J]., 2019, 5: 5.
[80] 毕慧萍, 刘晓楠, 李清艳, 等. 植物天然产物微生物重组合成研究进展 [J]. 生物工程学报, 2022, 38(11): 4263-4282.
[81] Geraldi A. Advances in the production of minor ginsenosides using microorganisms and their enzymes [J]., 2020, 1(1): 15-24.
[82] Wang D D, Liu M Z, Shen Y Q,. Research progress in understanding the structure, mechanism, and engineering of plant glycosyltransferases [J]., 2019, 49(9): 1133-1142.
[83] Rahimi S, Kim J, Mijakovic I,. Triterpenoid-biosynthetic UDP-glycosyltransferases from plants [J]., 2019, 37(7): 107394.
[84] 王海娇, 李宇兴, 佟爱仔, 等. 人参UGT基因家族功能研究进展 [J]. 人参研究, 2022, 34(2): 54-57.
[85] Wu J, Zhu W, Shan X,. Glycoside-specific metabolomics combined with precursor isotopic labeling for characterizing plant glycosyltransferases [J]., 2022, 15(10): 1517-1532.
Uridine diphosphate-dependent glycosyltransferase related to ginsenoside biosynthesis
TONG Jing1, YANG Deying2, ZHANG Qian1, LI Zhixin1, DONG Zishu1, LIU Hongning1, HUANG Jia1
1. Research Center for Differentiation and Development of TCM Basic Theory, Jiangxi Province Key Laboratory of TCM Etiopathogenisis, Institute for Advanced Study,Jiangxi University of Chinese Medicine, Nanchang 330004 China 2. Affiliated Hospital of Guangdong Medical University, Zhanjiang 524001 China
Ginsenosides are a class of important natural products with rich pharmacological activities, including dammarane type (protopanaxadiol type, PPD-type/proto-panaxatriol type, PPT-type), oleanane type (OA-type) and ocotillol type (OCT-type), which can be widely used in the fields of medicine, agriculture and industrial production. Uridine diphosphate (UDP)- dependent glycosyltransferases (UGTs) are the key enzymes that catalyze the production of ginsenosides, and play an important role in their chemical structure formations and pharmacological functions. This review summarized the distributions, structural diversities and biosynthesis pathways of ginsenosides. In addition, according to the types of several common ginsenosides, we emphasized the UGTs related to glycosylation reactions to provide reference for ginsenoside biosynthesis.
glycosylation; glycosyltransferase; ginsenosides; natural products; dammarane type; oleanane type; biosynthesis
R286.2
A
0253 - 2670(2024)09 - 3202 - 15
10.7501/j.issn.0253-2670.2024.09.033
2023-10-02
江西省教育厅科技计划青年项目(GJJ2200973);江西中医药大学博士科研启动基金课题(2022BSZR001);江西省卫生健康委员会科技计划项目(202311138)
童 婧,本科生,研究方向为中药活性天然产物生物合成。E-mail: 2644533042@qq.com
杨德盈,中药学博士,研究方向为药物化学。E-mail: yangdeying987@163.com
通信作者:刘红宁,教授,从事中药药剂学研究。E-mail: 19820002@jxutcm.edu.cn
黄 佳,讲师,从事中药活性天然产物生物合成研究。E-mail: novelleo@163.com
[责任编辑 时圣明]
