苗药血人参提取物水凝胶的制备及促创面愈合体内外研究
2024-05-14宋选飞张永萍
宋选飞,杨 露,谢 欢,周 斌,刘 耀, 2, 3,徐 剑, 2, 3*,张永萍, 2, 3*
苗药血人参提取物水凝胶的制备及促创面愈合体内外研究
宋选飞1,杨 露1,谢 欢1,周 斌1,刘 耀1, 2, 3,徐 剑1, 2, 3*,张永萍1, 2, 3*
1. 贵州中医药大学,贵州 贵阳 550025 2. 贵州省民族药经皮给药制剂工程技术研究中心,贵州 贵阳 550025 3. 国家苗药工程技术研究中心,贵州 贵阳 550025
制备一种载苗药血人参提取物的聚乙烯醇(PVA)/木质素(Lig)/壳聚糖(CS)水凝胶并探究其促创面愈合机制。在单因素考察的基础上,正交试验优选处方工艺并对其进行质量评价和体外生物评价,通过建立大鼠全层皮肤损伤模型,评价其促创愈合效果。携载提取物的PVA/Lig/CS水凝胶的最优处方和制备工艺为PVA用量7.0 g、CS用量4.0 g、Lig用量0.5 g、冻融循环次数4次,每次冻结6 h。该凝胶具有多孔网状结构、良好的溶胀性、保湿性及一定的机械强度,同时具有良好的生物相容性、抑菌性以及有效抑制巨噬细胞细胞迁移,且抑制作用可能与时间呈正比。该水凝胶的体内药效学研究显示,其促创面愈合作用可能与减少创面组织炎性细胞浸润,促进巨噬细胞向M2型极化、增加毛血细管生成和纤维组织形成有关。制备的载血人参提取物的PVA/Lig/CS水凝胶剂制备工艺简单、稳定可行、具有良好的缓释性能,且对全层皮肤损伤具较好的治疗效果。
血人参提取物;PVA/Lig/CS水凝胶;创面愈合;体外生物评价;药效学研究
皮肤组织作为保护器官免受感染和环境变化的屏障,具有至关重要的作用,但皮肤因各种物理、化学和微生物因子等因素引发的急、慢性创面常难以愈合[1],甚至伴有大量腐肉、脓液和恶臭等,严重影响患者的生活质量。因此,对创面愈合过程进行干预,以加速创面愈合是皮肤创面治疗的首要目标。目前,皮肤创伤修复药物治疗因其便携性等广受研究者关注。但大部分皮肤创面用药,主要包括抗菌剂、干细胞疗法、生长因子等[2],常存在生物安全性低、易产生耐药性、成本较高、稳定性较差等不足[3]。
血人参为豆科木蓝属植物茸毛木蓝Lindl.的干燥根,是苗族民间常用药[4-5],应用历史悠久,其乙醇提取物(ethanol extract,IS-EE)被证明具有抑制斑马鱼炎症模型中巨噬细胞向急性创伤部位募集的作用[6]。因此,本研究拟制备一种载有苗药血人参乙醇提取物PVA/ Lig/CS水凝胶(IS-EE PVA/Lig/CS hydrogel,IS-EE-H)作为创面敷料,该水凝胶是由木质素(lignin,Lig)、壳聚糖(chitosan,CS)和聚乙烯醇(polyvinyl alcohol,PVA)组成的混合材料,旨在以木质素改善水凝胶的机械强度,以壳聚糖提高创面的抗菌性能及以聚乙烯醇维持创面周围的润湿环境,并利用混合水凝胶三维网络结构作为IS-EE的药物储库,使药物从水凝胶中持续释放,防止巨噬细胞向炎症部位的过度迁移、聚集,加快皮肤创面愈合,以期为皮肤创面愈合提供新型敷料,并为皮肤创面愈合药物的开发提供理论基础。
1 仪器与材料
1.1 主要仪器
LC-2030C 3D型高效液相色谱仪、AUW120D型十万分之一电子分析天平,日本岛津制作所;Thermo Fisher Nicolet Is10-透射/ATR红外、Thermo 3111型CO2细胞培养箱、MULTISKAN SKY 153型全自动酶标仪,赛默飞世尔科技(中国)有限公司;CKX53型倒置相差显微镜,上海蛮吉光电科技有限公司;YXQ-LS-100SLL型高压灭菌锅,上海博讯医疗生物仪器股份有限公司;PHY-III型病理组织漂烘仪,常州市中威电子仪器有限公司;RS36型全自动染色机,常州派斯杰医疗设备有限公司;Inspect型扫描电子显微镜(SEM),美国FEI公司。
1.2 主要材料
血人参药材,批号20210322,贵阳德昌祥药业有限公司,经贵州中医药大学张永萍教授鉴定为豆科木蓝属植物茸毛木蓝Lindl.的干燥根;对照品儿茶素,质量分数98.0%,批号170209,成都植标化纯生物技术有限公司;对照品表儿茶素,质量分数99.7%,批号110878-201703,中国食品药品检定研究院;CCK-8(Cell Counting Kit-8细胞计数试剂)试剂盒,批号K1018,APExBIO Technology LLC;壳聚糖(批号RH300965)、木质素(批号RH238608),上海易恩化学技术有限公司;聚乙烯醇-124(PVA-124),批号181207,西陇科学股份有限公司;巨噬细胞(RAW264.7),中国典型培养物保藏中心;DMEM培养基,批号2318854,Gibco公司;脂多糖(lipopolysaccharide,LPS),批号820F036,Solarbio公司;重组牛碱性成纤维细胞生长因子,批号6920699338625,珠海亿胜生物制药有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α,批号20220120)、白细胞介素-6(interleukin-6,IL-6,批号20220120),南京建成生物工程研究所;卡那霉素(批号820Y0411)、二甲基亚砜(DMSO,批号710N0315),Solarbio公司。
1.3 实验动物
雄性Sprague-Dawley(SD)大鼠,体质量180~220 g,购自长沙天勤生物技术有限公司,合格证:SCXK(湘)2019-0015。动物实验符合动物实验伦理学要求,经贵州中医药大学动物伦理委员会审查后批准,编号20210174。
2 方法与结果
2.1 IS-EE的制备
称取血人参药材300 g,剪断或切碎,加6倍量60%乙醇回流提取2 h,滤过,滤渣加4倍量60%乙醇回流提取1.5 h,滤过。合并2次滤液,减压回收乙醇并浓缩至一定浓度,真空干燥至含水量<5%,得IS-EE浸膏粉54 g[6]。
2.2 IS-EE体外分析方法的建立
2.2.1 色谱条件 色谱柱为ComatexTMC18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.2%磷酸水溶液,梯度洗脱:0~40 min,8%~14%乙腈;体积流量为1.0 mL/min;检测波长为280 nm;柱温为30 ℃;进样10 μL。
2.2.2 混合对照品溶液的制备 精密称取儿茶素16.35 mg、表儿茶素14.24 mg分别置于10 mL量瓶中,加甲醇使其完全溶解并稀释至10 mL,作为儿茶素和表儿茶素的储备液。精密移取2 mL儿茶素储备液和5 mL表儿茶素储备液置于100 mL量瓶中并用甲醇稀释至100 mL,得到含儿茶素32.70 μg/mL和表儿茶素71.20 μg/mL的混合对照品储备液,4 ℃保存。
2.2.3 供试品溶液的制备 精密称取IS-EE浸膏粉50.0 mg于10 mL量瓶中加入甲醇超声使其完全溶解,稀释至10 mL。
2.2.4 专属性考察 取混合对照品溶液及IS-EE供试品溶液,按“2.2.1”项下色谱条件进行分析,色谱图见图1。在该色谱条件下,IS-EE供试品溶液和对照品溶液中儿茶素和表儿茶素的色谱峰具有相同的保留时间,且能实现完全分离。

图1 空白甲醇(a)、混合对照品(b)、IS-EE样品(c) 的HPLC图
2.2.5 线性关系考察 精密吸取0.625、1.25、2.5、5.0、10.0 mL“2.2.2”项下的混合对照品储备液,分别置于10 mL量瓶中,加甲醇稀释,得到儿茶素系列质量浓度和表儿茶素系列质量浓度的混合对照品溶液,按“2.2.1”项下色谱条件进样分析,测定其峰面积。以对照品质量浓度为横坐标(),待测成分峰面积为纵坐标()进行线性回归,得儿茶素的线性回归方程为=6 659.00-404.29,2=0.999 9,线性范围为2.04~32.74 μg/mL;表儿茶素的线性回归方程为=7 148.20-659.54,2=1.000 0,线性范围为4.50~71.20 μg/mL。由此可知,IS-EE中2种成分在线性范围内线性关系良好。
2.2.6 精密度考察 精密吸取2.5 mL混合对照品储备液,用甲醇定容至10 mL,并按“2.2.1”项下色谱条件进行分析,重复6次,以随行线性回归方程计算其中儿茶素和表儿茶素的实测质量浓度,并计算其RSD值,结果其RSD分别为0.69%和1.07%,可知儿茶素和表儿茶素RSD值均符合要求,仪器精密度良好。
2.2.7 重复性考察 取同一批IS-EE样品50.0 mg,精密称定,平行6份,按“2.2.3”项下方法处理样品制备供试品溶液,并按“2.2.1”项下色谱条件进行分析,以随行线性回归方程计算其中儿茶素和表儿茶素的实测含量,并计算其RSD值,结果其RSD分别为2.11%和1.11%,可知其RSD值均符合要求,表明该方法重复性良好。
2.2.8 稳定性考察 取同一批IS-EE样品50.0 mg,精密称定,按“2.2.3”项下方法制备供试品溶液,并按“2.2.1”项下色谱条件在制备后0、2、4、6、8、10、12 h时分别进样分析,以随行线性回归方程计算其中儿茶素和表儿茶素的实测含量,并计算其RSD值,结果其RSD分别为2.12%和2.37%,可知其RSD值均符合要求,表明供试品溶液在12 h内稳定性良好。
2.2.9 加样回收率考察 称取已测定指标成分含量的IS-EE样品约25.0 mg,精密称定,平行6份,按照所得2种成分含量分别加入其1.0倍量的对照品,按“2.2.3”项下方法处理样品制备供试品溶液,并按“2.2.1”项下色谱条件进行分析,以随行线性回归方程计算其中儿茶素和表儿茶素的实测含量,并计算2个指标成分的加样回收率及其RSD值,结果儿茶素和表儿茶素的平均加样回收率分别为103.87%和100.53%,RSD分别为2.86%和2.8.6%。
2.3 IS-EE-H的制备
称取IS-EE浸膏粉0.5 g,精密称定,以60%乙醇溶液7 mL溶解,加入PVA溶液(取8 g PVA加32 g超纯水,90 ℃搅拌溶解)搅拌后与Lig溶液(取1 g Lig加9 g超纯水,常温搅拌溶解)混合,搅拌均匀后加入CS溶液(取CS 4 g加71 g 2%乙酸溶液,90 ℃搅拌溶解),得到的混合溶液进行离心(2 000 r/min、3 min)脱气处理,采用冻融法(冷冻-解冻)在−20 ℃下物理交联得IS-EE-H。
2.4 单因素考察IS-EE-H的处方工艺
本实验采用冻融法制备PVA水凝胶,其机制主要为在冷冻状态下,随着冻融循环增加,水冻结、膨胀,推动PVA链与其他高分子材料链紧密接触,形成高分子无规则状的高密度区,促进氢键和晶体的形成[7]。为了考察冻融循环次数、冻结时间、不同基质比、木质素含量对水凝胶的影响,本研究选取的冻融循环次数分别为2、4、6次,冻结时间分别为6、12、24 h,PVA/Lig/CS比例(质量比)分别为8∶1∶2、7∶1∶3、6∶1∶4;Lig含量分别为0.5、1.0、1.5 g。除筛选因素改变外,将其他因素固定,即冻融循环次数和冻结时间分别为4次和6 h,PVA/Lig/CS比例为7∶1∶3,Lig含量为1.0 g。按照“2.3”项下方法制备水凝胶,评价各因素对水凝胶药物释放性能的影响。
2.4.1 冻融循环次数 不同冻融循环次数的水凝胶均在12 h后到达溶胀平衡状态,经过4次循环后,水凝胶的溶胀率达到最佳,溶胀率为374.8%,当冻融循环增加至6次时水凝胶溶胀率几乎不变,说明水凝胶冻融至4次时,其交联程度可能已达到最大,此外冻融2次水凝胶中儿茶素和表儿茶素的累积释放率最大,其次是冻融6次和冻融4次。
2.4.2 冻结时间 不同冻结时间的水凝胶均在12 h后达到溶胀平衡,其中冻结6 h的溶胀率(401.4%)最佳,较冻结12 h和24 h的平衡溶胀率(350.0%)高,同时冻结6 h和24 h时水凝胶中的儿茶素和表儿茶素的累积释放率较12 h高,可达80%以上。研究表明,水凝胶溶胀率是衡量其吸收伤口渗出液能力的关键因素之一[8-9],因此,本研究后续采用冻结6 h进行水凝胶的制备。
2.4.3 基质比 PVA/Lig/CS质量比(6∶1∶4)水凝胶溶胀率最大,可达至284.0%,其次是PVA/Lig/ CS质量比(7∶1∶3)水凝胶(265.6%)和PVA/Lig/ CS质量比(8∶1∶2)水凝胶(238.2%)。该结果表明,水凝胶处方中PVA和CS比值越小,水凝胶的溶胀度可能越大,其中CS对水凝胶的溶胀度可能起主导作用。水凝胶处方中PVA和CS比值越小,水凝胶的保湿性越小。PVA/Lig/CS质量比(6∶1∶4)水凝胶中儿茶素和表儿茶素的累积释放率最大,分别为101.4%和85.4%,其次是PVA/Lig/CS质量比(8∶1∶2)水凝胶和PVA/Lig/CS质量比(7∶1∶3)水凝胶,2者的儿茶素累积释放率分别为93.9%、77.7%,表儿茶素的累积释放率分别为84.5%、64.8%。
2.4.4 木质素含量 在木质素含量分别为0.5、1.0、1.5 g的水凝胶处方中,PVA/Lig/CS质量比(7∶0.5∶3)水凝胶的溶胀率和保湿率最高,该结果表明木质素在水凝胶处方中的比例越小,水凝胶的溶胀率和保湿率可能越大。PVA/Lig/CS质量比(7∶1.5∶3)水凝胶儿茶素和表儿茶素的累积释放率最大,其次是PVA/Lig/CS质量比(7∶1.0∶3)水凝胶和PVA/ Lig/CS质量比(7∶0.5∶3)水凝胶,该结果表明,水凝胶中木质素含量越大水凝胶的药物释放率可能越大。
2.5 正交试验优化处方工艺
为了进一步筛选IS-EE-H的制备工艺和制备处方,本实验采用了正交试验设计法对其制备工艺和制备处方进行优化。单因素考察实验结果显示,PVA用量(A)、CS用量(B)、Lig用量(C)、冻融循环次数(D)均对水凝胶的溶胀率、药物累积释放率影响较大,对保湿度的影响相对较小,因此,正交试验以水凝胶中儿茶素和表儿茶素的累积释放率和溶胀率的综合评分[综合评分=(儿茶素累积释放率/儿茶素累积释放率最大值)×0.35×100+(表儿茶素累积释放率/儿茶素累积释放率最大值)×0.35×100+(平衡溶胀度/平衡溶胀度最大值)×0.3×100]作为评价指标,按L9(34)因素水平表(表1)进行正交试验。由实验结果(表1、2)综合分析确定IS-EE-H的制备工艺和制备处方为A2B3C1D2,即PVA用量7.0 g、CS用量4.0 g、Lig用量0.5 g和冻融循环次数4次。
2.6 IS-EE-H的表征
2.6.1 傅里叶红外光谱分析 将PVA水凝胶、PVA/ Lig水凝胶、PVA/Lig/CS水凝胶和IS-EE-H冷冻干燥,干燥后的水凝胶分别使用傅里叶红外光谱分析仪分析其红外光谱(FTIR),分辨率为4 cm−1,扫描次数为16次,光谱范围为4 000~500 cm−1。其结果如图2所示。1 600~1 400 cm−1是木质素典型的芳香族骨架振动[10],PVA/Lig水凝胶、PVA/Lig/CS水凝胶及IS-EE-H在1 419 cm−1和1 569 cm−1处表现出特征峰,且1 569 cm−1的峰强增加,表明木质素与PVA可能交联成功。3 280 cm−1的强吸收峰是由于-OH拉伸振动[11],PVA存在大量亲水基团羟基,故PVA水凝胶、PVA/Lig水凝胶、PVA/Lig/CS水凝胶及IS-EE-H在3 280 cm−1均出现强吸收。研究表明,氢键形成时会使峰强增加同时将波段向低波数方向移动[12]。IS-EE-H在3 257 cm−1左右峰强增加,猜想IS-EE可能以氢键的形式包载于PVA/Lig/CS水凝胶中。
2.6.2 形态学表征 将PVA/Lig/CS水凝胶和IS- EE-H用相机记录其形态,同时进行冷冻干燥,干燥后样品折断,暴露横截面,喷金干燥后用SEM观察其微观形态。其结果如图3-A和3-B所示,该凝胶成型性好且具有良好的弹性。在SEM下,PVA/ Lig/CS水凝胶呈三维多孔网状结构(图3-A),该结果可能归因于木质素具有由多种活性基团(羟基、羧基和磺酸基团等)构成的特殊化学结构和空间构象,同时这些基团与PVA的羟基形成氢键,与壳聚糖的氨基形成离子键[13]。将PVA/Lig/CS水凝胶作为药物储库对血人参提取物进行装载后,形成的IS-EE-H仍保持一定数量的网状结构,该结构使水分子容易渗透,是具有良好的溶胀性能的保障[14],为其作为伤口敷料对伤口组织液、细胞代谢物等具有良好吸收效果提供理论依据。
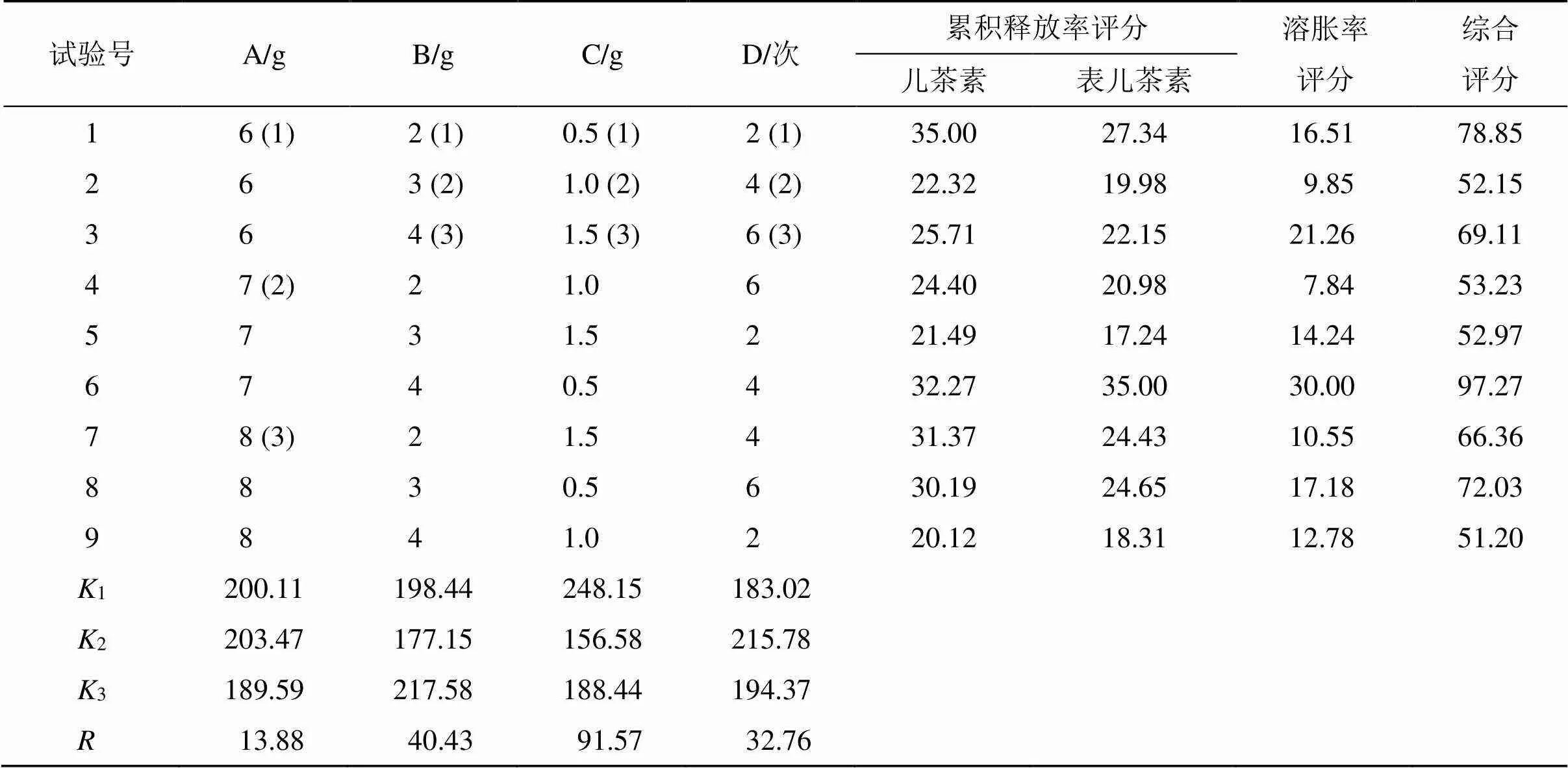
表1 正交试验设计与结果

表2 方差分析
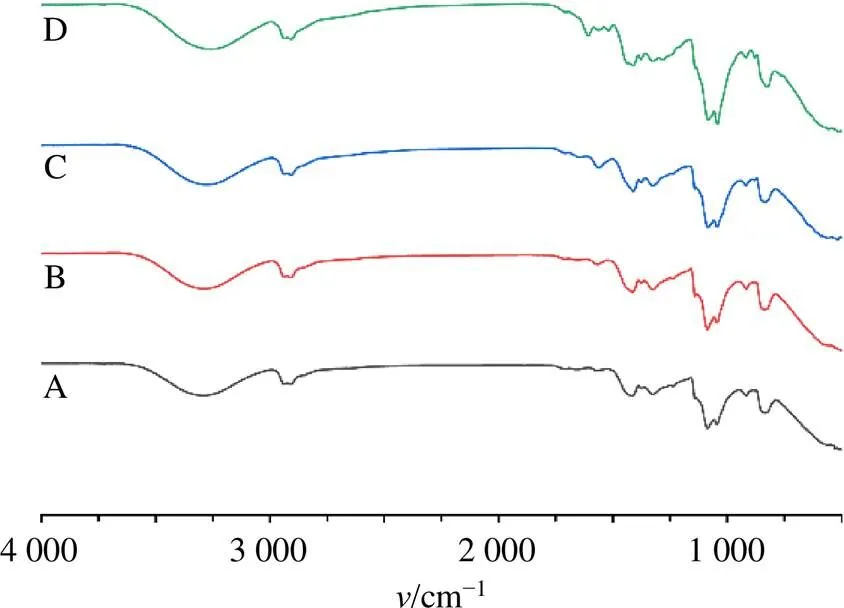
图2 PVA水凝胶(A)、PVA/Lig水凝胶(B)、PVA/Lig/CS水凝胶(C) 和IS-EE-H(D) 的FTIR图

图3 PVA/Lig/CS水凝胶(A) 和IS-EE-H (B) 的宏观形态和微观形态表征
2.6.3 溶胀性能 将水凝胶试样真空干燥(48 h),称定质量(质量记为0),加入50 mL超纯水使其在常温下充分膨胀,在时刻取出试样,滤纸擦干表面水分,称定质量(质量记为M),计算水凝胶的溶胀率。其溶胀率结果(图4)显示,PVA/Lig/CS水凝胶的平衡溶胀度为(436.820±9.623)%,IS- EE-H的平衡溶胀度为(168.32±2.53)%,IS-EE-H溶胀度下降的原因可能是IS-EE以氢键形式包载于PVA/Lig/CS水凝胶中,使水凝胶的交联度增加,导致水凝胶水渗透率下降。
2.6.4 保湿性能 理想的创面敷料应具有优良的保湿性能,敷料提供的润湿环境为表皮细胞的再生和趋化提供有利条件,保持细胞因子活性,促进创面快速愈合[15]。将水凝胶试样真空干燥(48 h),称定质量(质量记为0),加超纯水(50 mL)使其在常温下膨胀,充分溶胀后称定质量(质量记为e)。将充分溶胀后的水凝胶置于恒温箱(37 ℃)中,在时刻取出试样,称定质量(质量记为M),计算保湿度。PVA/Lig/CS水凝胶及IS-EE-H的保湿性结果(图4)显示,同一时间点PVA/Lig/CS水凝胶的保湿率较IS-EE-H高,IS-EE-H在短时间内具有一定的保湿性能。
2.6.5 释放性能 药物释药性能是考察水凝胶作为缓控释制剂应用的一项重要指标。将水凝胶试样置于PBS溶液(pH 5,20 mL)中,恒温振荡(37 ℃),分别在1、2、3、4、5、7、12、24、36、48 h取出释放介质(10 mL),同时补充同等体积的空白释放介质,将取出的释放介质置于蒸发皿中干燥,待其完全蒸发后,加入甲醇溶液溶解残留物质并定容至5 mL,0.22 µm有机膜滤过,取10 µL进样分析,计算水凝胶试样的累积释放率。IS-EE-H的累积释放率试验结果(图5)显示,IS-EE-H中IS-EE的指标成分儿茶素和表儿茶素均在8 h后接近恒速释放,此时二者的累积释放率分别为90.9%、60.8%。采用Origin2019b软件将儿茶素和表儿茶素的累积释放数据与零级方程、一级方程和Higuchi平方根方程进行拟合[16]。结果显示(表3),IS-EE-H中IS-EE指标成分儿茶素和表儿茶素的释放规律均符合一级动力学,该结果说明PVA/Lig/CS水凝胶作为IS-EE的药物储库可以对其具有缓释作用。

图4 PVA/Lig/CS水凝胶和IS-EE-H的溶胀率(A) 和保湿率(B) 结果(, n = 3)
2.6.6 流变学性能 将水凝胶置于平行板(直径20.0 mm)上,以1.0 mm的固定间隙值进行频率扫描分析。固定应变为1%,在0.01~10 Hz的频率范围,进行扫频测试,实验过程中温度保持为25 ℃。测定的PVA/CS水凝胶、PVA/Lig/CS水凝胶、IS-EE-H的流变性能结果如图6,其中储能模量(′)表示水凝胶的弹性,损耗模量(″)表示黏度。结果显示,3种类型的水凝胶均呈现出弹性行为和黏性行为,因储能模量值较损耗模量值高,判断3种类型水凝胶以弹性行为为主。同时,在PVA/CS水凝胶中添加Lig后,水凝胶的储能模量和损耗模量均降低,且储能模量值显著降低,该结果表明Lig在水凝胶中可能具有增加水凝胶黏度的作用。当PVA/ Lig/CS水凝胶携载IS-EE后,IS-EE-H的储能模量显著增加,产生该现象的原因可能是:IS-EE-H制备过程中,药物与PVA混合后加入Lig混匀时,由于IS-EE的溶剂为60%乙醇,该乙醇可能充当一定润湿剂的作用,使PVA、Lig和CS混合更加均匀,导致最终形成的凝胶弹性更好。

图5 IS-EE-H中2种指标成分的累积释放曲线(, n = 3)

表3 IS-EE-H中2种指标成分释放数据的拟合情况

图6 各水凝胶的流变学结果(, n = 3)
2.6.7 力学性能 为了进一步探究Lig在水凝胶中的作用,将PVA/CS水凝胶、PVA/Lig/CS水凝胶和IS-EE-H进行拉伸试验,将水凝胶切成条状(4.5 mm×1.5 mm×10 mm),采用万能试验机以50.0 mm/min的拉伸速率进行拉伸测试,记录拉伸过程中水凝胶应变值和应力值。试验结果(图7)显示,PVA/CS水凝胶断裂时的应变(断裂拉伸率)和抗拉强度分别为86.3%和8.0 kPa,PVA/CS水凝胶在变形过程中表现出明显的应变硬化现象,产生该现象的原因可能是在PVA/CS结晶区内PVA/CS聚合物链表现出有限的延展性[13]。当水凝胶中引入Lig后,Lig可能增加了水凝胶的三维空间结构,使其在拉伸过程中自行变形吸引拉力,导致PVA/Lig/CS水凝胶断裂时的应变和抗拉强度分别为308.3%和63.0 kPa。当PVA/Lig/CS水凝胶包载IS-EE后,IS-EE-H的断裂伸长率反而降低至229.1%,抗拉强度升至90.0 kPa,产生该结果的原因可能是IS-EE以氢键形式包载于PVA/Lig/CS水凝胶中,使水凝胶具有较高的晶体密度,增加了IS-EE-H网络的刚性,降低了网络的柔韧[17]。

图7 水凝胶力学性能实验结果
2.7 IS-EE-H体外生物评价
2.7.1 细胞相容性试验 将培养好的细胞(RAW 264.7)接种于96孔板中,1.5×104细胞/孔,分为空白组、DMSO组、IS-EE组、PVA/Lig/CS水凝胶组(PLC-H)和IS-EE-H组,重复3个复孔,培养(5% CO2、37 ℃)过夜。各组分别加入无血清DMEM配制的PBS、DMSO、IS-EE(儿茶素质量浓度分别为25.0、50.0、100.0、200.0 μg/mL,表儿茶素质量浓度分别为43.6、87.2、174.4、347.8 μg/mL)、PLC-H浸提液、IS-EE-H浸提液(儿茶素质量浓度分别为25.0、50.0、100.0、200.0 μg/mL,表儿茶素质量浓度分别为43.6、87.2、174.4、347.8 μg/mL),培养(5% CO2、37 ℃)24 h,吸去细胞上清液,每孔加入100 μL无血清DMEM和10 μL CCK-8溶液,轻轻混匀后孵育(5% CO2、37 ℃)2 h,通过酶标仪测定其在450 nm处的吸光度,计算细胞存活率[细胞存活率=(实验孔吸光度-空白孔吸光度)/(对照孔吸光度-空白孔吸光度)]。结果(表4)显示,IS-EE的细胞存活率与质量浓度呈负相关,且与相对应浓度的DMSO对细胞存活率无明显影响,该结果表明较高质量浓度的IS-EE可能对RAW264.7细胞具有抑制作用。将PLC-H携载IS-EE后,在低质量浓度时,IS-EE-H的细胞存活率与其质量浓度呈正相关,细胞存活率均高于76.0%。在高质量浓度时,IS-EE-H的细胞存活率降低至73.5%,该结果与PLC-H实验结果一致,说明低水平的PLC-H对细胞(RAW264.7)可能具有良好的增殖作用,高水平的PLC-H对RAW264.7细胞可能具有轻微的抑制作用。
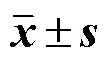
表4 IS-EE-H的细胞生物相容性试验结果(, n = 3)
2.7.2 细胞划痕试验 试验前用记号笔在24孔板背后画横线。将培养好的细胞(RAW264.7)接种于24孔板中,1.0×105细胞/孔,分为空白组、IS-EE组、PLC-H组和IS-EE-H组,每组3个复孔,培养(5% CO2、37 ℃)过夜。弃去细胞上清,各组分别加入1 mL无血清DMEM配制的PBS,IS-EE(儿茶素50.0 μg/mL,表儿茶素87.2 μg/mL),PLC-H浸提液,IS-EE-H浸提液(儿茶素50.0 μg/mL,表儿茶素87.2 μg/mL),孵育2 h。采用枪头(200 μL)在各组细胞正上方垂直孔板预处理的黑线划痕,划线完成后,使用无菌PBS清洗细胞2次,去除划下的细胞,给予LPS(100.0 ng/mL)刺激,将细胞放入细胞培养箱中培养(5% CO2、37 ℃)。分别在不同时间点(8、12、24 h)取出,显微镜拍照记录细胞的愈合情况,以Image J分析各实验组的划痕面积,计算伤口愈合率,伤口愈合率越小,说明RAW 264.7迁移率小。结果(表5)表明IS-EE可以抑制RAW264.7细胞迁移,且随时间点增加抑制效果越明显。将PLC-H对IS-EE进行包载后,IS-EE-H对RAW264.7细胞的抑制迁移现象更显著。巨噬细胞是创面愈合炎症期的主要炎症细胞,因此,IS- EE-H可能对创面愈合炎症期治疗具有重要作用。
2.7.3 对炎症因子的影响 将培养好的细胞(RAW 264.7)接种于24孔板中,1.0×105细胞/孔,分为空白组、IS-EE组、PVA/Lig/CS水凝胶组(PLC-H)和IS-EE-H组,每组3个复孔,培养(5% CO2、37℃)过夜。弃去细胞上清液,各组分别加入1.5 mL无血清DMEM配制的PBS,IS-EE(儿茶素50.0 μg/mL,表儿茶素87.2 μg/mL),PLC-H浸提液,IS-EE-H浸提液(儿茶素50.0 μg/mL,表儿茶素87.2 μg/mL),孵育2 h。吸出细胞上清,用PBS清洗细胞2次,给予LPS(100.0 ng/mL)刺激18 h,吸出细胞上清,按照ELISA试剂盒检测其中IL-6和TNF-α的含量。试验结果如表6所示,与空白组相比,IS-EE、PLC-H和IS-EE-H能显著降低LPS诱导巨噬细胞TNF-α的产生。与空白组相比,IS-EE和IS-EE-H对LPS诱导巨噬细胞IL-6的产生表现出抑制作用,但该作用无统计学意义。该结果表明,IS-EE、PLC-H和IS-EE-H可能具有抑制炎症反应发生的作用。
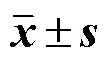
表5 不同时间点IS-EE-H的细胞划痕愈合率(, n = 3)
同一时间点与空白组比较:**<0.01***<0.001;与8 h空白组比较:##<0.01###<0.001;与8 h IS-EE组比较:Δ<0.05;与8 h PLC-H组比较:&<0.05。
**< 0.01***< 0.001blank group at the same time point;##< 0.01###< 0.0018 h blank group;Δ< 0.058 h IS-EE group;&< 0.058 h PLC-H group.
2.7.4 抑菌试验 采用大肠杆菌和金黄色葡萄球菌通过CFUs试验评价水凝胶的抑菌活性。用无菌PBS将细菌浓度调整为1.0×108cfu/mL,将PVA/Lig水凝胶浸提液、PVA/CS水凝胶浸提液、PLC-H浸提液、IS-EE(50.0 μg/mL)、IS-EE-H浸提液(IS-EE 50.0 μg/mL)和卡那霉素(kanamycin,50.0 μg/mL)分别与上述细菌悬液孵育(37 ℃)8 h,各混悬液逐步稀释至 1×10−5浓度,后将其(30 μL)接种于LB培养皿中。在37 ℃下孵育过夜后,拍照记录菌落数并计数。每组重复3次试验。计算抑菌率[抑菌率=(CFU空白组-CFU样本组)/CFU空白组]。由试验结果(表7)可知,在水凝胶中增加CS可以增强水凝胶的抗菌效果,且PVA/CS水凝胶、PLC-H、IS-EE-H、卡那霉素(50.0 μg/mL)对大肠杆菌的抑菌率有良好的抑菌效果,均大于99.0%。
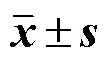
表6 IS-EE-H的对细胞炎症因子的影响结果(, n = 3)
与空白组比较:*<0.05**<0.01。
*< 0.05**< 0.01blank group.
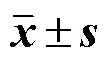
表7 IS-EE及其有无壳聚糖水凝胶的抑菌结果(, n = 3)
与PVA/Lig组比较:*<0.05。
*< 0.05PVA/Lig group.
2.8 IS-EE-H体内药效评价
2.8.1 全层皮肤损伤模型的建立 采用正常雄性SD大鼠(180~220 g)构建全层皮肤损伤模型。将SD大鼠80只随机分为5组,每组16只,即模型组、阳性对照组(重组牛碱性成纤维细胞生长因子)、IS-EE组、空白凝胶(blank gel,B-G)组、IS-EE-H组。其中IS-EE给药量为0.315 g/kg(生药量),IS-EE质量浓度0.26 g/mL。造模前将大鼠麻醉并对其背部脱毛,脱毛后用95%医用酒精消毒,随后在每只大鼠的背部创建全层皮肤伤口(1.5 cm×1.5 cm)。造模后第1天开始给药,隔1天给药1次,共6次。其中模型组给予300 μL PBS,阳性对照组给予重组牛碱性成纤维细胞生长因子,其余各组分别给予相应药物。
2.8.2 创面愈合率 采用Image J软件分析3、7、14 d时各组动物创面的伤口面积,并以第1天伤口面积作为伤口初始面积,计算创面愈合率。由表8可知,与模型组相比,第3、7天时IS-EE-H和阳性药组伤口面积明显减小,以第3天尤为显著,且两者的创面愈合率分别是模型组的4.3倍和3.5倍,结果表明IS-EE-H具有良好的促创面愈合的作用,产生该作用可能与前面证实IS-EE-H具有良好的生物相容性、抗菌性、抑制炎症细胞向创口过度聚集有关及抑制TNF-α生成有关。
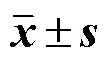
表8 第3、7、14天各实验组的创面愈合率(, n = 5)
与模型组比较:*<0.05***<0.001。
*< 0.05***< 0.001model group.
2.8.3 再生组织HE染色分析 经药物干预后,对第3、7、14天的创面再生组织进行HE染色分析,实验结果如图8所示,经治疗14 d后,与模型组相比,IS-EE-H和阳性药物组的皮肤组织修复程度相对最好,主要表现在炎性细胞浸润减少,毛血细管形成增加,纤维组织形成明显等。IS-EE的皮肤组织修复程度较IS-EE-H和阳性药物组差,B-G的皮肤组织修复程度相对次之。同时随着治疗时间增加,各组的皮肤创面组织修复效果越明显。该结果表明,与B-G相比,IS-EE及IS-EE-H具有良好的创面修复作用。
2.8.4 再生组织CD86(B淋巴细胞活化抗原B7-2)和CD163(M130抗原)的表达 选择表面生物标志物CD86和CD163,分别标记M1和M2巨噬细胞[18-19],观察IS-EE-H对创面愈合期间巨噬细胞极化的影响。如图9所示,与模型组相比,各试验组CD86的表达在第3、7天时明显减少,其中第3天时模型组CD86的表达量分是IS-EE组、B-G和IS-EE-H的2.4、1.6、2.2倍,第7天时模型组CD86的表达量分是IS-EE组、B-G和IS-EE-H的4、2、1.5倍(表9)。与模型组相比,各试验组第3天时CD163的表达无统计学意义,在第7天时,IS-EE-H组CD163的表达量是模型组2.1倍(表9)。该结果表明,在创面愈合前期,IS-EE、B-G和IS-EE-H均具有抑制M1型巨噬细胞向创面过度募集的作用。同时将B-G作为IS-EE缓释药物储库制备的IS-EE-H可能还具有促进促炎性巨噬细胞(M1型)向抗炎性巨噬细胞(M2型)极化的作用。
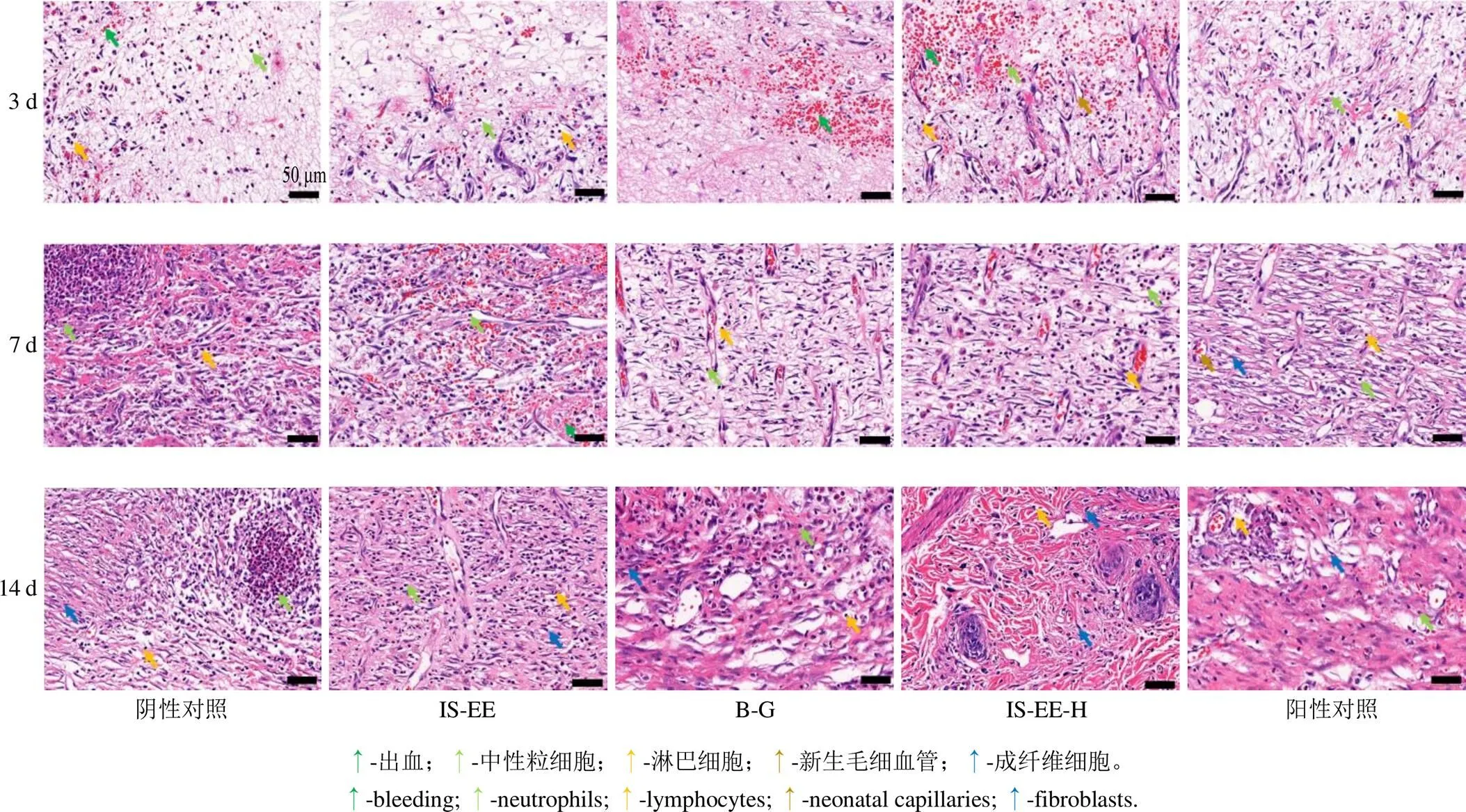
图8 第3、7、14天时再生组织的H&E染色图像(比例尺50 μm)

图9 第3、7天时再生组织中CD86和CD163的免疫组化染色照片(比例尺40 µm)

表9 第3、7天各实验组皮肤再生组织CD86和CD163的阳性面积占比(, n = 3)
与模型组比较:*<0.05**<0.01。
*< 0.05**< 0.01model group.
2.8.5 再生组织CD31的表达 CD31是一种在早期血管生成中表达的跨膜蛋白[20],本研究采用CD31免疫组化染色法评价创面的血管生成情况。如图10-A所示,与模型组相比,IS-EE组和IS-EE-H组的CD31表达明显,尤其是IS-EE-H组,其在第7、14天时CD31表达分别是模型组的2.5、3.2倍(表10),说明IS-EE组和IS-EE-H组的创面形成了更多成熟结构的毛细血管。该结果表明IS-EE和IS- EE-H可能通过增加创面再生组织中的血管生成促进创面修复。在伤口处理第14天时,B-G组CD31表达量也较模型组显著,该结果表明,B-G具有一定的促创面愈合作用,该作用可能与其具有良好的保湿性能、生物相容性和抗菌性能有关。
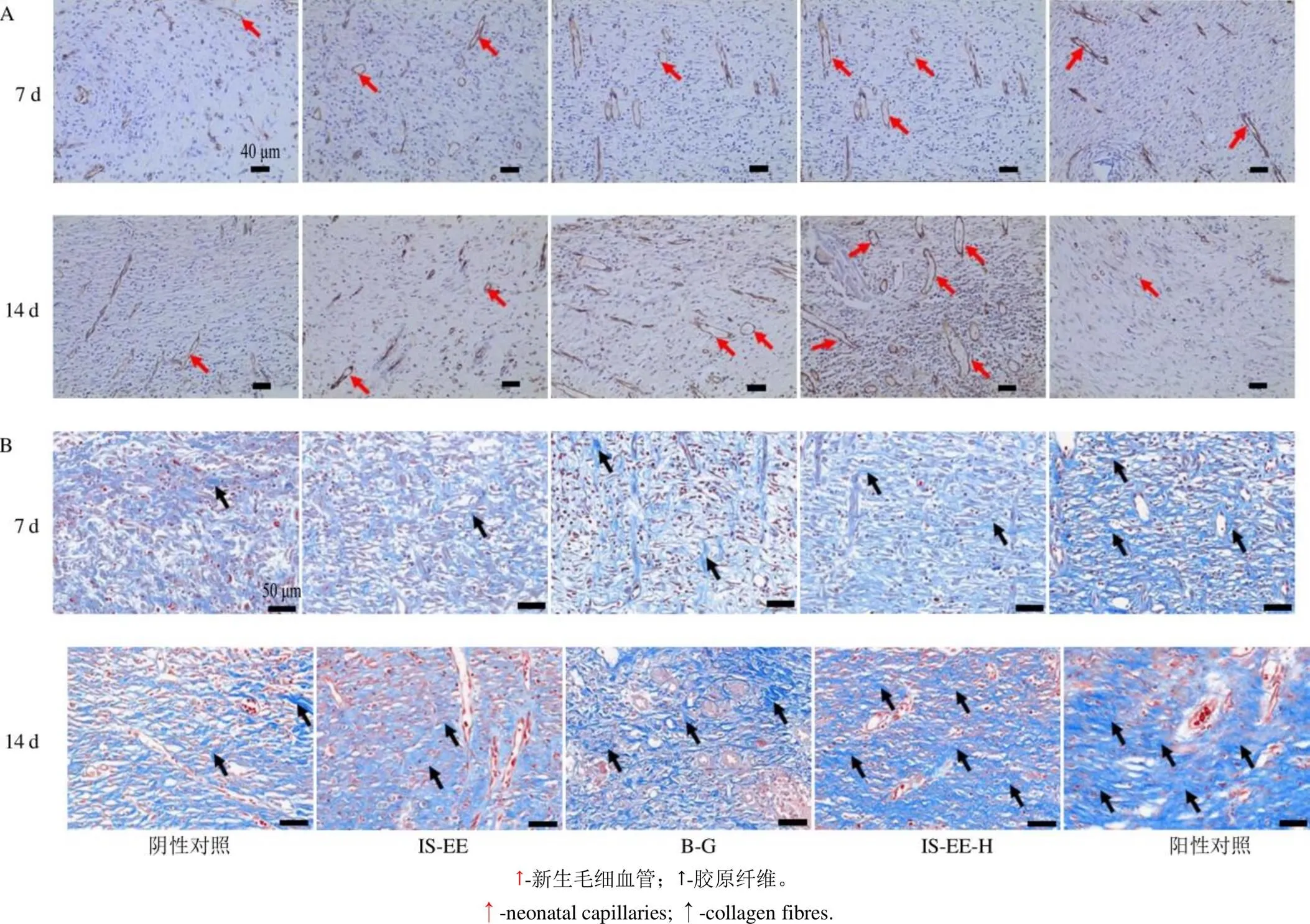
图10 第7、14天时再生组织中CD31免疫组化(比例尺40 µm, A) 和Masson染色图片(比例尺50 µm, B)
2.8.6 再生组织胶原纤维沉淀情况 伤口部位胶原蛋白的形成,在伤口愈合重塑期修复受损皮肤组织和增强组织的抗拉强度方面发挥着重要作用[21],本研究采用Masson三色染色法评价伤口愈合过程中胶原纤维沉积的情况。如图10-B所示,在第7、14天,各组实验组均出现了胶原纤维沉积(蓝色区域)。与模型组相比,IS-EE组、IS-EE-H和阳性药组胶原纤维沉积的现象更密集和显著,以伤口处理后的第14天尤甚,通过定量分析纤维组织表达面积百分比(表11)知,IS-EE组、IS-EE-H胶原纤维组织表达面积百分比是模型组的2.0倍,阳性药组胶原纤维组织表达面积百分比是模型组的2.4倍。该结果表明IS-EE和IS-EE-H对改善创面愈后质量具有良好作用,该作用可能与前述在创面愈合炎症期抑制促炎型巨噬细胞向创面过度聚集有关。

表10 第7、14天各实验组皮肤再生组织CD31的阳性面积占比(, n = 3)
与模型组比较:*<0.05**<0.01。
*< 0.05**< 0.01model group.
3 讨论
本研究在单因素考察的基础上正交试验设计筛选出最优的PLC-H,即PVA、CS和Lig的质量比为7∶4∶0.5,最优制备工艺为冻融循环次数4次,每次冻结6 h。将PLC-H携载IS-EE后,IS-EE-H的多孔网状结构及良好溶胀性能,更有利于伤口组织液和渗出物的吸收以及使药物发挥缓释作用。同时PLC-H合适的机械强度,更是为其作为创面敷料提供依据。

表11 第7、14天各实验组再生皮肤纤维组织表达面积百分比(, n = 3)
与模型组比较:*<0.05**<0.01***<0.001。
*< 0.05**< 0.01***< 0.01model group.
体外生物评价结果显示,IS-EE(儿茶素20.0~200.0 μg/mL)的细胞(RAW264.7)存活率与IS-EE浓度呈负相关,将PLC-H对IS-EE进行包载后,IS-EE-H对炎症细胞(RAW264.7)的抑制迁移现象更显著,同时IS-EE和IS-EE-H对大肠杆菌和金黄色葡萄球菌有良好的抑菌效果。体内药效结果显示,IS-EE-H具有良好的促创面愈合的作用,该作用可能是与其在创面愈合前期减少炎症细胞浸润、抑制巨噬细胞向创面过度趋化、促进M1型巨噬细胞向M2型巨噬细胞极化,同时在创面愈合中后期促进血管生成、增加纤维组织形成等相关。
综上所述,血人参因其优良的抗炎性能是目前创面愈合治疗具有潜力的候选药物,同时携载IS-EE的PVA/Lig/CS水凝胶可调控创面愈合炎症期巨噬细胞的迁移和极化,增殖期血管的生成及重塑期胶原纤维的表达,以改善创面愈后质量,但其具体调控机制及再生组织附属器(毛囊、汗腺、皮脂腺等)的生成情况等有待进一步系统研究。
此外,本研究还存在其他不足。其一,IS-EE中的指标成分(儿茶素和表儿茶素)对pH敏感,在pH>6时易降解,如后续将其制备为纳米制剂该问题可能会得到有效解决,同时对温度也较敏感,在制备过程中应加以注意。其二,采用PVA、Lig和CS以冻融法制备的高分子材料水凝胶虽然具备优良的机械性能、抗菌性能等,但其降解能力较薄弱是今后研究需要完善并解决的问题。
利益冲突 所有作者均声明不存在利益冲突
[1] Farokhi M, Mottaghitalab F, Fatahi Y,. Overview of silk fibroin use in wound dressings [J]., 2018, 36(9): 907-922.
[2] Soares R D F, Campos M G N, Ribeiro G P,. Development of a chitosan hydrogel containing flavonoids extracted fromleaves and the evaluation of its antioxidant and wound healing properties for the treatment of skin lesions in diabetic mice [J]., 2020, 108(3): 654-662.
[3] Park J W, Hwang S R, Yoon I S. Advanced growth factor delivery systems in wound management and skin regeneration [J]., 2017, 22(8): 1259.
[4] 张云封, 昝妮利, 朱枝祥, 等. 苗药血人参中黄酮类化学成分研究 [J]. 中草药, 2021, 52(12): 3485-3492.
[5] 段丽, 张永萍, 缪艳燕, 等. 苗药血人参不同提取部位体内外对乳腺癌4T1细胞的影响 [J]. 中草药, 2018, 49(12): 2902-2907.
[6] 秦帅, 张永萍, 陈希, 等. 高通量筛选抑制巨噬细胞迁移药物研究 [J]. 贵阳中医学院学报, 2020, 42(3): 87-90.
[7] Holloway J L, Spiller K L, Lowman A M,. Analysis of theswelling behavior of poly (vinyl alcohol) hydrogels in osmotic pressure solution for soft tissue replacement [J]., 2011, 7(6): 2477-2482.
[8] Singh B, Kumar A. Graft and crosslinked polymerization of polysaccharide gum to form hydrogel wound dressings for drug delivery applications [J]., 2020, 489: 107949.
[9] Arafa A A, Nada A A, Ibrahim A Y,. Preparation and characterization of smart therapeutic pH-sensitive wound dressing from red cabbage extract and chitosan hydrogel [J]., 2021, 182: 1820-1831.
[10] Wang L F, Kim D M, Lee C Y. Effects of heat processing and storage on flavanols and sensory qualities of green tea beverage [J]., 2000, 48(9): 4227-4232.
[11] Wu L J, Huang S Q, Zheng J,. Synthesis and characterization of biomass lignin-based PVA super-absorbent hydrogel [J]., 2019, 140: 538-545.
[12] Vdovenko S, Gerus I, Fedorenko E,. C-HF hydrogen bond and integral intensities of vinyl C-H vibtations in push-pull β-dimethylaminotrifluoromethyl ketone and its deuterated analog [J]., 2013, 2013: 640896.
[13] Zhang Y W, Jiang M M, Zhang Y Q,. Novel lignin-chitosan-PVA composite hydrogel for wound dressing [J]., 2019, 104: 110002.
[14] Guo B L, Finne-Wistrand A, Albertsson A C. Degradable and electroactive hydrogels with tunable electrical conductivity and swelling behavior [J]., 2011, 23(5): 1254-1262.
[15] Wei S M, You Y, Ma Y Y,. Bi-layer supramolecular polydimethylsiloxane elastomer film: Synthesis, characterization, and application in wound dressing on normal and diabetic rat [J]., 2019, 141: 21-32.
[16] Sullad A G, Manjeshwar L S, Aminabhavi T M. Novel pH-sensitive hydrogels prepared from the blends of poly (vinyl alcohol) with acrylic acid--guar gum matrixes for isoniazid delivery [J]., 2010, 49(16): 7323-7329.
[17] Rong Q F, Lei W W, Chen L,. Anti-freezing, conductive self-healing organohydrogels with stable strain-sensitivity at subzero temperatures [J]., 2017, 56(45): 14159-14163.
[18] Takuathung M N, Potikanond S, Sookkhee S,. Anti-psoriatic and anti-inflammatory effects ofin keratinocytes and macrophage cells [J]., 2021, 143: 112229.
[19] Isali I, McClellan P, Shankar E,. Genipin guides and sustains the polarization of macrophages to the pro-regenerative M2 subtype via activation of the pSTAT6-PPAR-gamma pathway [J]., 2021, 131: 198-210.
[20] Rőszer T. Understanding the mysterious M2 macrophage through activation markers and effector mechanisms [J]., 2015, 2015: 816460.
[21] He Y X, Li Y, Sun Y D,. A double-network polysaccharide-based composite hydrogel for skin wound healing [J]., 2021, 261: 117870.
Preparation of a hydrogel ofextract from Miao medicine and promotion of wound healingandstudy
SONG Xuanfei1, YANG Lu1, XIE Huan1, ZHOU Bin1, LIU Yao1, 2, 3, XU Jian1, 2, 3, ZHANG Yongping1, 2, 3
1. Guizhou University of Traditional Chinese Medicine, Guiyang 550025, China 2. Guizhou Ethnic Medicine Transdermal Drug Delivery Preparation Engineering Technology Research Center, Guiyang 550025, China 3. National Engineering Research Center of Miao’s Medicine, Guiyang 550025, China
To prepare of a polyvinyl alcohol (PVA)/lignin (Lig)/chitosan (CS) hydrogel containing extracts of(IS), a Miao medicine, and investigate its promoting wound healing mechanism.On the basis of single factor investigation, orthogonal test was performed to prefer the prescription process and to evaluate its quality andbiological evaluation, and its promoting wound healing effect was evaluated by establishing a rat whole skin injury model.The optimal prescription and preparation process of PVA/Lig/CS hydrogels carrying the extracts were 7.0 g of PVA, 4.0 g of CS, 0.5 g of Lig, and four freeze-thaw cycles of 6 h each. The gel has a porous mesh structure, good swelling property, moisture retention and some mechanical strength, as well as good biocompatibility, bacteriostatic properties and effective inhibition of macrophage cell migration, and the inhibition effect may be proportional to time. Thepharmacodynamic study of this hydrogel showed that its promoting wound healing effect may be related to the reduction of inflammatory cell infiltration in the wound tissue, promotion of macrophage polarisation towards the M2 type, and increase of capillary formation and fibrous tissue formation.The prepared PVA/Lig/CS hydrogel containing IS extract is simple, stable and feasible to prepare, has good slow-release properties, and has better therapeutic effect on all-over skin injury.
extract; PVA/Lig/CS hydrogel; wound healing;biological evaluation; pharmacodynamic study
R283.6
A
0253 - 2670(2024)09 - 2933 - 13
10.7501/j.issn.0253-2670.2024.09.008
2023-10-19
贵州省高等学校中药民族药(苗药)新剂型新制剂工程研究中心(黔教技[2022]022);国家苗药工程技术研究中心能力提升(黔科合中引地[2023]006);贵州省高层次创新型人才(黔科合平台人才-GCC[2023]037)
宋选飞(1996—),女,硕士研究生,主要研究方向为中药及民族药药物新制剂与新剂型。E-mail:xuanfeisong@126.com
通信作者:张永萍(1965—),女,教授,博士研究生导师。主要研究方向为中药及民族药新制剂、新剂型与新技术开发研究。E-mail: zgygpg@126.com
徐 剑(1977—),男,硕士,教授,研究方向为中药制剂新技术与新剂型。E-mail: twt8489@126.com
[责任编辑 郑礼胜]
