基于主成分分析、正交偏最小二乘判别分析及加权逼近理想解排序-灰色关联度融合模型评价不同产地珠子参质量
2024-05-14李海燕王慧然那丽莎金春花王加良
李海燕,王慧然,那丽莎,金春花,王加良*
基于主成分分析、正交偏最小二乘判别分析及加权逼近理想解排序-灰色关联度融合模型评价不同产地珠子参质量
李海燕1, 2,王慧然1,那丽莎1,金春花1,王加良1, 2*
1. 牡丹江医学院附属红旗医院 药学部,黑龙江 牡丹江 157000 2. 牡丹江医学院,黑龙江 牡丹江 157011
采用HPLC法对珠子参中多指标成分进行定量检测,建立主成分分析(principal component analysis,PCA)、正交偏最小二乘判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA)及加权逼近理想解排序-灰色关联度(technique for order preference by similarity to an ideal solution-grey relation analysis,TOPSIS-GRA)融合模型对不同产地珠子参进行质量评价,以提高珠子参药材整体质量控制水平。采用外标法测定珠子参中三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、人参皂苷Rd2、竹节参皂苷V、楤木皂苷A、竹节参皂苷IVa、越南参皂苷R4、齐墩果酸、镰叶芹醇、豆甾醇和β-谷甾醇含量,定量检测条件为Agilent Eclipse Plus C18色谱柱,流动相乙腈-0.2%磷酸梯度洗脱,检测波长205 nm,柱温30 ℃。以珠子参中13种成分含量为变量,通过PCA降维获得主成分并实现对样品分组,在样品分组基础上采用OPLS-DA挖掘影响珠子参质量的差异性标志物。建立加权TOPSIS-GRA融合模型对不同产地珠子参综合质量进行评价。珠子参中13种成分在各自范围内线性关系良好(>0.999),平均加样回收率为96.76%~100.06%(RSD<2.0%),精密度、稳定性和重复性试验结果符合《中国药典》2020年版规定。PCA结果显示前2个主成分特征值分别为9.757和1.976,累积方差贡献率为90.255%,15批珠子参聚为3组,呈现一定产地差异;OPLS-DA结果显示竹节参皂苷IVa、竹节参皂苷V、人参皂苷Rd2、β-谷甾醇、楤木皂苷A和人参皂苷Re是影响珠子参质量的差异性标志物。加权TOPSIS-GRA融合模型结果显示15批珠子参样品的平均相对贴近度(γ)为0.261 3~0.743 2,珠子参产品质量存在一定产地差异,同一产地差异较小,不同产地产品质量差异较大,同时聚类结果与PCA结果一致。建立的HPLC多指标成分定量控制方法操作便捷、结果准确,可用于珠子参中13种成分的同步检测;PCA、OPLS-DA及加权TOPSIS-GRA融合模型合理可靠,可用于不同产地珠子参质量评价。
珠子参;高效液相色谱法;主成分分析;OPLS-DA;加权TOPSIS;灰色关联度分析;质量评价;三七皂苷R1;人参皂苷Rg1;人参皂苷Re;人参皂苷Rb2;人参皂苷Rd2;竹节参皂苷V;楤木皂苷A;竹节参皂苷IVa;越南参皂苷R4;齐墩果酸;镰叶芹醇;豆甾醇;β-谷甾醇
珠子参为五加科植物珠子参C. A. Mey. var.(Burk.) C. Y. Wu et K. M. Feng或羽叶三七C. A. Mey. var.(Seem.) C. Y. Wu et K. M. Feng的干燥根茎,别名扣子七,是一种珍稀中药材。主要含有多种皂苷类化合物,此外,还含有挥发油、酚类物质、甾体、氨基酸、蛋白质等多种成分[1-3],具有补肺养阴、祛瘀止痛、止血之功。临床常用于气阴两虚、烦热口渴、虚劳咳嗽、跌扑损伤、关节痹痛、咳血、吐血、衄血、崩漏、外伤出血[4]。现代医学研究证明,珠子参在抗肿瘤、镇痛以及调节机体免疫功能等方面具有良好的药理活性[5],还可保肝降酶[6-7],珠子参多糖具有抗肝癌作用[8],珠子参地上部分可通过多成分、多靶点、多途径协同发挥防治脂肪肝的作用[9]。中药材成分繁杂、干扰多,因而多指标综合评价模式仍是中药质量评价的主要研究方向。主成分分析(principal component analysis,PCA)和正交偏最小二乘法-判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA)是化学识别模式最常用的分析方法,通过降维的方式对多变量进行分析,预测精度高,越来越多地用于评价中药质量[10-11]。灰色关联度分析(grey relation analysis,GRA)法是解决多目标之间复杂关系问题的有力工具[12],可根据因素间相互关联度的比较来确定哪些因素是影响大的主导因素,对各指标的综合评判值表达直观,避免了人为判断[13]。加权逼近理想解排序(technique for order preference by similarity to an ideal solution,TOPSIS)法可以通过对多指标进行合理赋权,以距离理想化目标的程度为基准进行综合评价,能够避免主观因素对品质评价的影响,准确性和科学性良好[14]。利用加权TOPSIS法与GRA法相整合的多目标综合评价方法,从横纵2个维度对评价目标进行综合评价,既消除了主观臆断性又增强了评价结果准确性。中药所含化学成分复杂,药效是多种成分协同或拮抗作用的结果,不能简单地用少数几个同类化学成分来评价其质量,因此建立一种不同类别的多种指标成分定量,对其质量进行评价,对中药的研究、开发、利用具有指导意义。本研究利用HPLC法对全国6省15批次珠子参样品三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、人参皂苷Rd2、竹节参皂苷V、楤木皂苷A、竹节参皂苷IVa、越南参皂苷R4、齐墩果酸、镰叶芹醇、豆甾醇和β-谷甾醇的含量进行测定,并借助于化学计量学、GRA与加权TOPSIS法融合模型对测定的含量数据进行分析,从而对不同产地珠子参质量的优劣进行排序,旨为珠子参的道地性开发和内在质量的全面控制提供科学依据。
1 材料
1.1 试药
对照品三七皂苷R1(批号110745-202322,质量分数97.8%)、人参皂苷Rg1(批号110703-202235,质量分数98.5%)、人参皂苷Re(批号110754-202330,质量分数96.9%)、人参皂苷Rb2(批号111715-202104,质量分数95.0%)、竹节参皂苷IVa(批号111861-202203,质量分数94.0%)、齐墩果酸(批号110709-202109,质量分数95.8%)、β-谷甾醇(批号110851-201909,质量分数92.7%)和竹节参皂苷V(批号111903-202307,质量分数92.5%)均购自中国食品药品检定研究院;对照品楤木皂苷A(批号PRF8082242,质量分数98.1%)、豆甾醇(批号PRF8071843,质量分数98.7%)、人参皂苷Rd2(批号PRFM22050917,质量分数98.6%)、越南参皂苷R4(批号PRF23090623,质量分数99.8%)和镰叶芹醇(批号PRF22051941,质量分数98.5%)由成都普瑞法生物科技有限公司供给;高效液相用乙腈和磷酸为德国Merck公司生产的色谱纯试剂,乙醇为天津市大茂化学试剂厂生产的分析纯试剂;珠子参药材经牡丹江医学院王加良副教授鉴定为珠子参C. A. Mey. var.(Burk.) C. Y. Wu et K. M. Feng的干燥茎,采集地信息见表1。

表1 珠子参药材信息
1.2 仪器
PR223ZH型分析天平(上海众渊实业有限公司);1260 InfinityⅡ型高效液相色谱仪(美国Agilent Technologies公司);KH-250B型数控超声波清洗器(昆山合创超声仪器公司)。
2 方法与结果
2.1 指标成分的测定
2.1.1 对照品溶液的制备 精密称取各对照品适量,60%乙醇溶解,制成含0.132 mg/mL三七皂苷R1、0.186 mg/mL人参皂苷Rg1、1.91 mg/mL人参皂苷Re、0.064 mg/mL人参皂苷Rb2、0.396 mg/mL人参皂苷Rd2、9.98 mg/mL竹节参皂苷V、3.714 mg/mL楤木皂苷A、14.57 mg/mL竹节参皂苷IVa、0.038 mg/mL越南参皂苷R4、0.87 mg/mL齐墩果酸、0.214 mg/mL镰叶芹醇、0.096 mg/mL豆甾醇、0.332 mg/mL β-谷甾醇的混合贮备液。精密吸取贮备液1 mL,至20 mL量瓶中,用60%乙醇定容至刻度,摇匀,即得。
2.1.2 供试品溶液的制备 取粉碎的珠子参粉末约0.5 g,精密称定,置25 mL量瓶中,用60%乙醇约20 mL超声提取45 min,冷却,滤过,用提取溶剂定容至25 mL,摇匀,滤过,即得。
2.1.3 色谱条件[15-17]色谱柱为Agilent Eclipse Plus C18柱(250 mm×4.6 mm,5 μm);检测波长205 nm;乙腈-0.2%磷酸为流动相梯度洗脱(0~11 min,16.0%乙腈;11~43 min,16.0%~32.0%乙腈;43~58 min,32.0%~55.0%乙腈;58~65 min,55.0%~16.0%乙腈);进样体积10 µL,柱温30 ℃,体积流量1.0 mL/min。在以上HPLC条件下得到的色谱图显示三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、人参皂苷Rd2、竹节参皂苷V、楤木皂苷A、竹节参皂苷IVa、越南参皂苷R4、齐墩果酸、镰叶芹醇、豆甾醇和β-谷甾醇与基线能完全分离,理论板数按各成分计均大于5 500(图1)。
2.1.4 线性关系考察 精密量取“2.1.1”项混合贮备液0.1、0.2、0.5、1.0、2.0、5.0 mL,分别置于20 mL量瓶中,用提取溶剂定容,摇匀制得制成一系列质量浓度的混合对照品溶液。在建立的HPLC条件下,依次进样分析,记色谱图。以对照品质量浓度与峰面积制作标准曲线,线性方程和相关系数见表2。
2.1.5 精密度试验 取珠子参(S1),按“2.1.2”项制备供试品溶液,连续进样6次,每次10 µL,测定峰面积,结果峰面积无显著变化,三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、人参皂苷Rd2、竹节参皂苷V、楤木皂苷A、竹节参皂苷IVa、越南参皂苷R4、齐墩果酸、镰叶芹醇、豆甾醇、β-谷甾醇峰面积的RSD值依次为1.33%、1.30%、0.74%、1.28%、1.16%、0.33%、0.59%、0.17%、1.49%、0.91%、1.17%、1.36%、1.13%,表明仪器精密度能满足检测要求。
2.1.6 稳定性试验 取一份珠子参(S1)供试品溶液,于制备后每隔4 h进样检测,考察至24 h,每次10 µL,测定峰面积,结果峰面积变化不显著,三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、人参皂苷Rd2、竹节参皂苷V、楤木皂苷A、竹节参皂苷IVa、越南参皂苷R4、齐墩果酸、镰叶芹醇、豆甾醇、β-谷甾醇峰面积的RSD值依次为1.51%、1.43%、1.03%、1.35%、1.21%、0.42%、0.77%、0.25%、1.51%、1.08%、1.32%、1.55%和1.21%,表明珠子参供试品溶液在24 h内具有稳定性。

1-三七皂苷R1;2-人参皂苷Rg1;3-人参皂苷Re;4-人参皂苷Rb2;5-人参皂苷Rd2;6-竹节参皂苷V;7-楤木皂苷A;8-竹节参皂苷Iva;9-越南参皂苷R4;10-齐墩果酸;11-镰叶芹醇;12-豆甾醇;13-β-谷甾醇。
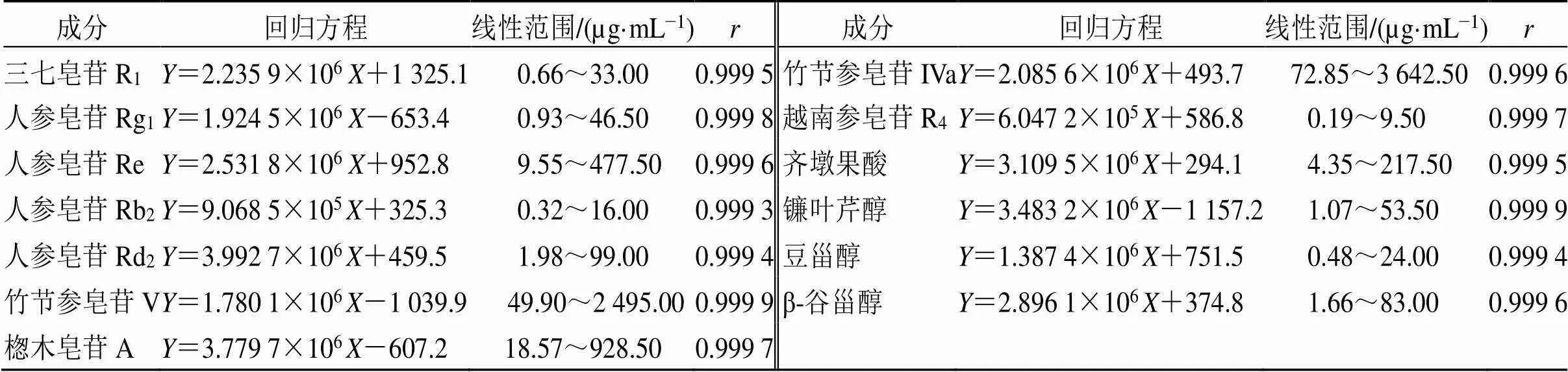
表2 HPLC法测定13种成分的线性关系
2.1.7 重复性试验 取珠子参(S1)6份,分别按“2.1.2”项方法平行制成6份供试品溶液,进样分析,测得峰面积,计算三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、人参皂苷Rd2、竹节参皂苷V、楤木皂苷A、竹节参皂苷IVa、越南参皂苷R4、齐墩果酸、镰叶芹醇、豆甾醇、β-谷甾醇平均质量分数分别为0.279、0.513、6.301、0.129、1.263、31.626、12.057、46.818、0.083、2.675、0.708、0.212、0.990 mg/g,RSD值依次为1.83%、1.79%、1.66%、1.93%、1.71%、0.69%、0.93%、0.58%、1.92%、1.37%、1.53%、1.78%、1.49%,表明方法重复性良好。
2.1.8 加样回收率试验 取已测定的三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、人参皂苷Rd2、竹节参皂苷V、楤木皂苷A、竹节参皂苷IVa、越南参皂苷R4、齐墩果酸、镰叶芹醇、豆甾醇和β-谷甾醇含量的珠子参(S1)9份,粉碎,每份取0.25 g,精密称定,分别按低、中、高3个水平加入混合对照品溶液(三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、人参皂苷Rd2、竹节参皂苷V、楤木皂苷A、竹节参皂苷IVa、越南参皂苷R4、齐墩果酸、镰叶芹醇、豆甾醇和β-谷甾醇质量浓度分别为0.069、0.124、1.579、0.032、0.318、7.894、2.983、11.716、0.021、0.672、0.173、0.056和0.249 mg/mL)0.8、1.0、1.2 mL,再按照供试品溶液制备方法制成加样供试品溶液,进样,计算三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、人参皂苷Rd2、竹节参皂苷V、楤木皂苷A、竹节参皂苷IVa、越南参皂苷R4、齐墩果酸、镰叶芹醇、豆甾醇、β-谷甾醇的平均加样回收率及相应的RSD值分别为97.55%、98.47%、100.06%、96.76%、98.86%、100.05%、99.13%、99.48%、97.87%、98.86%、96.89%、97.87%、98.16%,RSD值分别为1.11%、1.18%、0.52%、1.21%、1.04%、0.54%、1.08%、0.32%、1.43%、1.24%、0.82%、1.17%、1.12%,表明该方法的回收率符合含量测定要求,准确度高。
2.1.9 定量测定 分别取编号S1~S15的珠子参粉末各约0.5 g,精密称定,按照供试品溶液处理流程制成供试品溶液,进样,代入标准曲线,采用峰面积外标法计算三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、人参皂苷Rd2、竹节参皂苷V、楤木皂苷A、竹节参皂苷IVa、越南参皂苷R4、齐墩果酸、镰叶芹醇、豆甾醇、β-谷甾醇的含量,计算结果见表3。
表3 不同产地与批号的珠子参中13种成分的含量测定结果(=3)

Tab.3 Determination results of 13 components in Panacis Majoris Rhizoma from different origins and batches (n=3)
2.2 化学计量学分析评价
2.2.1 PCA 以15批珠子参中三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、人参皂苷Rd2、竹节参皂苷V、楤木皂苷A、竹节参皂苷IVa、越南参皂苷R4、齐墩果酸、镰叶芹醇、豆甾醇和β-谷甾醇含量数据为变量,运用SPSS 26.0软件对不同产地的珠子参进行PCA,结果见表4、5。由表4可知前2个主成分特征值分别为9.757和1.976(特征值>1)[18],方差贡献率分别为75.054%和15.201%,表明前2个主成分代表珠子参90.255%信息量。表5显示三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、竹节参皂苷V、楤木皂苷A、竹节参皂苷IVa、齐墩果酸、镰叶芹醇和豆甾醇在第1主成分中载荷较高,人参皂苷Rd2、越南参皂苷R4和β-谷甾醇在第2主成分中载荷较高。为考察15批珠子参的聚类情况,再借助SIMCA 14.1软件建立PCA模型(图2),结果显示15批样品聚为3组,各批次散点较分散,提示质量差异较大,其中S1~S6质量较接近,S7~S10质量较接近,S11~S15质量较接近。
2.2.2 OPLS-DA[19]为探究不同产地珠子参样品聚类分组的原因,查找引起组间差异的主要因素,将15批珠子参中13个组分含量数据矩阵导入SIMCA 14.1软件并运行OPLS-DA程序,得OPLS- DA模型得分图(图3),结果模型参数2为0.981,2为0.922,2为0.870,3个参数均接近1,表明模型稳定可靠、拟合度和预测能力良好。变量重要性投影值越大,对产品质量差异贡献度越大。结合图4,以VIP>1为筛选标准,结果竹节参皂苷IVa、竹节参皂苷V、人参皂苷Rd2、β-谷甾醇、楤木皂苷A和人参皂苷Re的VIP值分别为2.045、1.813、1.201、1.061、1.045和1.024,均大于1,表明这6个成分在15批珠子参聚类分组时具有显著重要性[20],对质量影响较大,可作为影响珠子参产品质量的差异标志物。对OPLS-DA模型进行置换200次,结果2拟合直线轴截距小于0.3,2拟合直线轴截距为负值,提示OPLS-DA模型不存在过度拟合,详见图5。

表4 珠子参PCA分析

表5 珠子参中13种成分的载荷矩阵

图2 15批珠子参的PCA得分图
2.3 加权TOPSIS-GRA融合模型建立
首先对含量数据进行处理,利用OPLS-DA中各指标成分的VIP值作为评价指标权重,并确定最优与负理想样本,再计算得到各样本与最优负理想样本的欧氏距离、各样本与最优负理想样本的灰色关联度,最后计算相对贴近度[21]。
2.3.1 加权TOPSIS归一化数据处理 15批珠子参中三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、人参皂苷Rd2、竹节参皂苷V、楤木皂苷A、竹节参皂苷IVa、越南参皂苷R4、齐墩果酸、镰叶芹醇、豆甾醇和β-谷甾醇含量差异较大,且均为药效成分,故使用公式(1)对含量数据进行归一化处理[22],处理后数值见表6。

图3 15批珠子参样品OPLS-DA模型得分图

图4 15批珠子参样品VIP图

图5 OPLS-DA置换检测结果图
2.3.2 加权TOPSIS各评价指标评分计算 以OPLS-DA分析中13个指标的VIP值作为各指标权重(Q),按照公式(2)计算加权决策矩阵,矩阵结果见表7,利用各成分矩阵结果确定正理想样本(+)和负理想样本(−),按照公式(3)、(4),计算各评价指标到正理想样本的距离(d+)和到负理想样本的距离(d−)[21],计算结果见表8。
Z=Y×Q(2)



表6 归一化处理结果

表7 加权矩阵

表8 15批珠子参TOPSIS评价di+和di-值
2.3.3 GRA数据标准化 由于15批珠子参中三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、人参皂苷Rd2、竹节参皂苷V、楤木皂苷A、竹节参皂苷IVa、越南参皂苷R4、齐墩果酸、镰叶芹醇、豆甾醇和β-谷甾醇含量具有较大的差异,需按照公式(5)对含量数据进行标准化处理[23],处理结果见表9。
Y=Z/Z(5)
Z为各评价指标含量数据,Z为第个评价指标含量检测结果的均值。

表9 珠子参中13种成分含量原始数据标准化处理结果



Δmin=min|Y-Y|、Δmax=max|Y-Y|、Δ′min=min |Y-Y|、Δ′max=max |Y-Y|,为分辨系数[20],取值0.5
2.3.5 GRA关联度及相对关联度计算 关联度为每个被评价对象的所有评价指标关联系数的平均值,分别按公式(8)计算被评价对象相对于最优参考序列的关联度,按公式(9)计算被评价对象相对于最差参考序列的关联度,结果见表10。

表10 15批珠子参GRA评价ri+和ri−值
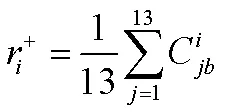

2.3.6 加权TOPSIS-GRA融合模型[21]首先按公式(10)~(13)对样品的参考序列欧氏距离和关联度进行无纲量化处理,再按公式(14)、(15)计算融合无纲量化后的欧氏距离和灰色关联度。−和R+值越大,样品越趋近理想样本,E+值综合评价了不同批次样品与理想样本的逼近程度,样品质量越好,E+值越大;E−反映了不同批次样品与理想样本的远离程度,样品质量越差,E−值越大。相对贴近度(i)按照公式(16)计算,其大小可反映样品与正、负理想样本接近的趋势程度。γ越大,样品质量越好。结果见表11。
D+=d+/maxd+(10)
D−=d−/maxd−(11)
R+=r+/maxr+(12)
R−=r−/maxr−(13)
E+=αD−+βR+(14)
E-=α++βR−(15)
γ=E+/(E++E−) (16)
其中α,β均为0.5

表11 15批珠子参样品的品质排序
由表11可以看出,15批珠子参样品平均相对贴近度在0.261 3~0.743 2,产品质量差异较大,其中样品S11~S15排名位于前5位,相对贴近度均>0.6,排名前5的均产自云南和贵州,提示云南和贵州产的珠子参质量较优。
3 讨论
在前期预试验中分别考察了超声提取时不同浓度的乙醇溶液(30%乙醇、60%乙醇和70%乙醇),时间考察了30、45、60 min,从提取的色谱信息全面性、色谱峰丰度、杂质干扰等方面考虑,发现60%乙醇超声提取45 min为珠子参供试品制备的最佳方法。还考察了不同流动相系统(乙腈-0.02%磷酸溶液[15]、乙腈-0.1%磷酸溶液[16]、乙腈-0.2%磷酸溶液[17])不同洗脱程序对供试品溶液色谱图的影响。结果显示,乙腈-0.2%磷酸溶液按2.1.3项梯度程序运行时,所得色谱图中基线平稳、色谱峰数量较多且色谱峰丰度饱满。
珠子参主要含有皂苷类、甾体类、挥发油、酚类等多种化学成分,其中三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、人参皂苷Rd2、竹节参皂苷V、楤木皂苷A、竹节参皂苷IVa、越南参皂苷R4、齐墩果酸等皂苷类是珠子参主要活性成分,在保护心脑血管系统、肝脏、镇痛镇静、抗炎、抗肿瘤等方面均具有良好的药理活性[2]。豆甾醇、镰叶芹醇和β-谷甾醇为其甾体类主要成分。现代研究表明竹节参皂苷IVa和竹节参皂苷V可促进巨噬细胞自噬、抑制泡沫化的发生、降低炎性因子[25];人参皂苷Re可改善心肌缺血、抗心肌缺血再灌注损伤、抗心肌细胞凋亡、抗心律失常、对缝隙连接重塑、对心肌细胞的减毒[26];竹节参皂苷Ⅳa、竹节参皂苷V和人参皂苷Re是珠子参中起保肝作用的核心成分。楤木皂苷A具有良好的抗溃疡、抗肿瘤、降血糖、抗凝血、抑制肾素活性、抑制Fas介导的角质形成细胞凋亡等活性[27]。β-谷甾醇可使胃癌细胞中AMPK、PTEN蛋白表达增加,HS90蛋白表达下调,诱导肿瘤细胞凋亡及抑制其生长[28]。齐墩果酸、豆甾醇、β-谷甾醇等是珠子参防治脂肪肝的主要活性成分[9]。作者在实验中,参考已有对珠子参成分定量检测的文献报道,曾尝试对人参皂苷Rg3进行定量检测,结果显示,人参皂苷Rg3含量较低,不宜作为定量控制指标成分,与文献报道[29]结果一致,故最终确定采用三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、人参皂苷Rd2、竹节参皂苷V、楤木皂苷A、竹节参皂苷IVa、越南参皂苷R4、齐墩果酸、镰叶芹醇、豆甾醇和β-谷甾醇为定量检测指标。
本实验采用HPLC法对6省15批珠子参中三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、人参皂苷Rd2、竹节参皂苷V、楤木皂苷A、竹节参皂苷IVa、越南参皂苷R4、齐墩果酸、镰叶芹醇、豆甾醇和β-谷甾醇进行定量测定,发现产品质量差异较大,其中不同产地的珠子参中三七皂苷R1的含量差异最大,在0.144~0.385 mg/g;越南参皂苷R4含量差异最小,在0.062~0.098 mg/g。为查找引起质量差异的主要成分,利用化学计量学对检测的含量数据进行分析,结果15批不同产地珠子参呈明显的分类趋势,明显聚焦为3组,呈现一定的产区差异。OPLS-DA发掘出引起珠子参产品质量差异的主要标志物为竹节参皂苷IVa、竹节参皂苷V、人参皂苷Rd2、β-谷甾醇、楤木皂苷A和人参皂苷Re。加权TOPSIS-GRA融合模型结果显示,15批珠子参相对贴近度在0.261 3~0.743 2,其中云南和贵州产地样品相对贴近度均高于0.6,其值越大,样品质量越好,表明云南和贵州产珠子参整体质量较好,与文献报道[30]结果一致,可能与珠子参平均气温、海拔高度等生长环境有关,后续将进一步扩大样品产地及产地气候、土壤、海拔、采收季节等影响珠子参生长的关键参数收集和分析,为珠子参道地性研究提供数据参考。
本实验采用HPLC法同时检测了15批珠子参中三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、人参皂苷Rd2、竹节参皂苷V、楤木皂苷A、竹节参皂苷IVa、越南参皂苷R4、齐墩果酸、镰叶芹醇、豆甾醇和β-谷甾醇的含量,利用OPLS-DA联合加权TOPSIS与GRA融合技术对其质量进行综合评价,建立的定量控制模式及评价模式可用于珠子参的内在质量评价,值得推广。
利益冲突 所有作者均声明不存在利益冲突
[1] 王丽, 苏钛, 侯安国. 珠子参的化学成分及药理作用研究进展 [J]. 中国中医基础医学杂志, 2020, 26(7): 1037-1040.
[2] 杨延, 张翔, 姜森, 等. 珠子参中皂苷成分及其药理活性研究进展 [J]. 食品工业科技, 2019, 40(2): 347-356.
[3] 李柏森, 张俊岭, 汪浩斌, 等. 云南不同产地珠子参的品质评价研究 [J]. 中国野生植物资源, 2023, 42(S1): 5-11.
[4] 中国药典[S]. 一部. 2020: 283-284.
[5] 王辉, 郭天康, 胡鹏斌. 珠子参临床药理研究进展 [J]. 甘肃医药, 2015, 34(2): 99-101.
[6] 张海潮, 周瑞, 唐志书, 等. 基于网络药理学、分子对接、体外细胞实验预测珠子参保肝机制 [J]. 中成药, 2021, 43(9): 2342-2351.
[7] 许苗苗, 张旋, 宋蓓, 等. 珠子参抗肝损伤药效的物质基础研究 [J]. 西北药学杂志, 2014, 29(5): 486-489.
[8] 陈涛, 陈茂华, 胡月琴, 等. 珠子参多糖抗肝癌作用的实验研究 [J]. 时珍国医国药, 2010, 21(6): 1329-1331.
[9] 郭敏, 贺依依, 徐虹, 等. 基于网络药理学和分子对接探讨珠子参地上部分防治脂肪肝的作用机制 [J]. 中南药学, 2021, 19(5): 836-844.
[10] 于洋, 李军, 李宝国. 化学计量学在中药质量控制研究中的应用 [J]. 中成药, 2018, 40(5): 1139-1142.
[11] 何佳, 黄文康, 马相锋, 等. 基于主成分分析与PLS-DA分析研究浙麦冬道地性与等级评价标准 [J]. 中国药学杂志, 2021, 56(4): 285-292.
[12] Pandey R K, Panda S S. Optimization of multiple quality characteristics in bone drilling using grey relational analysis [J]., 2014, 12(1): 39-45.
[13] 李力, 潘倩雯, 刘宏. 灰色关联度分析法在中药谱效学研究中的应用 [J]. 中国药房, 2018, 29(11): 1581-1584.
[14] 李雨昕, 邢娜, 白浩东, 等. 基于熵权法的灰色关联法-TOPSIS法对不同产地三七及其炮制品质量的评价研究[J]. 中草药, 2023, 54(4): 1252-1259.
[15] 李慧, 邹晨鑫, 高静, 等. HPLC法同时测定不同采收期珠子参中5种皂苷类成分含量 [J]. 中国民族民间医药, 2021, 30(12): 42-46.
[16] 张海元, 夏伟军, 谢佳颖, 等. 珠子参药材中皂苷类成分的薄层色谱及HPLC特征图谱研究 [J]. 中国现代中药, 2017, 19(3): 358-361.
[17] 任华忠, 朱丽金, 何毓敏. 珠子参总皂苷的HPLC特征图谱及化学成分研究 [J]. 中成药, 2022, 44(9): 2885-2890.
[18] 阿迪拉·阿布都热西提, 戴乐, 古丽巴哈尔·达吾提, 等. HPLC指纹图谱及化学模式识别鉴别菟丝草药材 [J]. 南开大学学报: 自然科学版, 2020, 53(5): 7-14.
[19] 李惠敏, 李凤超, 高必兴, 等. 基于HPLC指纹图谱及化学模式识别对比研究曲花紫堇及同属药材 [J]. 中草药, 2024, 55(5): 1709-1716.
[20] 黄广伟, 陈淮臣, 刘渝, 等. 基于灰色关联度和偏最小二乘回归分析的芩苏胶囊抑菌谱效关系研究 [J]. 药物评价研究, 2022, 45(6): 1060-1069.
[21] 张娜, 翁伟锋, 魏坤盛, 等. 基于灰色关联度与TOPSIS融合模型对不同产地广西郁金的质量评价 [J]. 中国实验方剂学杂志, 2020, 26(3): 137-145.
[22] 吴良发, 赵雯, 刘敏, 等. 基于熵权法和灰色关联度法评价丁香饮片质量 [J]. 药物流行病学杂志, 2023, 32(8): 906-914.
[23] 曾昭君, 余欣彤, 邓成程, 等. 基于化学模式识别和熵权TOPSIS法分析木棉花不同部位的差异 [J]. 天然产物研究与开发, 2022, 34(9): 1557-1564.
[24] 庞文娟, 张生杰, 田志梅. 灰色关联分析结合聚类分析评价不同产地板蓝根饮片质量 [J]. 中医药导报, 2023, 29(5): 53-57.
[25] 袁林, 梁晓晓, 罗颖, 等. 竹节参皂苷Ⅳa抑制THP-1源性巨噬细胞泡沫化的研究 [J]. 中国临床药理学杂志, 2022, 38(10): 1051-1054.
[26] 田静, 任雨贺, 刘淑莹, 等. 人参皂苷Re对心血管系统的药理作用研究进展 [J]. 安徽农业科学, 2019, 47(6): 23-25.
[27] 翟秉涛, 郭东艳. 楤木皂苷A的研究进展 [J]. 中南药学, 2016, 14(9): 967-971.
[28] Shin E J, Choi H K, Sung M J,. Anti-tumour effects of beta-sitosterol are mediated by AMPK/PTEN/HSP90 axis in AGS human gastric adenocarcinoma cells and xenograft mouse models [J]., 2018, 152: 60-70.
[29] 刘妍如, 史鑫波, 陈永琴, 等. HPLC-ESI-MS/MS法同时测定珠子参中15种皂苷类化合物 [J]. 中草药, 2016, 47(19): 3502-3507.
[30] 赵毅, 赵仁, 宋亮, 等. 珠子参药材品种概述及资源现状调查 [J]. 中国现代中药, 2011, 13(1): 11-17.
Quality evaluation offrom different producing areas by PCA, OPLS-DA and weighted TOPSIS-GRA fusion model
LI Haiyan1, 2, WANG Huiran1, NA Lisha1, JIN Chunhua1, WANG Jialiang1, 2
1. Department of pharmacy, Hongqi Hospital Affiliated to Mudanjiang Medical University, Mudanjiang 157000, China 2. Mudanjiang Medical University, Mudanjiang 157011, China
To quantitatively detect the multi-index components of Zhuzishen () by HPLC, and establish a fusion model of principal component analysis (PCA), orthogonal partial least-squares discrimination analysis (OPLS-DA) and weighted technique for order preference by similarity to an ideal solution-grey relation analysis (TOPSIS-GRA) to evaluate the quality offrom different places, so as to improve the overall quality control level of.Quantitative detection conditions were determined by HPLC on Agilent Eclipse Plus C18column with gradient elution of mobile phase acetonitrile-0.2% phosphoric acid at 205 nm and column temperature at 30 ℃. The contents of notoginsenoside R1, ginsenoside Rg1, ginsenoside Re, ginsenoside Rb2, ginsenoside Rd2, chikusetsusaponin V, araloside A, chikusetsusaponin IVa, vina ginsenoside R4, oleanolic acid, falcarinol, stigmasterol and β-sitosterol were determined by external standard method. Based on the content of 13 components in, the principal components were obtained by PCA and the samples were grouped. On the basis of the sample grouping, OPLS-DA was used to find the difference markers affecting the quality of. A weighted TOPSIS-GRA fusion model was established to evaluate the comprehensive quality offrom different origin.The 13 components had good linear relationships within their respective ranges (> 0.999), and the average recovery rate (=9) were 96.76%—100.06% (RSD<2.0%), the precision, stability and repeatability test results were in accordance with the provisions of Chinese Pharmacopoeia. The results of PCA showed that the eigenvalues of the first two principal components were 9.757 and 1.976, respectively, and the cumulative variance contribution rate was 90.255%. The 15 batches ofwere clustered into three groups, showing certain differences in origin. The results of OPLS-DA showed that chikusetsusaponin IVa, chikusetsusaponin V, ginsenoside Rd2, β-sitosterol, araloside A and ginsenoside Re were the different markers affecting the quality of. The results of the weighted TOPSIS-GRA fusion model showed that the average relative proximity (γi) of 15 batches ofsamples ranged from 0.261 3 to 0.743 2, and there were some differences in the quality ofproducts from different regions, with small differences in the same region and large differences in the quality of products from different regions. Meanwhile, the clustering results were consistent with the PCA results.The HPLC method can simultaneously determine the 13 components inRhizoma, which is simple and practical, OPLS-DA with weighted TOPSIS-GRA can be used to evaluate the quality ofRhizoma.
; HPLC; PCA; OPLS-DA; weighted TOPSIS; GRA; quality evaluation; notoginsenoside R1; ginsenoside Rg1; ginsenoside Re; ginsenoside Rb2; ginsenoside Rd2; chikusetsusaponin V; araloside A; chikusetsusaponin IVa; vina ginsenoside R4; oleanolic acid; falcarinol; stigmasterol; β-sitosterol
R286.2
A
0253 - 2670(2024)09 - 3116 - 11
10.7501/j.issn.0253-2670.2024.09.025
2023-10-14
黑龙江省卫生健康委科研课题(2019-403)
李海燕(1986—),女,朝鲜族,硕士,主管药师,主要从事药物质量评价及医院药学研究工作。Tel: (0453)6602052
通信作者:王加良(1978—),男,汉族,硕士,副主任药师,主要从事临床药学研究。Tel: (0453)6602788 E-mail: pttbtu@163.com
[责任编辑 时圣明]
