甘草新型自组装纳米粒的形成及抗炎作用评价
2024-05-14孟雨婷薛玉叶万志若高翠芸杭凌宇袁海龙
孟雨婷,薛玉叶,刘 燕,万志若,高翠芸,杭凌宇*,袁海龙*
甘草新型自组装纳米粒的形成及抗炎作用评价
孟雨婷1, 2,薛玉叶2,刘 燕1, 2,万志若2,高翠芸2,杭凌宇2*,袁海龙1, 2*
1. 安徽医科大学药学院,安徽 合肥 230032 2. 空军军医大学空军特色医学中心药学部,北京 100142
对传统中药煎煮自组装现象进行改良,应用微沉淀法制备甘草新型自组装纳米粒(glycyrrhiza novel self-assembled nanoparticles,GN-SAN),将其与传统水煎煮形成的甘草SAN(glycyrrhiza decoction self-assembled nanoparticles,GD-SAN)进行系统比较,进一步探究GN-SAN对2,4-二硝基氯苯(2,4-dinitrochlorobenzene,DNCB)诱导的小鼠特应性皮炎的治疗作用。采用煎煮结合微沉淀法制备GN-SAN,以粒径、PDI和ζ电位为评价指标,通过单因素试验联合Box-Behnken设计-响应面法对煎煮时间、磁力搅拌转速、磁力搅拌时间、磁力搅拌温度、旋转蒸发温度以及生药质量浓度进行优化,筛选最优处方工艺。将优化后的GN-SAN与GD-SAN进行比较,扫描电子显微镜(scanning electron microscope,SEM)和透射电子显微镜(transmission electron microscope,TEM)观察形态;高效液相色谱仪(HPLC)、紫外分光光度计(UV)以及bicinchoninic acid(BCA)试剂盒检测各SAN中小分子活性成分(芹糖甘草苷、甘草苷、芹糖异甘草苷、异甘草苷、甘草酸、甘草查耳酮A)、多糖以及蛋白的含量。采用DNCB对小鼠背部皮肤刺激,建立特应性皮炎模型。将小鼠分为空白组,模型组,阳性药组,GN-SAN凝胶低、中、高剂量组,观察各小鼠背部皮肤皮损变化,对皮损组织病理变化、炎症因子表达、脏器指数等指标进行检测。GN-SAN的最佳处方工艺:甘草经8倍量水煎煮1 h,得GD-SAN。再经6倍70%乙醇煎煮1 h后得醇提液,合并2次提取液,600 r/min磁力搅拌20 min,60 ℃旋转蒸发除醇并浓缩至0.2 g/mL,即得GN-SAN。形成的SAN性质稳定,为形态均一的圆球形纳米粒,粒径为(189.5±0.3)nm,多分散指数为0.138±0.130,ζ电位为(−31.4±0.8)mV。其粒径大小、均匀性、稳定性及有效成分转移率相对于传统SAN均提高,且GN-SAN对皮炎有良好的治疗效果。采用煎煮法结合微沉淀法制备GN-SAN,其工艺简单、主要成分含量高,稳定性好;制成的GN-SAN性能优良、抗炎作用显著,为甘草纳米制剂进一步开发应用奠定基础。
甘草;自组装纳米粒;Box-Behnken设计-响应面法;物质基础;特应性皮炎;抗炎;微沉淀法;芹糖甘草苷;甘草苷;芹糖异甘草苷;异甘草苷;甘草酸;甘草查耳酮A;多糖;蛋白质
中药自组装是近年各学者研究与探讨的热门话题,中药在煎煮过程中,大量化合物从中药材转移到汤剂中,化学分子之间发生相互作用并形成自组装纳米粒(self-assembled nanoparticles,SAN)[1-2]。研究表明SAN可以包封难溶性小分子,提高溶解度及生物利用度,增强药效[3-5]。如黄连汤中的SAN,能够促进细胞旁小檗碱运输,并通过主动运输和胞吞作用改善细胞间小檗碱运输[6]。甘草通过煎煮可以包裹芍药有效成分形成聚集体,增加其溶解度,延长在体内发挥作用的时间[7-8]。从白虎汤汤液中发现的纳米聚集体的解热作用强于水溶液,该部位的细胞摄取率和靶向性也显著增强[9]。中药在经过煎煮中天然成分自组装形成纳米粒很可能是一个很有前途现代制剂研究方向。
然而中药SAN的临床可行性、稳定性是评估药物是否可能用于临床应用的关键指标,由于传统方式煎煮获得的SAN在常温水相下长时间放置也会出现粒径、ζ电位的变化[10-11]。若要保证中药SAN的结构稳态与均一性,则需要在调控温度、煎煮时间、pH值等因素变化,更重要的是,传统水煎煮往往存在难溶性成分转移率低的问题,限制了中药活性成分的有效递送。因此,需要通过有效的制剂技术,提高SAN的稳定性及有效成分转移率。
甘草为豆科甘草属植物甘草Fisch.、胀果甘草Bat.或光果甘草L.的干燥根和根茎[12],具有解毒、调和诸药、祛风止痒的功效。甘草及其活性成分制剂作为经验用药在临床上被广泛应用于治疗多种皮肤病,具有良好的抗病毒、抗炎、抗变态反应等功效,效果显著[13-15]。本课题组前期研究发现,甘草经水煎煮可形成SAN,但在进一步应用过程中发现其存在稳定性不佳,难溶性成分转移率较低等问题。采用微沉淀法改良自组装过程,即药材经水煎煮后,以适当浓度乙醇提取药渣,水提液和醇提液合并,磁力搅拌后除醇,水煎液和醇提液发生分子识别并在过饱和驱动力下形成自组装纳米粒[16]。该方法有效解决了SAN稳定性差,易聚集及难溶性成分转移率低的问题。本研究通过控制关键形成条件,并进一步应用微沉淀法制备甘草新型自组装纳米粒(novel self-assembled nanoparticles,GN-SAN),考察不同煎煮时间、磁力搅拌转速、磁力搅拌时间、旋转蒸发温度和生药质量浓度对SAN形成的影响,优化最佳GN-SAN工艺。从粒径分布、ζ电位、SAN形态、有效成分转移率等方面,对传统水煎煮形成的甘草SAN(decoction self-assembled nanoparticles,GD-SAN)与GN-SAN进行系统对比研究,进一步探究GN-SAN抗皮炎活性药效,以期为中药天然纳米制剂的发展提供新的思路及见解。
1 仪器与材料
1.1 仪器
BT125D型电子天平,赛多利斯科学仪器(北京)有限公司;98-1-B型电子恒温电热套,天津市泰斯特仪器有限公司;N-1300D型旋转蒸发仪,上海爱朗仪器有限公司;SHB-III型循环水式多用真空泵,郑州长城科工贸有限公司;DZF-6020型真空干燥箱,北京陆希科技有限公司;Lab-1A-50型冻干机,北京博医康实验仪器有限公司;DF101S型集热式恒温加热磁力搅拌器,北京恒丰长伟科技有限公司;TDA-8002型电热恒温水浴锅,余姚市东方电工仪器厂;Nanotrac Wave II型纳米粒度电位仪,美国麦奇克有限公司;LC-2030C 3D Plus型高效液相色谱仪,日本岛津公司;Tecnai G2 F30型场发射高分辨透射电子显微镜(TEM),美国FEI公司;S-4800扫描电子显微镜(SEM),日本日立公司;CBGT-48型高速组织研磨机,上海测博科技有限公司。
1.2 药物与试剂
对照品芹糖甘草苷(批号PS011457)、甘草苷(批号PS012028)、异甘草苷(批号PS020442),质量分数均>98%,成都普思生物科技股份有限公司;对照品甘草酸(批号HP200644F1)、芹糖异甘草苷(批号HR5168W4)、甘草查耳酮A(批号HS1970B1),质量分数均>98%,宝鸡市辰光生物科技有限公司。
甘草购自北京仟草中药饮片有限公司,经空军特色医学中心袁海龙研究员鉴定,为豆科甘草属植物胀果甘草Bat.的干燥根和根茎。1-氯-2,4-二硝基苯,批号GL100072,萨恩化学技术(上海)有限公司;丁酸氢化可的松,批号23011009,天津金耀药业有限公司;卡波姆940,批号20230812,广州佰宇生物科技有限公司;薇婷脱毛膏,批号C261122001,利洁时家化有限公司;小鼠白细胞介素-6(interleukin-6,IL-6,批号AK04JBN85267)、IL-1β(批号PA048H480024)、免疫球蛋白E(immunoglobulin E,IgE,批号PA054RX65181)酶联免疫吸附测定试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(批号KL07J8J64980),武汉伊莱瑞特生物科技股份有限公司。甲醇、乙腈色谱纯,赛默飞世尔科技(中国)有限公司;其他试剂均为分析纯。
1.3 动物
BALB/c小鼠,雄性,体质量18~22 g,SPF级,由斯贝福(北京)生物技术有限公司提供。许可证号:SCXK(京)2019-0010。动物实验伦理经中国人民解放军空军特色医学中心伦理委员会批准,批准号:空特(科研)第2023-98-PJ01。
2 方法与结果
2.1 GD-SAN和GN-SAN的制备
2.1.1 GD-SAN的制备 采用传统煎煮工艺提取GD-SAN。取甘草15 g,打碎成粗粉,加9倍量超纯水,浸泡30 min,回流提取1 h,趁热滤过,滤液迅速放入冷水中搅拌冷却;药渣重复提取1次,趁热滤过;合并2次滤液,减压浓缩至0.2 g/mL,即得GD-SAN。
2.1.2 GN-SAN的制备 采用微沉淀法[16]制备GN-SAN。取甘草15 g,打碎成粗粉,加8倍量超纯水,浸泡30 min,回流提取1 h,趁热滤过。取甘草水提后的药渣,加6倍70%乙醇回流提取1 h,滤过,得醇提液。合并2次提取液,600 r/min、25 ℃条件下磁力搅拌20 min,60 ℃旋转蒸发除醇,并浓缩至0.2 g/mL,即得GN-SAN。
2.1.3 甘草药材溶液的制备 取甘草粉末(过三号筛)约0.2 g,精密称定,置具塞锥形瓶中,精密加入甲醇100 mL,密塞,称定质量,超声处理(功率250 W、频率40 kHz)30 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.2 指标成分检测方法的建立
2.2.1 色谱条件 色谱柱为Inertsil®ODS-3柱(250 mm×4.6 mm,5 µm);流动相为乙腈-0.05%磷酸水溶液,进行梯度洗脱:0~10 min,19%乙腈;10~12 min,19%~20%乙腈;12~21 min,20%~33%乙腈;21~35 min,33%~51%乙腈;35~46 min,51%乙腈;46~50 min,51%~19%乙腈;变波长检测:0~15 min,275 nm;15~30 min,360 nm;30~35 min,250 nm;35~50 min,375 nm;体积流量为1.0 mL/min;柱温为30 ℃;进样量为10 μL。
2.2.2 对照品溶液的制备 精密称定芹糖甘草苷、甘草苷、芹糖异甘草苷、异甘草苷、甘草酸和甘草查耳酮A对照品适量,加入甲醇配制成质量浓度分别为783.0、296.0、148.0、54.5、1 391.0、99.0 µg/mL的混合对照品溶液,4 ℃冰箱冷藏,备用。
2.2.3 供试品溶液的制备 取“2.2.1”项下的GN-SAN溶液0.5 mL,置10 mL量瓶中,加甲醇超声溶解后,定容至刻度,摇匀,过0.22 µm微孔滤膜,即得供试品溶液。
2.2.4 专属性考察 分别取空白甲醇溶液(阴性对照组)、混合对照品溶液、GN-SAN供试品溶液,按“2.2.1”项下色谱条件进样分析,记录色谱图,结果见图1。空白溶液未出现干扰峰,且GN-SAN供试品溶液和混合对照品溶液中各个成分的出峰时间一致,表明该色谱方法专属性良好。
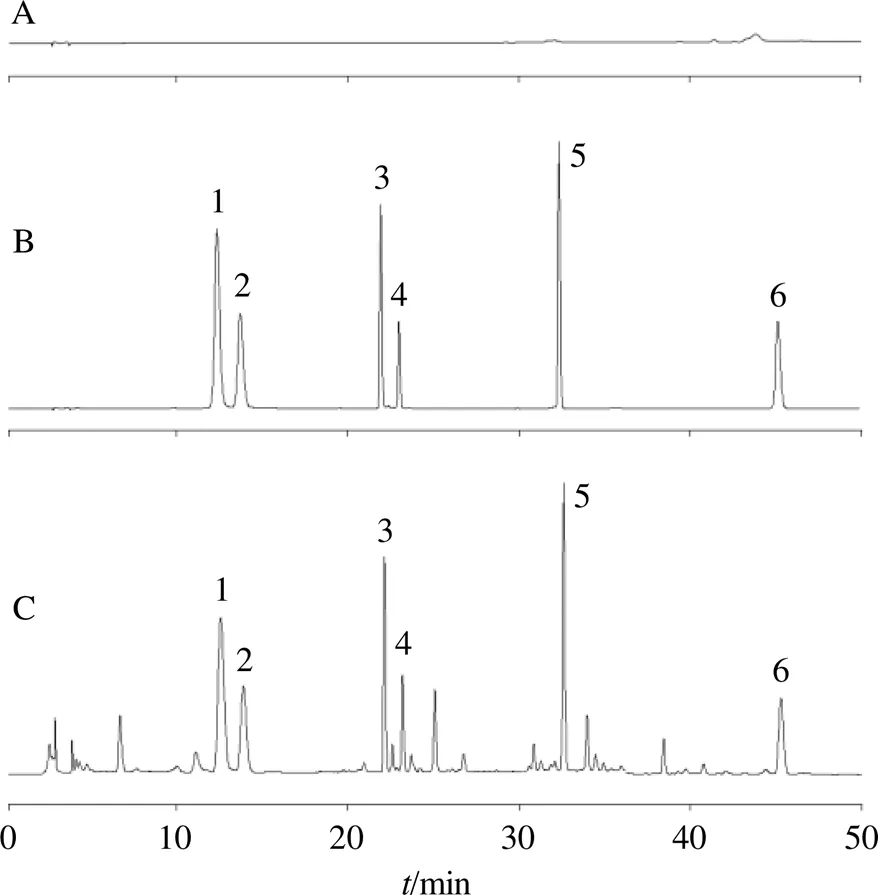
1-芹糖甘草苷;2-甘草苷;3-芹糖异甘草苷;4-异甘草苷;5-甘草酸;6-甘草查耳酮A。
2.2.5 线性关系考察 精密量取“2.2.2”项下制备的混合对照品溶液,等比稀释,加甲醇定容至刻度,摇匀。HPLC进样分析,以峰面积为纵坐标(),各成分的质量浓度为横坐标()绘制标准曲线,进行线性回归,得回归方程:芹糖甘草苷=12 725.0+40 450.0,2=0.999 9,线性范围48.94~783.00 µg/mL;甘草苷=191 861.0+20 573.0,2=0.999 9,线性范围18.50~296.00 µg/mL;芹糖异甘草苷=30 883.0+23 264.0,2=0.999 9,线性范围9.25~148.00 µg/mL;异甘草苷=36 666.0+9 073.5,2=0.999 9,线性范围3.41~54.50 µg/mL;甘草酸=7 847.7-54 818.0,2=0.999 8,线性范围86.94~1 391.00 µg/mL;甘草查耳酮A= 44 516.0+15 686.0,2=0.999 9,线性范围6.19~99.00 µg/mL;结果表明6个成分在各自的质量浓度范围内与峰面积的线性关系良好。
2.2.6 精密度试验 精密吸取质量浓度分别为芹糖甘草苷783.0 µg/mL、甘草苷296.0 µg/mL、芹糖异甘草苷148.0 µg/mL、异甘草苷54.5 µg/mL、甘草酸1 391.0 µg/mL、甘草查耳酮A 99.0 µg/mL的混合对照品溶液,按“2.2.1”项下色谱条件进样分析,平行测定6次,计算得到芹糖甘草苷、甘草苷、芹糖异甘草苷、异甘草苷、甘草酸、甘草查耳酮A峰面积的RSD分别为0.43%、0.41%、0.39%、0.40%、0.39%、0.37%,表明仪器精密度良好。
2.2.7 稳定性试验 精密量取GN-SAN供试品溶液,分别于配制后0、2、4、8、12、24 h,按“2.2.1”项下色谱条件进样分析,测定峰面积,计算得到芹糖甘草苷、甘草苷、芹糖异甘草苷、异甘草苷、甘草酸、甘草查耳酮A峰面积的RSD分别为1.39%、1.35%、1.88%、0.72%、1.36%、1.86%,表明供试品溶液在24h内稳定性良好。
2.2.8 重复性试验 精密量取同一批GN-SAN供试品溶液6份,按“2.2.1”项下色谱条件进样分析,测定峰面积。计算得到芹糖甘草苷、甘草苷、芹糖异甘草苷、异甘草苷、甘草酸、甘草查耳酮A质量浓度的RSD分别为0.94%、0.94%、1.18%、1.19%、1.20%、1.18%,表明该方法重复性良好。
2.2.9 加样回收率试验 精密吸取适量已测定指标成分质量浓度的供试品溶液9份,根据样品中各成分质量浓度的80%、100%、120%的比例加入各对照品,涡旋混合均匀后,按“2.2.1”项下色谱条件进样分析,计算得到芹糖甘草苷、甘草苷、芹糖异甘草苷、异甘草苷、甘草酸、甘草查耳酮A的平均加样回收率分别为101.99%、101.19%、101.33%、101.00%、100.95%、100.29%,RSD分别为0.53%、0.75%、1.64%、0.63%、0.77%、1.18%,表明该方法准确度良好。
2.3 BBD-RSM因素和水平设计(单因素实验)
前期实验表明,甘草用水和乙醇各提取1次,有效成分转移率可达到60%以上,因此固定提取次数各1次,以GN-SAN的平均粒径、多分散指数(polydispersity index,PDI)、ζ电位为评价指标,对甘草煎煮时间、磁力搅拌转速、磁力搅拌时间、磁力搅拌温度、旋转蒸发温度和生药质量浓度进行单因素考察,初步筛选对GN-SAN制备过程中影响较大的实验因素。
2.3.1 煎煮时间的影响 固定磁力搅拌转速600 r/min、磁力搅拌时间20 min、磁力搅拌温度25 ℃、旋转蒸发温度60 ℃和生药质量浓度0.2 g/mL,考察煎煮时间分别为10、20、30、60、90、120 min时对GN-SAN的平均粒径、PDI和ζ电位的影响,结果见表1。可知,不同煎煮时间对SAN的粒径影响较大,在10~60 min内,随着煎煮时间的增加,粒径逐渐减小;60 min之后,煎煮时间越长,粒径越大。当煎煮时间为60 min时,SAN粒径最小,且粒子分布均匀。故选择煎煮时间60 min。
表1 煎煮时间考察(, n = 3)
2.3.2 磁力搅拌转速的考察 固定煎煮时间为60 min,磁力搅拌时间20 min、磁力搅拌温度25 ℃、旋转蒸发温度60 ℃和生药质量浓度0.2 g/mL,考察磁力搅拌转速为400、600、800 r/min时对GN-SAN的平均粒径、PDI和ζ电位的影响,结果见表2。当磁力搅拌转速从400 r/min增至600 r/min时,粒径和PDI无明显变化,ζ电位增加粒子趋于稳定;继续增加磁力搅拌速度,粒径增加,并且稳定性降低。故选择磁力搅拌转速为600 r/min。
2.3.3 磁力搅拌时间的考察 固定煎煮时间为60 min,磁力搅拌转速600 r/min、磁力搅拌温度25 ℃、旋转蒸发温度60 ℃和生药质量浓度0.2 g/mL。考察磁力搅拌时间为10、20、30 min时对GN-SAN的平均粒径、PDI和ζ电位的影响,结果见表3。当磁力搅拌时间从10 min增至20 min时,平均粒径无明显变化,稳定性增加。但搅拌时间增加至30 min时,较长的搅拌时间破坏了纳米体系的稳定性,导致粒径显著增大,故选择搅拌时间为20 min。
2.3.4 磁力搅拌温度的考察 固定煎煮时间为60 min,乙醇体积分数70%,磁力搅拌转速600 r/min、磁力搅拌时间20 min、旋转蒸发温度60 ℃和生药质量浓度0.2 g/mL。考察磁力搅拌温度为25、50、75 ℃时对GN-SAN的平均粒径、PDI和ζ电位的影响,结果见表4。磁力搅拌温度对粒径和ζ电位都没有显著影响,故选择磁力搅拌温度为25 ℃。
表2 磁力搅拌转速考察(, n = 3)
表3 磁力搅拌时间考察(, n = 3)
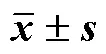
表4 磁力搅拌温度考察(, n = 3)
2.3.5 旋转蒸发温度的考察 固定煎煮时间为60 min,磁力搅拌转速600 r/min、磁力搅拌时间20 min、磁力搅拌温度25 ℃和生药质量浓度0.2 g/mL。考察旋转蒸发温度为40、60、80 ℃时对GN-SAN的平均粒径、PDI和ζ电位的影响,结果见表5。旋转蒸发温度对粒径无显著影响;当旋转蒸发温度从40 ℃增加至60 ℃时,ζ电位明显增大,继续升高温度对ζ电位无显著影响。故选择旋转蒸发温度为60 ℃。
2.3.6 生药质量浓度的考察 固定煎煮时间为60 min,乙醇体积分数70%,磁力搅拌转速600 r/min、磁力搅拌时间20 min、磁力搅拌温度25 ℃和旋转蒸发温度60 ℃。考察生药质量浓度为0.1、0.2、0.3 g/mL时对GN-SAN的平均粒径、PDI和ζ电位的影响,结果见表6。有研究发现[17],中药汤剂中化学成分达到一定质量浓度即临界生药质量浓度时才会聚集形成SAN,当大于临界生药质量浓度时,小分子过度聚集导致粒径增大。由表6可知,当质量浓度为0.2 g/mL时,GN-SAN处于临界生药质量浓度,粒子粒径最小且趋于稳定;继续增大质量浓度,SAN的粒径和PDI都显著增加,并且电位降低,粒子变大且稳定性降低。故选择质量浓度为0.2 g/mL。
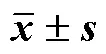
表5 旋转蒸发温度考察(, n = 3)
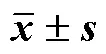
表6 生药质量浓度考察(, n = 3)
2.4 Box-Behnken设计优化实验
2.4.1 Box-Behnken设计实验因素 基于单因素实验结果,选择对GN-SAN制备过程中影响较大的3个因素作为考察因素,分别为煎煮时间(1)、磁力搅拌时间(2)和生药质量浓度(3),以平均粒径(1)和PDI(2)2者作为评价指标,使用Design-Expert V8.0.6软件对数据进行拟合,并验证优化后的工艺。因素与水平见表7。
2.4.2 回归模型方差分析及显著性检验 以Box-Behnken响应面法优化其工艺参数[18],因素水平及实验结果见表7。采用Design-Expert V8.0.6软件进行数学模型拟合。以1和2作为响应值,1、2和3为自变量,建立的2次回归方程为1=188.72+11.761-7.892+14.223-0.9312+8.4013-4.2023+35.1512+29.4022+28.6832,12=0.998 9,adj12=0.997 5,<0.000 1;2=0.16+0.006 151-0.0282+0.0293-0.004 82512-0.000 22513+0.01923+0.04512+0.02622+0.03632,22=0.992 2,adj22=0.982 1,<0.000 1。拟合方程2均大于0.9,由此可证明模型拟合良好。各因素之间具有良好的相关性。自变量与响应值的三维图如图2所示。
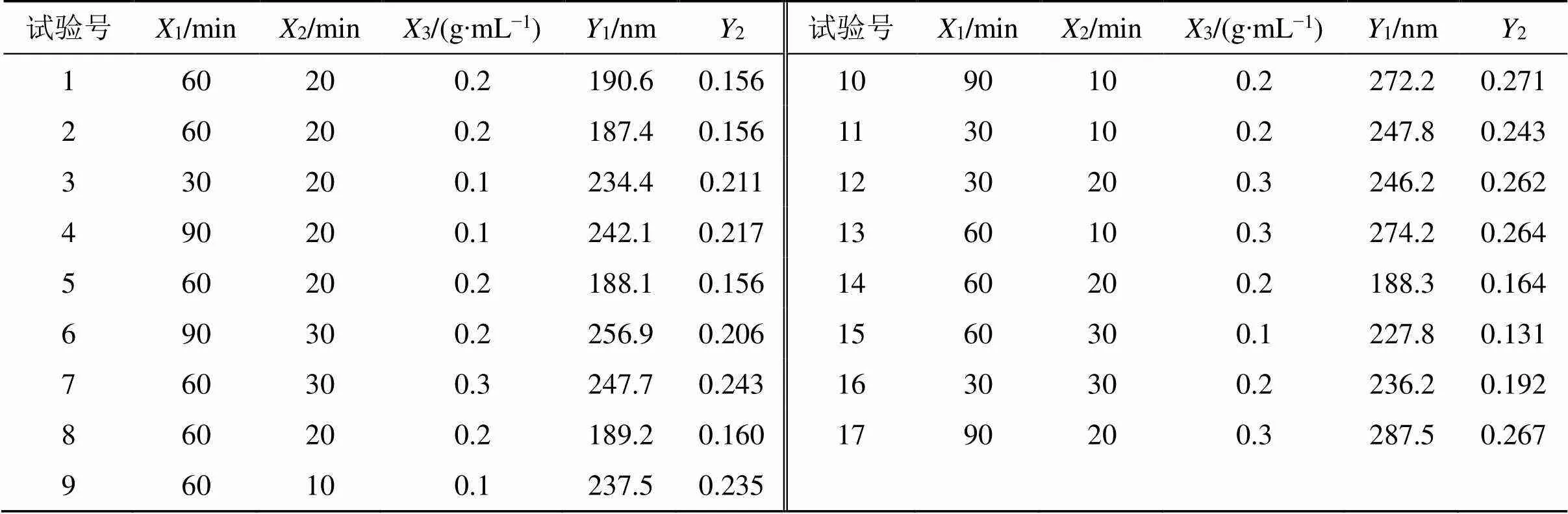
表7 Box-Behnken实验设计和结果
根据Design-Expert V8.0.6实验设计软件综合评价后给出的最佳制备条件:煎煮时间57.35 min,磁力搅拌时间23.07 min,生药质量浓度0.17 g/mL,3批验证试验与模型优选的最佳处方条件,测得GN-SAN的粒径和PDI。
2.4.3 优化处方及验证 为了方便实验操作,根据Design-Expert V8.0.6实验设计软件综合评价后给出的GN-SAN的最佳制备工艺和处方进行相应调整,将最佳工艺参数修正为煎煮时间57 min,磁力搅拌时间23 min,生药质量浓度0.17 g/mL。按照“2.2”项下方法制备最优处方GN-SAN 3批,分别测定GN-SAN平均粒径和PDI,计算偏差[偏差=(预测值-实际值)/预测值],实测值与模型预测值结果见表8,可知实测值和模型预测值比较接近,说明模型预测性良好,可靠性高。
通过单因素分析对制备工艺进行优化,最终得出GN-SAN的最佳制备方法为采用传统煎煮工艺结合微沉淀法优化GN-SAN,取甘草15 g,打碎成粗粉,加8倍量超纯水,浸泡30 min,回流提取1 h,趁热滤过得甘草SAN。取甘草水提后药渣,加6倍70%乙醇回流提取1 h,滤过,得醇提液。合并2次提取液,600 r/min磁力搅拌20 min,60 ℃旋转蒸发除醇并浓缩至0.2 g/mL,即得GN-SAN。
2.5 GD-SAN和GN-SAN的表征
2.5.1 粒径分析 取适量GD-SAN、GN-SAN溶液,加超纯水稀释后,测定平均粒径、PDI及ζ电位。其粒径分布见图3。GD-SAN的粒径平均粒径为(320.5±2.3)nm,PDI为0.116±0.090,ζ电位值为(−20.4±2.8)mV。GN-SAN的粒径分布较为均一,体系较为稳定,平均粒径为(189.5±0.3)nm,PDI为0.138±0.130,ζ电位值为(−31.35±0.80)mV。
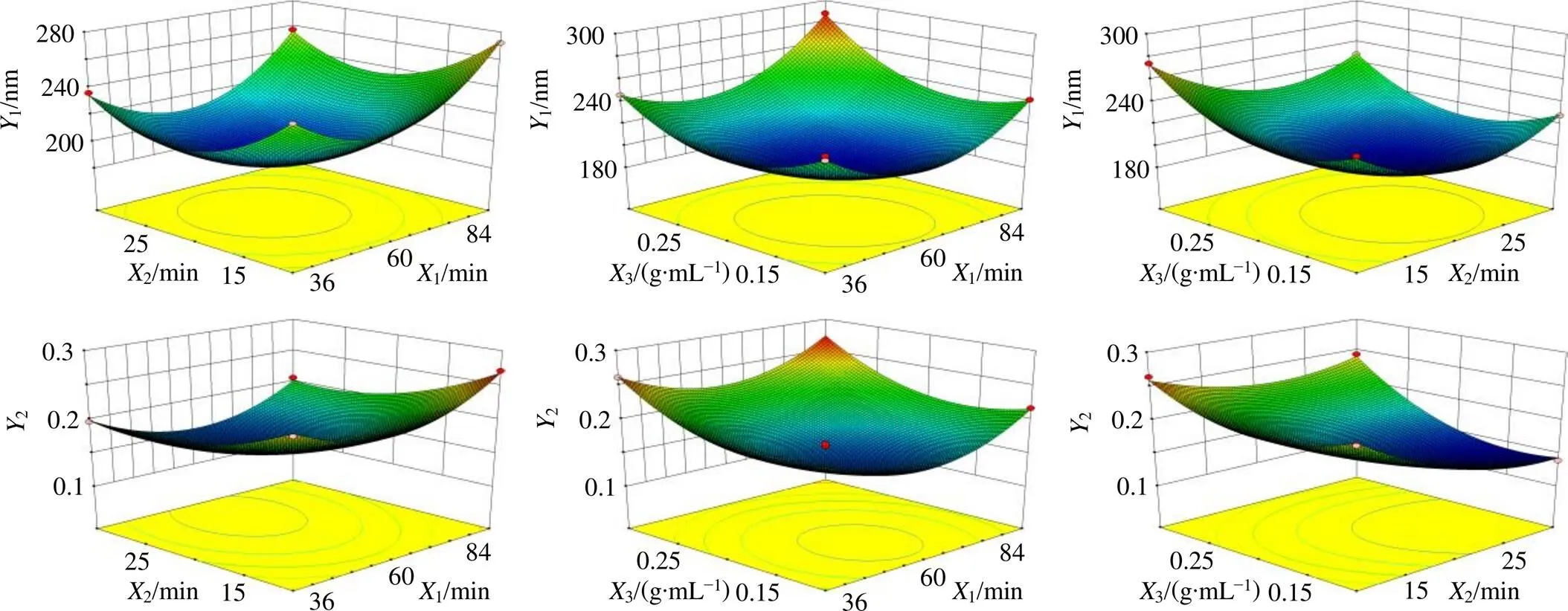
图2 自变量与响应值的三维图
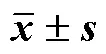
表8 预测值和实际值的比较(, n = 3)
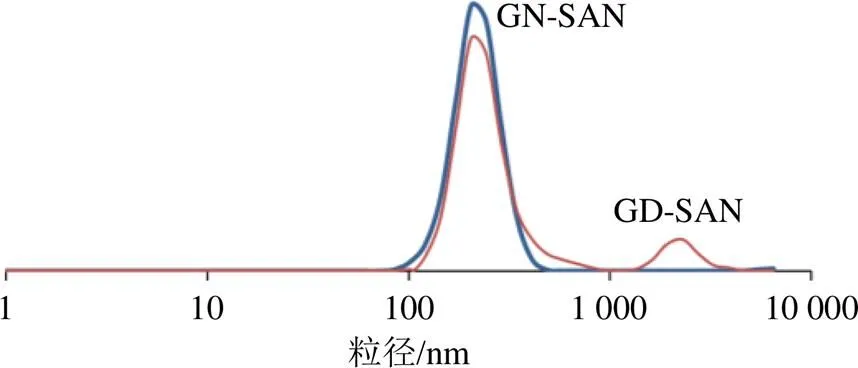
图3 GD-SAN和GN-SAN的粒径分布
2.5.2 SEM形态观察 取适量GD-SAN、GN-SAN溶液,适当稀释后滴于锡箔纸上,室温下自然干燥,喷金处理后,于SEM下观察其形态,结果见图4。
2.5.3 TEM形态观察 取适量GD-SAN、GN-SAN溶液滴于铜网上,用滤纸吸去边缘多余液体,红外灯干燥后TEM观察形态,结果见图5。所制备的GN-SAN粒径在100~300 nm,形态完整,呈规则的圆球形,分布均匀。GD-SAN粒径在200~500 nm,形态也呈规则的圆球形,但有聚集现象。
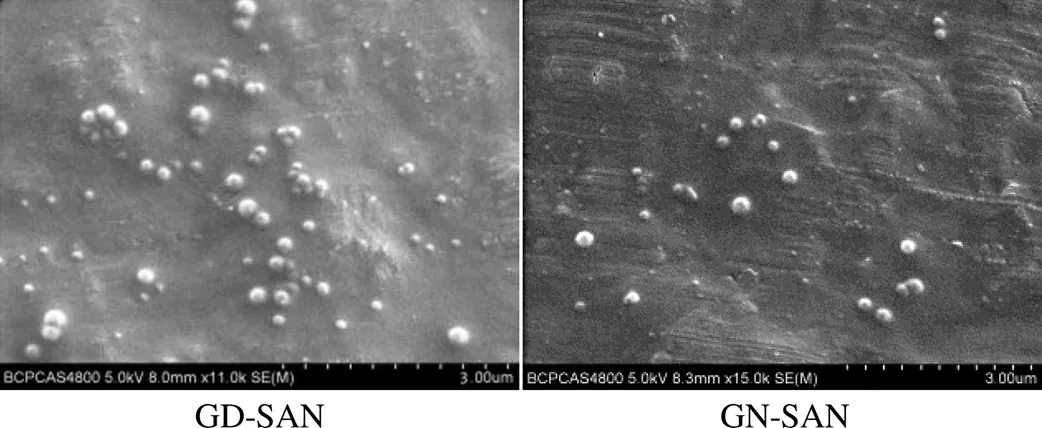
图4 GD-SAN和GN-SAN的SEM图

图5 GD-SAN和GN-SAN的TEM图
2.6 含量测定
2.6.1 小分子活性成分 取按“2.1”项下方法制备的GD-SAN、GN-SAN溶液各0.5 mL,加甲醇定容至10 mL,按“2.2.1”项下HPLC方法测定其中6种活性成分含量,记录色谱图。计算所含活性成分的含量,结果见表9。
2.6.2 蛋白质的含量 使用BCA试剂盒测定汤剂中蛋白类成分的含量。以牛血清白蛋白(bovine albumin,BSA)为标准品,用磷酸盐缓冲液(phosphate buffer solution,PBS)稀释至标准品质量浓度分别为0、0.025、0.05、0.1、0.2、0.3、0.4、0.5 mg/mL。取“2.1”项下制备的GD-SAN、GN-SAN溶液各3份,用PBS稀释10倍,精密吸取20 μL至96孔板,每个样品设置3个复孔。根据对照品孔和样品孔数量,将BCA试剂A和BCA试剂B按体积比为50∶1配制适当体积的工作液,充分混匀,精密吸取200 μL至各标准品孔和样品孔中,37 ℃孵育0.5 h后,562 nm波长下测定吸光度()值,根据值绘制标准曲线,并计算样品中蛋白质含量。
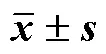
表9 各组分有效成分的含量分析(, n = 3)
按照BCA蛋白浓度测定试剂盒的说明书操作,将10 μL待测样品加入到微孔板中,并用PBS补足到20 μL,向微孔板中加入200 μL工作液,混匀,37 ℃放置30 min,在562 nm波长处测定值,并记录读数;以BSA质量浓度为横坐标(),值为纵坐标(),绘制标准曲线,得到BSA的线性回归方程为=0.788 8+0.122 2;2=0.996 0,线性范围为0.025~1 000 µg/mL。将样品的值代入线性方程,计算GD-SAN、GN-SAN溶液中蛋白含量,结果见表9。
2.6.3 糖类成分的含量 以苯酚-硫酸法测定GD-SAN、GN-SAN中多糖含量[19]。精密称取适量的无水葡萄糖,置25 mL量瓶中,加水溶解并定容,得到质量浓度为103.6 μg/mL的葡萄糖对照品溶液。分别吸取0.1、0.2、0.4、0.6、0.8、1.0 mL对照品溶液至试管中,加蒸馏水补足至1 mL,分别加4%苯酚溶液1 mL,混匀,迅速加入硫酸7 mL,摇匀,40 ℃水浴30 min后,冰水浴5 min,充分摇匀,放置25 min,以不含对照品的溶液为空白,使用紫外分光光度法,在490 nm波长处测定不同质量浓度对照品的值,以对照品质量浓度为横坐标(),值为纵坐标(),绘制标准曲线并计算回归方程。结果葡萄糖的回归方程为=5.700+0.101,2=0.999 8,结果表明葡萄糖在10.36~103.60 μg/mL线性关系良好。
取“2.1”项下制备的GD-SAN、GN-SAN溶液3份,稀释至适宜质量浓度,照标准曲线的制备项下方法,自“加4%苯酚溶液1 mL”起,依法测定值,计算样品的多糖含量,结果见表9。
2.7 转移率测定
取按“2.1”项下制备的GD-SAN、GN-SAN、甘草药材溶液,按“2.2.1”项下HPLC方法测定,计算6种活性成分由甘草药材到GD-SAN、GN-SAN溶液的转移率,结果见表10。
转移率=GD-SAN或GN-SAN中指标成分的含量/甘草药材中指标成分的含量
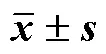
表10 转移率计算结果(, n = 3)
2.8 GN-SAN治疗特应性皮炎小鼠的药效评价
2.8.1 不同质量浓度GN-SAN凝胶的制备 取卡波姆940加水至卡波姆940质量浓度为2%[20],充分溶胀均匀,按“2.2”项下方法分别制备质量浓度为0.1、0.2、0.3 g/mL的GN-SAN溶液加入已溶胀均匀的凝胶体系中,边加边搅拌均匀,滴加三乙醇胺调节值至pH 5.5~6.5,可得低、中、高剂量GN-SAN凝胶样品,平行制备3份。
2.8.2 分组 将经检疫合格的SPF级BALB/c小鼠48只,随机分为6组,每组8只,分别为空白组,模型组,阳性对照(丁酸氢化可的松)组,凝胶低、中、高剂量组。
2.8.3 造模 小鼠经2 d适应性喂养后,建立经典的DNCB诱导特应性皮炎样皮损模型[21]。在实验前一天使用脱毛膏脱去背部毛发(约2 cm×2 cm面积)。空白组小鼠每日在背部皮肤涂抹生理盐水。模型组及各给药组在第1、3天用200 µL 1% DNCB(溶解在3∶1的丙酮和橄榄油的混合物)涂抹小鼠的背部皮肤,在第5、7、9、11、13、15、17、19天采用同法涂抹200 µL 0.5% DNCB基质溶液于小鼠背部相同位置。
2.8.4 给药 根据小鼠与人的剂量换算,GN-SAN凝胶低、中、高剂量0.2 g,丁酸氢化可的松乳膏剂量为0.1 g[22],造模第5天开始给药,空白组背部单位面积涂抹生理盐水,每天1次,连续10 d,隔1 d拍照1次,记录小鼠背部皮肤情况。连续20 d边造模边给药,最后一次给药后,将小鼠脱颈处死。
2.8.5 小鼠背部皮损评分 每天对小鼠背部皮肤拍照留存并按照皮损面积和严重程度(psoriasis area and severity index,PASI)评分标准对皮损部位红斑/出血,干燥、结痂,剥脱/糜烂,水肿4个方面进行评分。PASI评分标准如下:0,无明显症状;1,轻度;2,中度;3,重度。症状评分之和即为皮损严重程度,得分越高,皮损越严重。各组小鼠第20天皮损情况见图6。空白组小鼠皮肤脱毛处毛发生长正常;模型组小鼠致敏皮肤处有红斑、局部水肿并大量结痂、无新生毛发,表明造模成功;阳性对照组小鼠皮肤生长良好,AD样症状消失;GN-SAN凝胶低、中剂量组红肿缓解,有少量出血点、表皮结痂逐渐开始掉落、新生皮肤良好;GN-SAN凝胶高剂量组未见出血,结痂大部分脱落,皮肤水肿缓解;给药组小鼠皮损显著改善,且随着给药质量浓度增大,治疗效果越明显。
各实验组在第2、4、6、8、12、16、18天皮损严重程度评分比较见表11。实验第0天,各组小鼠皮肤正常,评分均为0分。在实验第8天,各组小鼠评分达到最高,明显有炎症症状,说明造模成功。实验第18天,与模型组相比,凝胶组和阳性对照组PASI评分均有所降低(<0.01)。随着剂量增大,凝胶组PASI评分逐渐降低。

图6 各组AD模型小鼠皮损情况
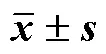
表11 各组小鼠皮损PASI评分比较(, n = 8)
与空白组比较:##<0.01;与模型组比较:**<0.01。
##< 0.01normal group;**< 0.01model group.
2.8.6 小鼠皮损组织病理变化 小鼠脱颈处死后,剪下一半皮损组织,放在4%多聚甲醛中固定,而后经过脱水、石蜡包埋、切片、HE染色,每个标本选3张切片进行观察并拍照。各组鼠染色结果见图7。HE染色结果显示,正常组小鼠皮肤组织结构完整清晰,真皮层无血管扩张及炎症细胞。模型组角质层角化过度,颗粒层明显减少,棘细胞间水肿,棘层肥厚并伴有表皮突起延伸,真皮层可见毛细血管增生和明显炎性细胞浸润现象。氢化可的松阳性对照组表皮层较为完整,少量表皮突起下延,炎性细胞浸润明显减少。SAN各剂量组表皮增厚降低,表皮突起延伸、毛细血管增生、炎性细胞浸润明显减少,且呈现出剂量相关现象。
2.8.7 小鼠血清和织中炎症因子含量测定 小鼠摘眼球取血,血液流尽时脱颈处死小鼠,采集后的全血立即放入离心管中,室温静置30 min后,在相对离心力14000×下离心血样15 min,用移液枪吸取分离上层血清,按照ELISA试剂盒说明书检测IgE的含量。将小鼠余下皮损组织放在试管中置于−20 ℃冰箱中保存。实验前提前取出解冻,称定质量后剪碎,按1∶9加入生理盐水,再往试管中加入钢珠,用组织匀浆机进行破碎,离心后取上清液,采用ELISA法检测其中炎症因子IL-1β、IL-6的含量,结果见表12。由表可知,与空白组相比,模型组小鼠3种炎症因子含量均显著增加(<0.01),说明造模成功。与模型组相比,阳性对照组与凝胶各剂量组炎症因子含量显著降低(<0.01),差异均具有统计学意义。
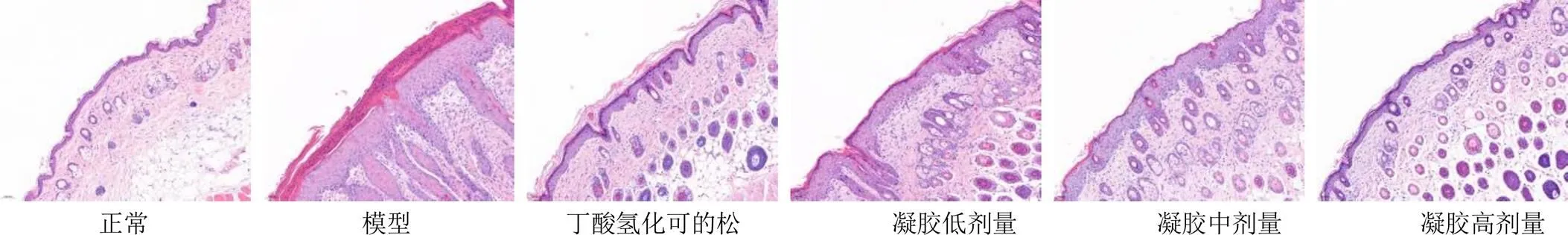
图7 各组小鼠皮损组织病理变化
2.8.8 小鼠脏器指数测定 小鼠称定质量后处死,依次取出脾脏、胸腺并记录其质量,按公式计算脏器指数。各组小鼠脾脏、胸腺指数变化见表12。由表可知,与空白组相比,模型组脾脏指数显著升高(<0.01),说明造模成功;与模型组相比,阳性对照组、SAN凝胶高中低剂量组脾脏指数均显著降低(<0.01)。与空白组相比,模型组胸腺指数显著降低(<0.01);与模型组相比,阳性对照组胸腺指数降低(<0.01),而其余各给药组胸腺指数变化不明显,无统计学意义。
脏器指数=脏器质量/体质量

表12 各组小鼠IgE、IL-1β和IL-6的含量比较及脏器指数变化(, n = 8)
与空白组比较:##<0.01;与模型组比较:**<0.01。
##< 0.01normal group;**< 0.01model group.
3 讨论
中药水煎液中普遍存在自组装聚集体,不仅可发挥生物活性,也可作为天然载体用于药物递送,提高药物的生物利用度,对药效发挥起到重要作用,具有广泛的应用前景。甘草经煎煮后中药化学成分子间发生相互作用,形成甘草SAN,从而发挥增溶、增效的作用,但粒径较大且稳定性不高的问题有待解决。本研究采用微沉淀法改良传统汤剂的自组装过程,系统地对新型纳米粒GN-SAN及传统水煎煮SAN进行了比较,研究表明所形成的新型纳米粒GN-SAN粒径远小于GD-SAN,且大小均一,呈现圆球型结构,其ζ电位高于GD-SAN,稳定性增强。新型纳米粒GN-SAN的有效成分转移率均大于GD-SAN,其中黄酮类小分子成分的转移率显著提升,异甘草苷的转移率在GN-SAN中可达到92.6%,是GD-SAN的1.33倍;甘草查耳酮A的转移率是GD-SAN的7.8倍。新型GN-SAN有效改善了传统汤剂自组装纳米粒粒径大、不稳定以及转移率不高的问题。药效实验显示,与模型组相比,氢化可的松组、SAN凝胶各剂量组PASI评分、炎症因子含量、脾脏指数均显著降低(<0.05)。且SAN组各项指标显示,SAN凝胶高剂量组略优于低、中剂量组。皮损病理变化结果显示,氢化可的松组和SAN各剂量组表皮厚度降低,表皮突起下延、炎性细胞浸润及毛细血管增生减少。可见甘草SAN凝胶对DNCB诱导的特应性皮炎小鼠具有显著的治疗作用,并且有剂量依赖性。本研究在甘草提取物的基础上,改良了传统汤剂自组装过程,优化GN-SAN的制备工艺,提高了中药SAN的稳定性及难溶性成分转移率,对其进行药效学评价及初步作用机制探讨。为中药药效物质基础的高效利用提供了制剂学思路。对于GN-SAN具体的形成机制及体内过程,有待进一步研究。
利益冲突 所有作者均声明不存在利益冲突
[1] Peng A, Lin L Z, Zhao M M. Chemical basis and self-assembly mechanism of submicroparticles forming in chrysanthemum tea infusion [J]., 2023, 427: 136745.
[2] Chen M, Wang P L, Li T,. Comprehensive analysis of Huanglian Jiedu Decoction: Revealing the presence of a self-assembled phytochemical complex in its naturally-occurring precipitate [J]., 2021, 195: 113820.
[3] Zhang C Z, Zhao R, Yan W Q,. Compositions, formation mechanism, and neuroprotective effect of compound precipitation from the traditional Chinese prescription Huang-Lian-Jie-Du-Tang [J]., 2016, 21(8): 1094.
[4] Zheng J, Fan R, Wu H Q,. Directed self-assembly of herbal small molecules into sustained release hydrogels for treating neural inflammation [J]., 2019, 10(1): 1604.
[5] Tian X H, Wang P L, Li T,. Self-assembled natural phytochemicals for synergistically antibacterial application from the enlightenment of traditional Chinese medicine combination [J]., 2020, 10(9): 1784-1795.
[6] Wu J J, Yang Y, Yuan X Y,. Role of particle aggregates in herbal medicine decoction showing they are not useless: Consideringdecoction as an example [J]., 2020, 11(12): 10480-10492.
[7] 沈成英, 朱君君, 戴博, 等. 芍药甘草汤自组装纳米粒的形成及其对白芍主要成分释放和吸收的影响 [J]. 中国中药杂志, 2021, 46(9): 2190-2196.
[8] 秦祉剑, 闫巧, 杭凌宇, 等. 芍药甘草汤自组装纳米粒的分离、表征及抗小鼠银屑病的研究 [J]. 中国中药杂志, 2023, 48(8): 2116-2125.
[9] Ping Y, Li Y P, Lü S W,. A study of nanometre aggregates formation mechanism and antipyretic effect in Bai-Hu-Tang, an ancient Chinese herbal decoction [J]., 2020, 124: 109826.
[10] 武印奇, 吕邵娃, 李英鹏, 等. 白虎汤中纳米相态的分离与表征 [J]. 中华中医药学刊, 2021, 39(12): 121-124.
[11] Ke L J, Gao G Z, Shen Y,. Encapsulation of aconitine in self-assembled licorice protein nanoparticles reduces the toxicity[J]., 2015, 10(1): 449.
[12] 中国药典 [S]. 一部. 2020: 88-89.
[13] Dong L S, Lee J H, Jo E H,. Effects of varying ratios ofand donkey hide gelatin water extracts on dinitrochlorobenzene-induced atopic dermatitis in NC/nga mice [J]., 2023, 15(9): 2094.
[14] Wu Q, Mo X M, Lin Y,. Inhibitory effects of isoliquiritin on an atopic dermatitis model through the CD177/JAK2/STAT pathwayand[J]., 2022, 10(18): 980.
[15] Hou D D, Wang X X, Li S J,. Glycyrrhizic acid suppresses atopic dermatitis-like symptoms by regulating the immune balance [J]., 2022, 21(12): 7090-7099.
[16] 朱煜文, 邓翔, 陈莉, 等. 波棱瓜子新型自组装纳米粒的构建及评价 [J]. 药学学报, 2024, 59(2): 448-454.
[17] Duan D, Doak A K, Nedyalkova L,. Colloidal aggregation and theactivity of traditional Chinese medicines [J]., 2015, 10(4): 978-988.
[18] 刘欣欣, 黄甜甜, 付婧欣, 等. Box-Behnken效应面法优化小豆蔻明纳米混悬剂处方工艺及其体外抗肿瘤活性研究 [J]. 中草药, 2023, 54(5): 1419-1428.
[19] 郭琴. 基于蛋白自组装探讨芍药—甘草药对配伍的物质基础 [D]. 北京: 中国中医科学院, 2022.
[20] 李绍林. 湿疹方微乳凝胶制备及其质量评价的研究 [D]. 广州: 广州中医药大学, 2012.
[21] Kim K M, Kim S Y, Mony T J,.L. alleviates DNCB-induced atopic dermatitis-like symptoms by inhibiting NLRP3 inflammasome-mediated IL-1β in BALB/c mice [J]., 2022, 15(10): 1217.
[22] 尚芸, 张莉, 王强, 等.基于网络药理学探究敦煌芮草膏减轻荨麻疹小鼠皮肤瘙痒的机制 [J]. 中成药, 2023, 45(4): 1339-1344.
Formation of novel self-assembled nanoparticles ofand anti-inflammatory evaluation
MENG Yuting1, 2, XUE Yuye2, LIU Yan1,2, WANG Zhiruo2, GAO Cuiyun2, HANG Lingyu2, YUAN Hailong1, 2
1. School of Pharmacy, Anhui Medical University, Hefei 230032, China 2. Department of Pharmacy, Air Force Medical Center, Air Force Medical University, PLA, Beijing 100142, China
To refine the traditional decoction self-assembly phenomenon, thenovel self-assembled nanoparticles (GN-SAN) were constructed by microprecipitation method, and compared withdecoction self-assembled nanoparticles (GD-SAN) in detail, and to further explore the therapeutic effect of GN-SAN on 2,4-dinitrochlorobenzene (DNCB)-induced atopic dermatitis in mice.GN-SAN was prepared by decoction combined with microprecipitation, and the particle size, PDI and ζ potential were used as evaluation indexes, and the decoction time, magnetic stirring speed, magnetic stirring time, magnetic stirring temperature, rotary steaming temperature and mass concentration of raw materials were optimized by single factor test combined with Box-Behnken design-response surface method, and the optimal prescription process was screened. Compare the optimized GN-SAN with GD-SAN, the morphology of SAN was observed by scanning electron microscopy (SEM) and transmission electron microscopy (TEM), and the contents of small molecule active components (liquiritin apioside, liquiritin, isoliquiritin apioside, isoliquiritin, glycyrrhetinic acid, licochalcone A), polysaccharides and proteins were detected by high-performance liquid chromatography (HPLC), ultraviolet spectrophotometer (UV) and bicinchoninic acid (BCA) kit. DNCB was used to stimulate the dorsal skin of mice, and an atopic dermatitis model was established. The mice were divided into blank group, model group, positive drug group, GN-SAN gel low, medium and high dose groups, and the changes of skin lesions on the back of the mice were observed, and the histopathological changes, inflammatory factor expression, organ index and other indicators of skin lesions were detected.The optimal prescription process of GN-SAN was as follows:was decocted with 8 times the amount of water for 1 h to obtain the GD-SAN. After decoction of 6 times of 70% ethanol for 1 h, the alcohol extract was obtained. Combining the two extracts, stirring magnetically at 600 r/min for 20 min, removing alcohol by rotary evaporation at 60 ℃ and concentrating to 0.2 g/mL to obtain GN-SAN. The formed SAN is a stable spherical nanoparticle with a morphological homogeneous particle size of (189.5 ± 0.3) nm, a polydispersity index of 0.138 ± 0.130, and a ζ potential of (−31.4 ± 0.8) mV. Compared with traditional SAN, the particle size, uniformity, stability and effective component transfer rate were improved, and GN-SAN had a good therapeutic effect on dermatitis.The preparation of GN-SAN by decoction method combined with microprecipitation method is simple and the content of main components is high and stable, and the prepared GN-SAN has excellent performance and significant anti-inflammatory effect, which lays a foundation for the further development and application ofnano-preparations.
Fisch.; self-assembled nanoparticles; Box-Behnken design-response surface method; material basis; atopic dermatitis; antiinflammatory;microprecipitation method; liquiritin apioside; liquiritin; isoliquiritin apioside; isoliquiritin; glycyrrhetinic acid; licochalcone A; polysaccharides; proteins
R283.6
A
0253 - 2670(2024)09 - 2912 - 11
10.7501/j.issn.0253-2670.2024.09.006
2023-11-26
国家自然科学基金面上项目(82174074);国家自然科学基金面上项目(81873092);优秀青年人才项目(22YXQN027)
孟雨婷,硕士研究生,研究方向为中药药剂学。E-mail: uoouooy@163.com
通信作者:袁海龙,研究员,博士生导师,研究方向为中药新型给药系统。E-mail: yhlpharm@ 126.com
杭凌宇,博士,研究方向为中药新型给药系统。E-mail: 445914871@qq.com
[责任编辑 郑礼胜]
