基于网络药理学探讨郁火咳嗽方治疗咳嗽的作用机制
2024-05-14黄学宽
余 娇 黄学宽 王 辉
1.重庆医科大学中医药学院,重庆 400041;2.重庆市北碚区中医院肺病科,重庆 400700
咳嗽(cough)是最常见的呼吸道症状,由于气管、支气管黏膜或胸膜受到炎症、异物、物理或化学刺激等引起,同时也是气管支气管系统独立性疾病、支气管扩张症或间质性肺疾病等的常见症状[1]。郁火咳嗽方是重庆市名老中医王辉教授以小柴胡和四逆散为基础,去人参、大枣,加五味子、苦杏仁、细辛、桃仁、牡丹皮、乌梅、防风创制的。主治咳嗽剧烈、咳甚胸痛呕吐、口干口苦、急躁易怒等。有药理实验表明[2],小柴胡汤作为一种传统中药汤剂,由111个活性成分组成,作用于肿瘤坏死因子(tumor necrosis factor,TNF)、有丝分裂原激活蛋白激酶(recombinant mitogen activated protein kinase,MAPK)14在内的55个靶点,用于治疗肺炎。其中p38(MAPK14)信号通路可以触发树突状细胞(dendritic cells,DC)产生炎症因子,从而通过调节核因子激活的核因子-κB(nuclear factor-kappa B,NF-κB)/MAPK信号通路来减轻肺组织的炎症[3]。在咳嗽患者中,观察到白细胞介素(interleukin,IL)-4和干扰素(interferon,IFN)-γ水平高于正常人。IFN-γ主要由T辅助细胞(T helper cell,Th)1细胞分泌,而IL-4参与白细胞的浸润和募集,加剧了气道阻塞和炎症反应。另一方面,在四逆散中发现白芍的提取物能够促进IL-4的合成与释放[4],同时抑制IL-1β和TNF-α水平,从而显示出抗炎的作用。临床研究证实,小柴胡汤和四逆散在治疗感冒后咳嗽、咳嗽变异型哮喘、支气管哮喘和胃食管返流咳嗽等有着显著效果[5-6]。本文通过网络药理学对郁火咳嗽方治疗咳嗽的作用机制进行预测,为该方治疗咳嗽等呼吸系统疾病做进一步研究与临床应用提供参考。
1 资料与方法
1.1 郁火咳嗽方活性成分及作用靶点筛选
利用中药系统药理学数据库分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)分别对郁火咳嗽方的各味药(黄芩、半夏、白芍、北五味子、柴胡、防风、甘草、苦杏仁、牡丹皮、生姜、桃仁、乌梅、细辛、枳实)进行检索。以生物口服利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18为标准对其进行检索得到的化学成分进行筛选,收集符合以上条件的化合物,使用TargetNet、SwissTargetPrediction数据库,输入其有效成分SMILE结构式,筛选预测分值(Prob)>0.9的结果,保存UniprotID、Protein、Prob信息为EXCEL格式。
1.2 郁火咳嗽方治疗咳嗽潜在靶点预测
以“cough”为关键词在Drughbank、GeneCards、PharmGkb、Therapeutic Target Database (TTD)数据库检索与咳嗽相关的靶点。利用genedenovo (https://www.genedenovo.com/)对郁火咳嗽方的有效成分作用靶点和咳嗽相关靶点取交集,得到郁火咳嗽方治疗咳嗽的潜在靶点。
1.3 预测郁火咳嗽方治疗咳嗽的关键活性成分
利用Cytoscape软件构建“中药-有效成分-疾病靶点”网络图,并进行网络拓扑分析得到郁火咳嗽方治疗咳嗽的关键活性成分。
1.4 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建
将郁火咳嗽方的有效成分作用靶点与咳嗽相关靶点的交集靶点输入STRING 11.0(https://string-db.org/)数据库,设定物种来源“Homo sapie”,勾选“hide disconnected nodes in the network”,构建PPI网络图,去除游离节点后导入Cytoscape软件进行网络拓扑分析,筛选出郁火咳嗽方治疗咳嗽的核心靶点蛋白。
1.5 基因富集分析
将靶点信息导到DAVID(htpps://David.ncifcrf.gov/)数据库,进行基因本体(gene ontology,GO)功能、京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路的富集分析。
2 结果
2.1 郁火咳嗽方的有效成分和作用靶点
在TCMSP中检索得到黄芩、半夏、白芍、北五味子、柴胡、防风、甘草、苦杏仁、牡丹皮、生姜、桃仁、乌梅、细辛、枳实的活性成分分别为33、11、8、8、11、16、86、18、5、4、12、8、7、20种,其中共有成分20种。除去重复的后得到了205种活性成分,共同作用的靶点有200个。见表1。
2.2 确定交集靶点
从Drughbank、GeneCards、PharmGkb、TTD数据库中筛选出与咳嗽的相关靶点有1798个,与郁火咳嗽方的有效成分作用靶点进行对比,交集靶点得到了172个。见图1。

图1 药物-疾病交集靶点图
2.3 成分-靶点网络构建
使用Cytoscape软件绘制郁火咳嗽方的有效成分及其作用靶点间的关系网络图(图2),205种类药成分全部参与,图形大小及明暗程度代表其作用强度,其中作用强度前3位的有效成分分别为山奈酚、刚烯酸、甘草查尔酮B,这些有效成分可能是郁火咳嗽方治疗咳嗽的关键化合物。

图2 中药-有效成分-疾病靶点网络图
2.4 PPI网络构建
将交集靶点上传至STRING 11.0平台,设定最小互相作用阈值为“highest confidence”>0.9,得到79个节点、470条边、平均节点度为11.9的PPI网络(图3)。Degree值较大的基因有细胞色素P4503A4酶(cytochrome P4503A4,CYP3A4)、组蛋白去乙酰化酶(histone deacetylase,HDAC)、雌激素受体1(estrogen receptor 1,ESR1)、核受体视黄醇X受体α(reconmbinant retinoid X receptor α,RXRA)等,说明这些靶点有极大可能是郁火咳嗽方治疗咳嗽的关键靶点。

图3 郁火咳嗽方治疗咳嗽的PPI网络图
2.5 郁火咳嗽方治疗咳嗽基因和功能分析
将郁火咳嗽方治疗咳嗽的关键靶点通过DAVID分析平台进行GO和KEGG分析。GO富集分析包括生物过程(biological processes,BP)、细胞组分(cellular components,CC)、分子功能(molecular functions,MF),见图4~6。Count代表靶点数量,Count越大代表富集的结果越相关。

图4 关键基因BP分析
2.5.1 基因BP分析 对郁火咳嗽方关键基因可能涉及的BP进行分析,从图4可知,这些关键基因涉及各个BP,其中Count值较前的有有机物质代谢过程、对化学物质的反应、生物质量调节、细胞对化学刺激的反应等,这些BP可能在咳嗽中起着至关重要的作用,表明郁火咳嗽方的潜在干预机制。
2.5.2 基因CC分析 通过对关键基因涉及CC的分析,本研究可以推测出郁火咳嗽方干预咳嗽在细胞内的具体作用机制。从图5可知,关键基因CC分析排前五位的有细胞器、膜界细胞器、细胞质、细胞内的细胞器、细胞内膜束缚细胞器,有关这类关键细胞器的研究,对于研究郁火咳嗽方治疗咳嗽作用机制起到了辅助作用。
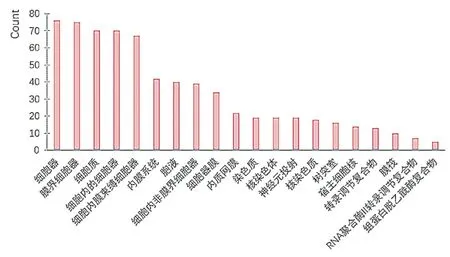
图5 关键基因CC分析
2.5.3 基因MF分析 在机制研究过程中,对于MF的研究尤为重要,因此本研究对关键基因的MF进行了富集分析。从图6可知,Count值排前五位的为离子结合、有机环状化合物、杂环化合物结合、催化活性、阳离子结合,这些分子可能是郁火咳嗽方发挥作用的形式。

图6 关键基因MF分析
2.5.4 KEGG分析 本研究对关键基因信号通路进行富集分析,得到169条相关通路,从图7可以看出,代谢通路(Metabolic pathways)在关键信号通路富集分析中比较靠前,同时也与癌症通路(Pathways in cancer)相关性较强,说明郁火咳嗽方极大可能是治疗肿瘤的潜在药物。在信号通路富集分析中,发现炎症介质、酒精、亚油酸代谢、阿尔茨海默病等通路在研究咳嗽机制中具有重要意义。

图7 前二十位关键通路
3 讨论
本研究对郁火咳嗽方药物有效成分进行筛选,将其有效成分的潜在靶点与咳嗽相关靶点进行比对,以得到交集靶点,利用生物信息学分析,确定关键基因靶点及其通路,并构建成分-靶点网络图。从中药-有效成分-疾病靶点网络图节点推测出主要活性成分,如山奈酚(kaempferol)、刚烯酸(gondoic acid)、甘草查尔酮B(Licochalcone B)、槲皮素(quercetin)、β-谷甾醇(beta-sitosterol)。LI等[7]研究表明,山奈酚可以调节佛波酯(phorbol-12-myristate-13-acetate,PMA)诱导的核因子κB抑制因子α(NF-kappa-B inhibitor alpha,IκBα)降解和NF-κB p65的核转位来抑制气道黏蛋白基因表达和产生的能力。槲皮素作为一种活性氧清除剂,可减少肺部炎症、杯状细胞增多、促炎细胞因子的信使核糖核酸(messenger RNA,mRNA)表达和粘液素5AC,有潜力治疗慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)等肺部疾病[8]。β-谷甾醇是一种中药成分,其抑制中性粒细胞趋化因子IL-8、人生长调节致癌基因α(growth-related oncogene-α,GRO-α)和人生长调节致癌基因β(growth-related oncogene-β,GRO-β)的表达,控制囊性纤维化患者肺部炎症的过度发生[9]。上述中药成分具有多靶点、多条通路协同作用,对于治疗咳嗽具有重要的作用。
对关键靶点及其互作网络的分析表明,CYP3A4、HDAC、ESR1、RXRA、RELA等蛋白处于前排。郁火咳嗽方的主要成分是黄酮类化合物,它能够抑制CYP3A4的活性,可以调节人肝脏药物代谢酶的活性[10-11]。抑制CYP3A4对于增强药物治疗效果、逆转抗肿瘤药物的耐药性等方面是至关重要的[12-14]。肺泡巨噬细胞产生的促炎细胞因子被关键分子HADC所抑制[15]。在动物实验中,HDAC有助于维持Th1/Th2平衡,减少Th2细胞免疫的过度表达,防止Th2细胞相关细胞因子产生,并改善气道炎症。雌激素受体(estrogen receptor,ER)α参与NF-κB转录复合物,抑制NF-κB信号传导,从而限制炎症反应的程度[16],既往研究表明,ER激活后通过环腺苷酸-蛋白激酶A(cyclic adenosine monophosphate-pretein kinase A,cAMPPKA)信号通路降低气道平滑肌中的钙离子浓度,最终导致气道平滑肌的放松[17]。上述诸多基因都可能成为治疗咳嗽的核心基因,为咳嗽的治疗提供临床价值。
对咳嗽疾病及其以咳嗽为主要症状的关键基因进行KEGG信号通路富集分析发现,通路主要与代谢途径、肿瘤和炎症反应等相关。其中最典型代表的是IL-17、瞬间受体电位(transient receptor potential,TRP)、高级糖基化终末产物-受体(advanced glycation end product-receptor,AGERAGE)等信号通路。如IL-17信号通路与其受体结合时,它通过MAPK途径和核转录因子B途径引发促炎细胞因子的作用[18]。为减少中性粒细胞浸润或肺部炎症,血管紧张素转化酶2(angiotensinconverting enzyme 2,ACE2)通过降低信号传导转录激活因子3(recombinant signal transducer and activator of transcription 3,STAT3)通路的活性来限制IL-17信号通路的传递,这对于治疗肺部疾病至关重要[18]。TRP通路家族成员中,包括辣椒素受体1(transient receptor potential V1,TRPV1)、瞬间受体电位离子通道(transient receptor potential A1,TRPA1)、冷刺激瞬时电位受体第8亚型(transient receptor potential M8,TRPM8),已被证实可以介导和调节咳嗽。在支气管C纤维表达中,TRPM8和TRPA1可能是关键离子通道,是通过激活颈静脉传入纤维引起的咳嗽[19]。此外,有研究表明,TRPV1在肺传入神经中的表达和功能上调是慢性咳嗽、哮喘以及各种肺部炎症的共同特征,这种上调导致TRPV1通道对刺激的敏感性增加,进而导致咳嗽、疼痛、痒、呼吸困难和神经源性炎症等症状的出现[20]。
综上所述,本研究通过对郁火咳嗽方中所有中药进行化合物的分析,以确定其主要成分,研究数据分析结果显示,其主要成分是黄酮类化合物,它已被证实有可能影响与炎症有关的信号传导途径。通过预测这些化合物的生物活性、靶点来探讨治疗咳嗽的作用机制。证实了中药复方郁火咳嗽方能有效地针对促炎因子信号通路来治疗咳嗽,与此同时,抗炎症因子在一定程度上可以激活机体免疫系统,抑制肿瘤细胞的生长和扩散。因此,可以进一步探讨这些化合物抑制炎症细胞表达的能力。虽然,网络药理学存在部分数据库不全等局限性,但是它可以帮助挖掘中药的潜在药效和新药物,为新药物的开发提供新的思路,对中医发展具有重要的促进作用。
