罗汉松种子总黄酮的抗炎作用研究
2024-05-14黎晶晶黄增琼
黎晶晶 黄增琼
1.广西医科大学第八附属医院 贵港市人民医院儿童诊疗中心综合办公室,广西贵港 537100;2.广西医科大学药学院,广西南宁 530021
一直以来,普遍、反复发作却无法彻底治愈的炎症严重影响人们的身体健康和生活质量,临床常用非甾体类抗炎药和糖皮质激素类药物对症治疗,药效明显但副作用较多,因此开发安全、高效的天然药物显得尤为重要。国内外许多学者深入研究了各类植物黄酮,发现从山蜡梅叶、香椿叶中提取的黄酮类化合物均有抗炎镇痛作用[1-2]。现代药理学研究也表明,植物黄酮类化合物具有抗氧化、抗炎、抗菌等多种药理活性[3-4],且毒性较低,对炎症的治疗和预防具有重要意义[5]。
罗汉松为罗汉松科植物,广西地区常见[6]。罗汉松实为罗汉松和短叶罗汉松的种子及花托[7],但药用部位主要为种子[8]。罗汉松实所含成分主要包括黄酮类、萜类等化合物,刘欣宇等[9]从罗汉松实中可提取到4.66%的总黄酮,说明罗汉松种子总黄酮含量丰富,具有重要药用价值,但目前国内外对罗汉松种子总黄酮的抗炎作用研究尚无相关报道。本研究通过建立角叉菜胶致小鼠足肿胀、二甲苯致小鼠耳肿胀、脂多糖(lipopolysaccharide,LPS)诱导小鼠致炎三种急性致炎实验模型,探讨罗汉松种子总黄酮在小鼠体内的抗炎作用及部分作用机制,为后续罗汉松种子的药用价值研究提供参考。
1 材料
1.1 试剂及药品
试剂:罗汉松种子(采自广西北海鑫意园罗汉松种植基地,经广西医科大学药学院生药学教研室李琼讲师鉴定);二甲苯(分析纯,批号:20211025,天津奥普升化工有限公司);LPS(来源大肠杆菌055:B5,批号:22012183,南宁市辛佰生物试剂经营部);0.5%羧甲基纤维素钠(sodium carboxymethylcellulose,CMCNa)和吐温80溶液;酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)试剂盒(北京诚林生物科技有限公司)。
药品:阿司匹林肠溶片(规格:100 mg×36片/盒,生产批号:21150803,沈阳奥吉娜药业有限公司)。
1.2 仪器及材料
JY1002型电子天平(上海衡平仪器仪表厂);DFY-200A型万能粉碎机(无锡久平仪器有限公司);Gary3500型紫外可见分光光度计(美国安捷伦);BSA224S型万分之一分析天平(赛多利斯科学仪器北京有限公司);YLS-25A型电动耳肿打耳器(济南益延科技发展有限公司);TDZ4-WS型台式低速离心机(长沙高新技术产业开发区离心机仪器有限公司);HH-2型电热恒温水浴锅(京科伟永兴仪器有限公司);SynergyH1型多功能酶标仪(南宁市精密仪器仪表有限公司)。
1.3 实验动物
选取体重为18~22 g的SPF级昆明小鼠180只,雌雄各半,购于广西医科大学动物实验中心,生产许可证号:SCXK桂2020-0003,使用许可证号:SYXK桂2020-0004,购买后适应性喂养7 d,用于实验。
2 实验方法
2.1 罗汉松种子总黄酮提取物的制备和给药剂量的确定
2.1.1 罗汉松种子总黄酮提取物的制备 经鉴定后的罗汉松种子,粉碎后用乙醇回流法提取(提取工艺条件:65%乙醇、料液比1∶14、提取40 min、提取3次)罗汉松种子总黄酮,得提取物干粉末,通过液相色谱和质谱检测确定提取物主要含黄酮类化合物,再用紫外可见分光光度法测定总黄酮含量为71.77%。
2.1.2 给药剂量的确定 罗汉松种子总黄酮提取率:0.86%;KA为人的公斤体重系数,KA=0.11;KB为小鼠公斤体重系数,KB=1。
人的用量DA=20 g×14.42%×5.94%/70 kg=2.45 mg/kg。
小鼠公斤体重剂量DB=DA×(KB/KA)=2.45×(1/0.11)=22.27 mg/kg。
为了增强小鼠体内效果,确定罗汉松种子总黄酮低剂量组为60 mg/kg、高剂量组为180 mg/kg。提取物用0.5% CMC-Na和吐温80配置成罗汉松种子总黄酮60、180 mg/kg的药液,用于灌胃。同时设空白对照组(0.5%CMC-Na和吐温80)和阿司匹林组(阿司匹林200 mg/kg)[10]。
2.2 角叉菜胶致小鼠足肿胀实验
取小鼠40只,雌雄各半,按“2.1.2”项随机分为4组,每组各10只,分别灌胃给药,给药1次/d,连续7 d。末次给药1 h后,在小鼠右后肢足跖皮下注射0.1 ml角叉菜胶致炎,左足不注射作为正常对照。致炎1 h后,颈椎脱臼处死小鼠,从小鼠膝关节处剪下左右两足,用万分之一分析天平称重。右足与左足的重量差为肿胀度,计算小鼠足肿胀抑制率。
足肿胀抑制率=(空白对照组平均足肿胀度-给药组平均足肿胀度)/空白对照组平均足肿胀度×100%。
2.3 二甲苯致小鼠耳肿胀实验
取小鼠50只,雌雄各半,按“2.1.2”项和模型组(生理盐水组)随机分成5组,每组各10只,分别灌胃给药,1次/d,连续7 d。末次给药1 h后,在小鼠右耳双面均匀涂抹0.02 ml二甲苯致炎,左耳不涂抹作为正常对照。致炎3 h后,自小鼠眼眶取血,收集于离心管中,置于3000 r/min离心机离心30 min后分离血清,用ELISA法测定血清中白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-8(interleukin-8,IL-8)含量。取血后,颈椎脱臼处死小鼠,剪下双耳,用6 mm打孔器于小鼠左右耳对称处打下耳片,用万分之一分析天平称重。小鼠右耳与左耳的重量差为肿胀度,计算小鼠耳肿胀抑制率[11]。
耳肿胀抑制率=(空白对照组平均耳肿胀度-给药组平均耳肿胀度)/空白对照组平均耳肿胀度×100%。
2.4 LPS诱导小鼠致炎实验
取50只昆明小鼠,雌雄各半,按“2.1.2”项和模型组(LPS组)随机分成5组,雌雄各半,每组10只,分别灌胃给药,1次/d,连续7 d。末次给药30 min后,除空白对照组外,其余各组均腹腔注射LPS(5 mg/kg),致炎6 h后,自小鼠眼眶取血,收集于离心管中,置于3000 r/min离心机离心30 min后分离血清,用ELISA法测定肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)和白细胞介素-10(interleukin-10,IL-10)含量。
2.5 统计学处理
实验数据使用SPSS 25.0统计学软件进行处理分析,计量资料以均数±标准差()表示,采用单因素方差分析法分析,包括方差齐性,P< 0.05为差异有统计学意义,P< 0.01为差异有显著统计学意义。
3 结果
3.1 对角叉菜胶致小鼠足肿胀的影响
阿司匹林组的小鼠足肿胀度低于空白对照组,差异有统计学意义(P< 0.05),罗汉松种子总黄酮低、高剂量组小鼠足肿胀度与空白对照组相比较低,但差异无统计学意义(P> 0.05)。见表1。
表1 对角叉菜胶致小鼠足肿胀的影响比较()

表1 对角叉菜胶致小鼠足肿胀的影响比较()
注 与空白对照组比较,*P < 0.05;“-”表示无数据
组别n剂量(mg/kg)肿胀度(mg)肿胀抑制率(%)空白对照组10-88.22±35.06-阿司匹林组1020073.79±20.03*16.36罗汉松种子总黄酮低剂量组106077.04±35.9112.67罗汉松种子总黄酮高剂量组1018075.44±29.2714.49
3.2 对二甲苯致小鼠耳肿胀的影响
阿司匹林组和罗汉松种子总黄酮高剂量组小鼠耳肿胀度明显低于空白对照组,差异有显著统计学意义(P< 0.01);罗汉松种子总黄酮低剂量组小鼠耳肿胀度与空白对照组比较,差异无统计学意义(P> 0.05),但高于阿司匹林组,差异有统计学意义(P< 0.05)。见表2。
表2 对二甲苯致小鼠耳肿胀的影响比较()
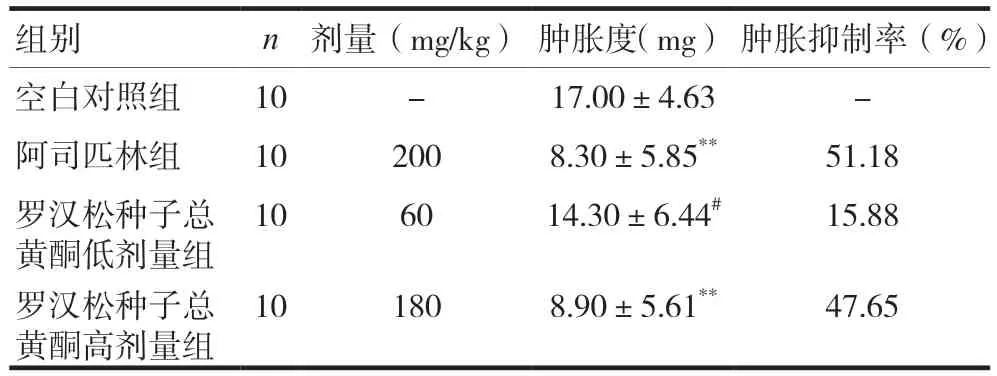
表2 对二甲苯致小鼠耳肿胀的影响比较()
注 与空白对照组比较,**P < 0.01;与阿司匹林组比较,#P < 0.05;“-”表示无数据
组别n剂量(mg/kg)肿胀度(mg)肿胀抑制率(%)空白对照组10-17.00±4.63-阿司匹林组102008.30±5.85**51.18罗汉松种子总黄酮低剂量组106014.30±6.44#15.88罗汉松种子总黄酮高剂量组101808.90±5.61**47.65
罗汉松种子总黄酮低、高剂量组以及阿司匹林组与空白对照组、模型组IL-1β比较,差异无统计学意义(P> 0.05);罗汉松种子总黄酮低、高剂量组IL-8明显高于空白对照组和阿司匹林组,差异均有统计学意义(P< 0.05),但与模型组比较,差异无统计学意义(P> 0.05),而阿司匹林组IL-8低于模型组,差异有统计学意义(P< 0.05)。见表3。
表3 对小鼠血清中IL-1β和IL-8水平的影响()

表3 对小鼠血清中IL-1β和IL-8水平的影响()
注 与空白对照组比较,**P < 0.01;与模型组比较,△△P < 0.01;与阿司匹林组比较,##P < 0.01;IL-1β:白细胞介素-1β;IL-8:白细胞介素-8;“-”表示无数据
组别n剂量(mg/kg)IL-1β(pg/ml)IL-8(pg/ml)空白对照组10-76.34±11.58428.75±244.94模型组10-82.84±5.652091.00±373.12**阿司匹林组1020075.30±15.701258.75±198.08**△△罗汉松种子总黄酮低剂量组106081.24±4.092045.00±284.47**##罗汉松种子总黄酮高剂量组1018080.68±11.241933.13±352.55**##
3.3 对LPS诱导小鼠致炎的影响
罗汉松种子总黄酮低、高剂量组TNF-α与空白对照组比较,差异无统计学意义(P> 0.05),均低于模型组,差异有统计学意义(P< 0.05),均高于阿司匹林组,但差异无统计学意义(P> 0.05);罗汉松种子总黄酮低、高剂量组IL-6与空白对照组、阿司匹林组比较,差异无统计学意义(P> 0.05),但明显低于模型组,差异有统计学意义(P< 0.05);罗汉松种子总黄酮低、高剂量组IL-10与空白对照组比较,差异无统计学意义(P> 0.05),但明显高于模型组,差异有统计学意义(P< 0.05),也均高于阿司匹林组,但罗汉松种子总黄酮低剂量组比较,差异无统计学意义(P> 0.05),高剂量组的差异有统计学意义(P< 0.05)。见表4。
表4 对LPS诱导小鼠致炎的影响()
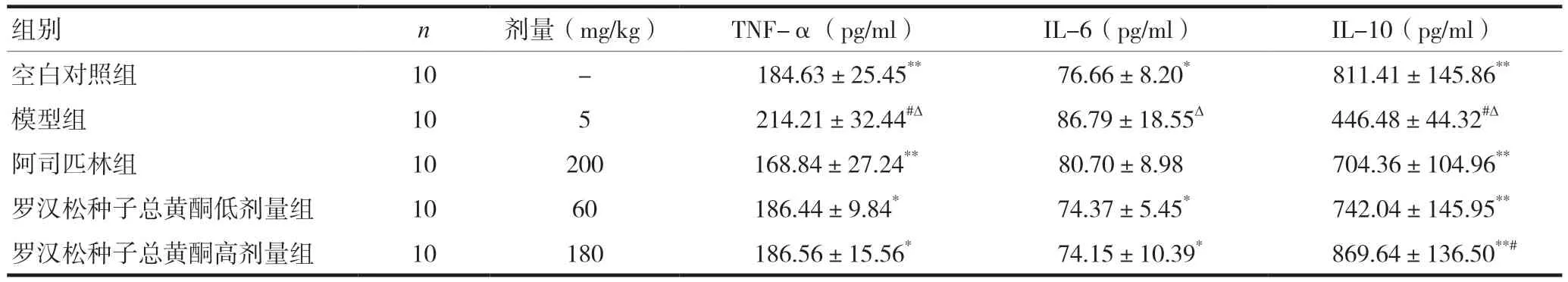
表4 对LPS诱导小鼠致炎的影响()
注 与空白对照组比较,ΔP < 0.05;与模型组比较,*P < 0.05、**P < 0.01;与阿司匹林组比较,#P < 0.05;TNF-α:肿瘤坏死因子α;IL-6:白细胞介素-6;IL-10:白细胞介素-10;“-”表示无数据
组别n剂量(mg/kg)TNF-α(pg/ml)IL-6(pg/ml)IL-10(pg/ml)空白对照组10- 184.63±25.45** 76.66±8.20* 811.41±145.86**模型组105 214.21±32.44#Δ 86.79±18.55Δ446.48±44.32#Δ阿司匹林组10200 168.84±27.24**80.70±8.98 704.36±104.96**罗汉松种子总黄酮低剂量组1060186.44±9.84* 74.37±5.45* 742.04±145.95**罗汉松种子总黄酮高剂量组10180 186.56±15.56* 74.15±10.39* 869.64±136.50**#
4 讨论
炎症病理机制复杂,涉及多种机制和炎性介质[12],如IL-1β、IL-8、TNF-α和IL-6等可促进炎症发生,而IL-10等能对抗致炎作用[13]、促进组织修复。角叉菜胶、二甲苯和LPS均能引发小鼠急性炎症[14-15]。本研究中,罗汉松种子总黄酮低、高剂量组和阿司匹林组对角叉菜胶致小鼠足肿胀的抑制率相近,但高剂量组对二甲苯致小鼠耳肿胀的抑制效果与阿司匹林组相差不大,罗汉松种子总黄酮低剂量组相对较差,说明罗汉松种子总黄酮对小鼠足、耳肿胀有一定抑制效果,具有抗炎作用,且随剂量增加而增强。另外,分析ELISA法检测小鼠血清IL-1β、IL-8、TNF-α、IL-6和IL-10水平结果提示,罗汉松种子总黄酮对血清IL-1β和IL-8无明显影响,但能明显降低血清TNF-α、IL-6含量和升高IL-10含量,这可能与其抗炎作用有关。
综上所述,本研究通过角叉菜胶致小鼠足肿胀、二甲苯致小鼠耳肿胀、LPS诱导小鼠致炎三种急性致炎实验模型探讨罗汉松种子总黄酮抗炎作用及部分可能作用机制,方法准确可靠、重复性好,能为罗汉松种子的抗炎药用价值研发提供研究基础。
