第一性原理研究硼掺杂氧化石墨烯对过氧化锂氧化反应的催化机理*
2024-05-13雷雪玲朱巨湧柯强欧阳楚英
雷雪玲 朱巨湧 柯强 欧阳楚英
(江西师范大学物理与通信电子学院,南昌 330022)
锂-氧电池由于高能量密度在后锂离子电池中脱颖而出,而放电产物过氧化锂缓慢的氧化反应降低了电池的循环性能.因此,提高过氧化锂氧化反应动能、降低充电过电位对于实现高能量密度的可逆锂-氧电池具有重要意义.本文通过第一性原理计算,对比研究了氧化石墨烯(GO)和硼掺杂氧化石墨烯(BGO)对过氧化锂小团簇(Li2O2)2 氧化反应的催化机理.结果表明,从(Li2O2)2 团簇转移到GO 和BGO 上的电荷分别为0.59 e和0.96 e,B 掺杂提高了电荷转移.4 电子反应过程表明,(Li2O2)2 团簇倾向于Li-O2-Li 分解路径,在GO 和BGO上反应的速率决定步均是第三步去锂.在平衡电位下,GO 和BGO 的充电过电位分别是0.76 V 和0.23 V,B 掺杂大大降低了锂-氧电池充电过电位.机理分析表明B 与O 对(Li2O2)2 团簇起到了协同催化的作用.
1 引言
为了满足日常生活中日益增长的储能需求,人们需要探索具有高能量密度的新型动力电池[1].在各种后锂离子电池中,如钠离子电池[2-4]、锂-硫电池[5]等,能量密度高、成本低又环保的锂-氧电池被认为有希望成为锂离子电池的替代者[6-9].典型的锂-氧电池由空气阴极(活性氧)、高能量密度的锂金属阳极和高离子电导率的电解质组成,通过简单的氧化还原反应2Li+O2↔Li2O2(2.96 V vs Li/Li+)实现电池循环[10].锂-氧电池独特的反应使其能量密度超过3500 W·h/kg,远超最先进的锂离子电池和其他商用电池[11].对于典型的锂-氧电池,充电-放电机理已经非常清楚,固态过氧化锂被认为是反应的最终产物[12].放电过程,金属锂氧化为Li+离子并释放电子,氧气得到从外电路来的电子而被还原,在阴极发生氧还原反应(ORR),形成过氧化锂.充电过程则相反,过氧化锂被氧化,释放氧气,在阴极发生析氧反应(OER)[13].因此,放电产物过氧化锂的形成和分解直接决定着锂-氧电池的循环性能[14].
理论计算表明纯的过氧化锂是带隙为4.91 eV的绝缘体[15].绝缘性质限制了电子在过氧化锂里的迁移和电子从过氧化锂到阴极材料的转移,导致锂-氧电池倍率性能下降[16].实际上,过氧化锂由于其绝缘性很难被氧化,氧化反应动能缓慢,充电过电位高.高过电位容易引起电解质和阴极材料不稳定等副反应[17-19].因此,为了提高锂-氧电池的能效和循环性能,研究充电过程过氧化锂的氧化反应非常重要[20].为了提高过氧化锂氧化反应的动能,人们设法提高阴极催化剂的催化活性.在众多锂-氧电池阴极催化剂中,如过渡金属氧化物MnO2[21,22]和Co3O4[23-26]、贵金属Pt[27],Au[12,28]和Ru[29,30]等,石墨烯基催化剂由于其比表面积大而备受关注[31-33].研究发现石墨烯和N 掺杂的石墨烯有很多活性电子,可以作为锂-氧电池的ORR 催化剂[34-36].而对于OER,过氧化锂需要转移电荷到催化剂表面氧化为氧气.因此,B 掺杂的石墨烯由于其p 型行为有望作为过氧化锂OER 的候选催化剂[37].而且,实验上发现B 原子可以掺杂到石墨烯的碳晶格位,形成C=B 共价键[37,38].Ren等[39,40]研究表明硼掺杂石墨烯能够提高从过氧化锂到催化剂的电荷转移,降低过氧化锂OER 中的速率决定步势垒.我们以前的研究发现硼掺杂石墨烯能够促进过氧化锂分子的氧化[41].另外,相对于纯的石墨烯,氧化石墨烯能够增强其与过氧化锂和超氧化锂分子的相互作用,而且随着氧化浓度的升高,从过氧化锂和超氧化锂分子向氧化石墨烯催化剂转移的电荷增加[32].更为重要的是在实际应用中,纯的完美石墨烯很难制备,常见的是氧化石墨烯或还原氧化石墨烯[30,42].因此,本文利用第一性原理计算系统研究了B 掺杂氧化石墨烯作为锂-氧电池阴极催化剂对过氧化锂OER 的催化机理,分析了B 原子、O 原子和C 原子对过氧化锂氧化反应的协同催化作用.
本工作利用第一性原理计算系统研究了硼掺杂氧化石墨烯的几何结构和电子性质,对比研究了二聚体过氧化锂小团簇(Li2O2)2分别在氧化石墨烯和硼掺杂氧化石墨烯上的吸附结构、吸附强度和电荷转移,对比分析了过氧化锂小团簇分别在氧化石墨烯和硼掺杂氧化石墨烯上的最优解离路径、吉布斯自由能、速率决定步和过电位.结果发现B 掺杂能大幅度提高从过氧化锂到催化剂的电荷转移,而且在4 电子氧化反应中,B 掺杂能大大降低充电过电位.
2 计算方法
本文采用第一性原理计算软件VASP[43]完成,离子实与价电子的相互作用采用投影缀加平面波描述[44],电子与电子的交换关联采用广义梯度近似下的Perdew-Burke-Ernzerhof 泛函描述[45].石墨烯模型采用6×6×1 的超胞,包含72 个碳原子,晶格常数为 14.76 Å,真空层为30 Å.布里渊区积分采用Monkhorst-Pack 型网格[46],k点取值为2×2×1.态密度计算采用四面体展宽方法(ISMEAR=-5).平面波基组展开的截止能量为520 eV,力和总能量的收敛判据分别为0.02 eV/Å和10-4eV/atom.所有计算均考虑了自旋极化.计算过氧化锂小团簇吸附时采用DFT-D3[47]方法修正范德瓦耳斯相互作用.为了方便描述,文章中氧化石墨烯用GO 表示,硼掺杂氧化石墨烯用BGO 表示.
3 结果与讨论
3.1 硼掺杂氧化石墨烯的几何结构和电子性质
图1 给出了硼掺杂氧化石墨烯(BGO)的几何结构和电子性质.为了对比,图1 同样给出了氧化石墨烯(GO)的几何结构和电子结构.由图1(a)可以看出,对于GO,氧原子位于两个相邻碳原子的桥位,C—O 键长1.467 Å,局域氧化构型与文献[32,48]报道一致.图1(c)显示GO 打开了石墨烯的带隙(0.2 eV),C1 与C2 的电子态密度简并在一起.在-1.0 eV 附近及以下,O 原子与C1 和C2 原子的电子态密度重叠.图1(b)给出了硼掺杂氧化石墨烯的最低能量结构.引入硼原子后,氧原子位于碳原子和硼原子的桥位,硼原子突出石墨烯表面与氧原子成键,B—O 键长1.444 Å,C1—O 键长1.395 Å,B—C2/C3 键长1.510 Å.图1(d)显示硼原子掺杂后,BGO 的费米能级下移,体系出现金属性质,原因可能是硼原子比碳原子少电子,硼原子替换碳原子,使占据的电子态减少.金属性说明BGO 的电导率高,更有利于电子传输,BGO 更适合作为锂-氧电池阴极材料.而且,C2 与C3 的电子态密度完全简并.在-0.8 eV 附近及以下,O 原子与C1 原子和B 原子的电子态重叠,B 原子还与C2/C3 原子的电子态重叠.更为重要的是,在费米能级以下,相比GO,硼掺杂不仅增加了碳与硼对电子态的贡献,还提高了氧的电子态密度,这更有利于其与过氧化锂分子反应,增强活性位点的催化活性.另外,GO 和BGO的电子态密度均为自旋非极化,磁矩为零.
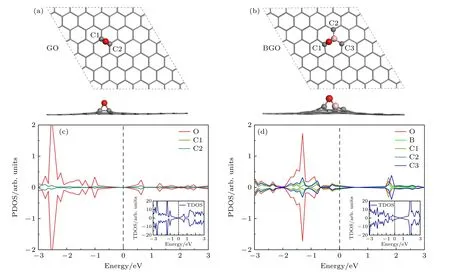
图1 氧化石墨烯和硼掺杂氧化石墨烯的几何结构和电子性质(a),(b)几何结构,灰色、红色和粉色小球分别代表C,O 和B 原子;(c),(d)电子性质,C1,C2 和C3 与结构图中相一致,图中插入的是总态密度Fig.1.Geometric structure and electronic properties of oxide graphene (GO) and B doped oxide graphene (BGO): (a),(b) Geometric structures,grey,red and pink balls represent the C,O and B atoms,respectively;(c),(d) electronic properties,C1,C2 and C3 are consistent with those in the geometric structures,the insert is total density of states (TDOS).
为了进一步分析硼掺杂对氧化石墨烯电子结构的影响,图2 为硼掺杂前后氧化石墨烯的电荷密度差分和局域电子密度.由图2 可以看出氧原子获得电荷,硼原子失去电荷.Bader 电荷分析表明对于GO,C1 与C2 分别失去+0.33 e 和+0.30 e,O原子得到-0.80 e.对于BGO,C1 失去+0.35 e,C2 与C3 分别得到-0.57 e 和-0.56 e,B 原子失去+1.97 e,O 原子得到-1.24 e.可见硼原子掺杂不仅使氧原子得到更多的电荷,还使相邻的碳原子也得到电荷.电子局域密度分析表明相对于GO,BGO 的硼原子周围形成了缺电子活性中心,这将有利于过氧化锂分子的吸附和解离.
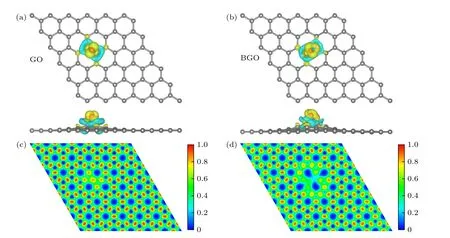
图2 氧化石墨烯和硼掺杂氧化石墨烯的电荷密度差分和电子局域密度(a),(b)电荷密度差分,黄色和蓝色区域分别表示电荷聚积和电荷消失,电荷等值面为0.004 e/Å3;(c),(d) 电子局域密度,从红色到蓝色表示电子由多到少Fig.2.Charge density difference and electron localization function (ELF) of GO and BGO: (a),(b) Charge density difference,yellow and blue indicate the gain and the loss of electrons,and the isosurface value is 0.004 e/Å3;(c),(d) electron localization function,red to blue indicates more to less electrons.
3.2 过氧化锂小团簇(Li2O2)2 的吸附性质
为了检验BGO 对过氧化锂氧化反应的催化性能,以二聚体过氧化锂小团簇(Li2O2)2作为过氧化锂模型,计算了小团簇(Li2O2)2在BGO 上的吸附性质,如图3 所示.为了比较,图3 同样给出了小团簇(Li2O2)2在GO 上的吸附性质.结果显示小团簇(Li2O2)2在GO 上吸附时有两个Li—O 键形成,而在BGO 上吸附时有3 个Li—O 键形成.另外,小团簇(Li2O2)2在GO 和BGO 上的吸附能分别为1.08 eV 和1.80 eV,大的吸附能说明硼掺杂氧化石墨烯增强了与小团簇(Li2O2)2的相互作用,BGO 更容易捕获过氧化锂团簇,使过氧化锂氧化反应顺利进行.另外,放电产物过氧化锂与BGO的紧密结合使过氧化锂向阴极转移电子更容易,更有利于降低电池的充电过电位.Bader 电荷分析表明有0.59 e 从(Li2O2)2团簇转移到GO,而有0.96 e从(Li2O2)2团簇转移到BGO,说明硼掺杂提高了从过氧化锂团簇到BGO 的电荷注入,有利于提高过氧化锂氧化反应的动能和降低充电过电位.另外,对于(Li2O2)2团簇在GO 上吸附时,团簇里的氧所带电荷(27.01 e)多于其在BGO 上吸附时氧上所带电荷(26.64 e),致使O—O 键长大于其在BGO 上吸附时的O—O 键长.以上这些分析都说明了BGO 比GO 更适合作为过氧化锂氧化反应的催化剂.

图3 (Li2O2)2 团簇在氧化石墨烯(a)和硼掺杂氧化石墨烯(b)上吸附的俯视图和侧视图以及电荷转移,箭头表示电荷转移方向,青色和绿色分别代表(Li2O2)2 团簇的O 原子和Li 原子Fig.3.Top view and side view of (Li2O2)2 cluster adsorbed on the GO (a) and BGO catalysts (b) along with the charge transfer,arrows indicate the direction of charge transfer.The cyan and green represent the O and Li atoms in the (Li2O2)2 cluster,respectively.
为了进一步分析过氧化锂小团簇(Li2O2)2与GO和BGO 的相互作用,分别计算了(Li2O2)2团簇吸附之后的投影态密度,如图4 所示,O1 和O2 分别代表(Li2O2)2团簇中的O 和催化剂上的O.可以看出,吸附了(Li2O2)2团簇之后,GO 和BGO 均为金属性质,而且电子态密度出现了自旋极化.另外,在GO 中,出现了Li 与O2 的相互作用,而在BGO中,除了出现Li 与O2 的相互作用,还出现B 与O2的相互作用,说明B 与O 对(Li2O2)2团簇起到了协同催化的作用.
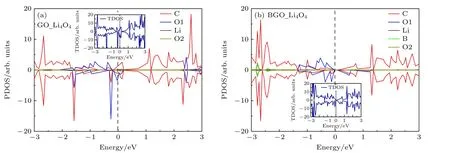
图4 (Li2O2)2 团簇在氧化石墨烯(a)和硼掺杂氧化石墨烯(b)上吸附的电子结构,图中插入的是总态密度,O1 和O2 分别代表(Li2O2)2 团簇和催化剂上的OFig.4.Electronic structures of (Li2O2)2 cluster adsorbed on the GO (a) and BGO catalysts (b),the insert is TDOS.O1 and O2 represent O on (Li2O2)2 cluster and catalysts,respectively.
3.3 过氧化锂小团簇(Li2O2)2 的解离过程
图5 所示为(Li2O2)2小团簇在GO 和BGO上按照Li-Li-O2路径解离的俯视图和侧视图及相应的吉布斯自由能.为了更接近实际情况,在计算中考虑了隐形溶剂四乙二醇二甲醚(TEGDME),介电常数选为7.79[31].由图5 可知,采用Li-Li-O2解离路径,(Li2O2)2小团簇在GO 和BGO 上解离的速率决定步(RDS)均为第1 步,即Li4O4→Li++e-+Li3O4反应步.另外,在平衡电位下,(Li2O2)2小团簇在GO 和BGO 上解离的过电位分别是1.06 V 和0.88 V.因此,BGO 降低了(Li2O2)2小团簇解离的过电位,即降低了锂-氧电池的充电过电位.因此,可推测BGO 作为锂-氧电池阴极催化剂更有助于放电产物的解离,有效提高锂-氧电池的循环性能.

图5 (Li2O2)2 团簇在GO (a)和BGO (b)上按照Li-Li-O2 路径解离的俯视图和侧视图,以及相应的吉布斯自由能曲线(c),(d)Fig.5.Top view and side view of (Li2O2)2 cluster dissociation on GO (a) and BGO (b) following the Li-Li-O2 pathway,and the corresponding Gibbs free energy profiles (c),(d).
接下来检查了Li-O2-Li 解离路径.图6(a),(b)分别显示了(Li2O2)2小团簇在GO 和BGO 上的解离过程,图6(c),(d)分别显示了(Li2O2)2小团簇相应的解离吉布斯自由能.可以看出,在GO 和BGO 上,(Li2O2)2小团簇整个氧化反应的RDS 均是解离第3 个锂,即Li2O2→Li++e-+LiO2反应步.另外,在平衡电位下,(Li2O2)2小团簇在GO 和BGO 上解离的过电位分别是0.76 V 和0.23 V,即BGO 大大降低了锂-氧电池的充电过电位.进一步检查RDS 中Li2O2中间体的吸附能,发现Li2O2分子在GO 上的吸附能为1.68 eV,而在BGO 上的吸附能为1.58 eV.反应中间体的吸附能减小有利于氧化反应的进行.因此,Li2O2分子在BGO 上的吸附能小于在GO 上的吸附能,说明Li2O2分子在BGO 上更容易发生氧化反应.最后,与Li-Li-O2解离路径的过电位0.88 V 相比,Li-O2-Li 解离路径的过电位0.23 V 更低,说明Li-O2-Li 是过氧化锂团簇最优的解离路径.

图6 (Li2O2)2 团簇在GO (a)和BGO (b)上按照Li-O2-Li 路径解离的俯视图和侧视图,以及相应的吉布斯自由能曲线(c),(d)Fig.6.Top view and side view of (Li2O2)2 cluster dissociation on GO (a) and BGO (b) following the Li-O2-Li pathway,and the corresponding Gibbs free energy profiles (c),(d).
4 结论
本文通过第一性原理计算,对比研究了氧化石墨烯和硼掺杂氧化石墨烯对过氧化锂小团簇氧化反应的催化机理.结果表明,(Li2O2)2小团簇在GO和BGO 上的吸附能分别为1.08 eV 和1.80 eV,从(Li2O2)2团簇转移到GO 和BGO 上的电荷分别为0.59 e 和0.96 e,可见B 掺杂增强了与(Li2O2)2团簇的相互作用和电荷转移,有利于提高锂-氧电池的反应动能,降低充电过电位.4 电子分解过程的吉布斯自由能表明,(Li2O2)2团簇倾向于Li-O2-Li 分解路径,GO 和BGO 的速率决定步均是第三步.在平衡电位下,GO 和BGO 的充电过电位分别是0.76 V 和0.23 V,可见B 掺杂大大降低了锂-氧电池的充电过电位.电子态密度分析表明B 掺杂调节了GO 的电子结构,增强了GO 的电子电导,并形成了缺电子活性中心,B 与O 对(Li2O2)2团簇起到了协同催化的作用.
感谢合肥先进计算中心提供计算资源.
