心室辅助装置研究进展
2024-05-13李映涛刘瑶任俊儒沈斌郭占玲
李映涛,刘瑶,2,任俊儒,沈斌,郭占玲
1. 中北大学 机械工程学院,山西 太原 030051;2. 广东省微创手术器械设计与精密制造重点实验室,广东 广州 510006;3. 浙江清华长三角研究院 海纳精密加工中心,浙江 嘉兴 314000
引言
心力衰竭在全球范围内的患病形势极其严峻,死亡率居首位,患者数量超过2600 万,并且增长的速度持续攀升[1]。自2006 年起,中国心血管病(Cardiovascular Diseases,CVD)患病率和死亡率处于持续上升阶段,患CVD 人数2.9 亿,其中心力衰竭患者有450 万,CVD 占居民患病死亡率超过了40%[2-3],是当今医学界面临的重大难题。心力衰竭患者通常需要进行心脏移植才能彻底治愈,而心脏器官来源受限制且不稳定,以及受体匹配的概率极小,因此心脏移植存在极大的不确定性且患者需要经历漫长的等待期。因此,心室辅助装置(Ventricular Assist Device,VAD)成为众多心力衰竭患者延长生存期的有效途径[1]。
目前,世界范围内的心力衰竭患者数量庞大且持续上升,因此VAD 有着巨大的应用前景。本文对国内外VAD 的发展历程和现状进行总结,对VAD 的核心部件叶轮设计和支承方式进行简述,说明各自优点,总结存在的不足,并对VAD 的体外模拟循环系统进行总结对比,展望了未来VAD 的发展方向。
1 VAD发展现状
VAD 的研究历时很短,但经历了多次改革,其发展共经历了3 个阶段,第一代搏动式、第二代中心支撑式和第三代悬浮式[4],见图1 和表1。第一代搏动式VAD 主要通过体积改变来驱动血液流动,代表性的VAD 有电搏动泵Novacor[5]和HeartMate XVE[6],气搏动泵Thoratec VAD[7]如图1a 所示。Novacor 的尺寸为16 cm×13 cm×6.5 cm,1984 年成功植入并应用于临床[5]。搏动式VAD 的体积较大,无法经血管植入,通常采用搭桥的方式建立体外循环通路,可能涉及开胸,仅适合植入大体重患者,术后感染和机械故障发生率较高。第二代轴流式VAD 采用机械轴承支撑,通过高速叶轮转动提供血压和流量,实现血流连续供给,一般没有搏动性[1],代表性的产品有DeBakey、HeartMate Ⅱ和Jarvik-2000,见图1b。轴流式VAD 一般体积和重量均较小,如DeBakey 长68 mm,宽24 mm,重量为94 g[8];HeartMate Ⅱ长7 cm,体积约63 cm3,重量约370 g[9];Jarvik-2000 长55 mm,直径为25 mm,重量约85~90 g,流量为3~7 L/min[10]。Abiomed 公司研发的Impella ECP,是世界上最小的轴流式VAD,也是唯一兼容小口径通道和闭合技术的VAD,插入和取出时直径为9 Fr,工作时膨胀,峰值流量可达5 L/min,目前还处于临床研究阶段[11],见图1b 所示。
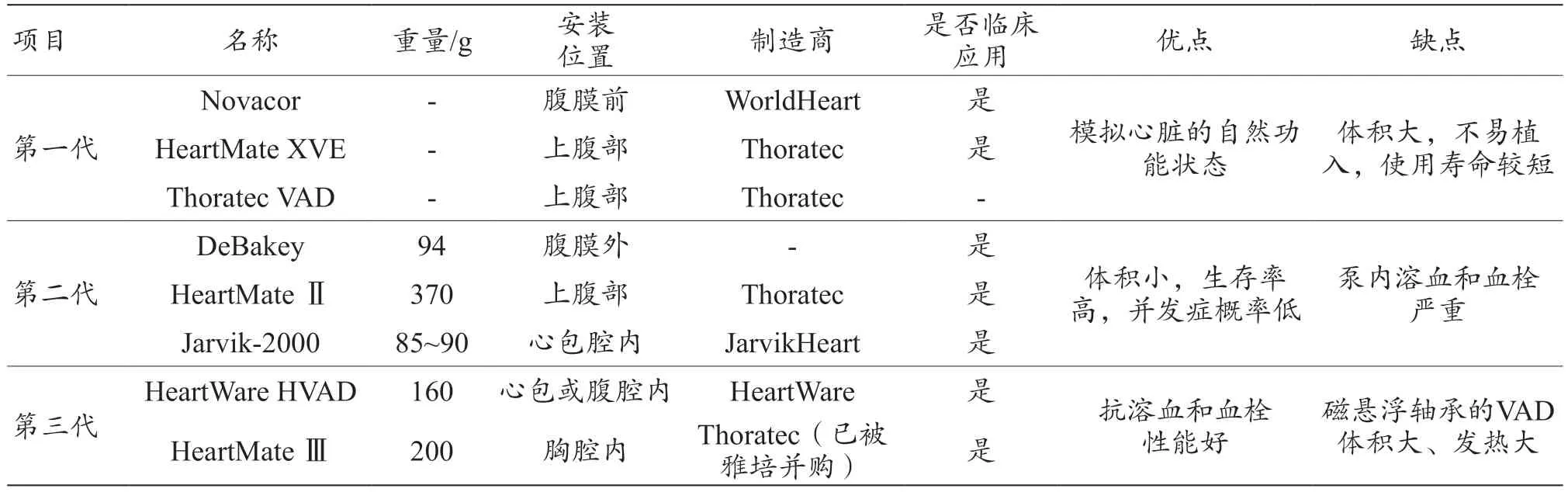
表1 第一代、第二代、第三代VAD汇总表[5-9,11-12]
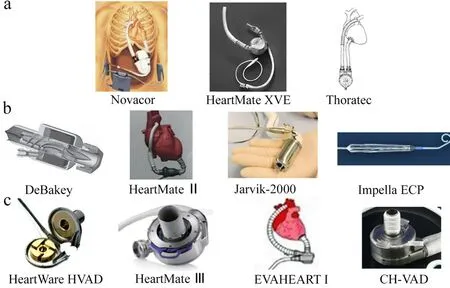
图1 各代VAD图
第三代VAD 于1998 年左右开始研制,采用磁悬浮或流体动力悬浮支承方式,推进器或转子叶轮悬浮于腔体中,避免了轴承磨损,因此可以实现长时间的使用[12]。如图1c 所示,磁液悬浮的HeartWare HVAD体积小,能耗低,尺寸为48 mm×28 mm,重量约160 g,转速为1800~4000 r/min,流量可达10 L/min[13]。全磁悬浮HeartMate Ⅲ直径为55 mm,重量为200 g,转速为3000~9000 r/min,其与HeartMate Ⅱ相比出血和卒中发生率显著降低[9]。在第三代VAD 的基础上,沙宏磊等[14]进一步提出了电磁悬浮VAD,主要产品有流体动压支撑的离心式Ventr Assist 及微型对角线Micro Diagonal。
目前临床应用的第三代VAD 中,HeartWare HVAD 最早上市,但脑卒中的发生率相对较高,因此逐渐退出了市场。HeartMate Ⅲ于2017 年批准上市,是目前应用最多的一个产品[9]。目前国内临床应用和研发的EVAHEART Ⅰ(永仁心)和CH-VAD(苏州同心)均属于第三代VAD,见图1c。离心式纯水悬浮EVAHEART I,重量为420 g,转速为800~3000 r/min,流量为2~20 L/min,生物相容性较好[15]。离心式全磁悬浮CH-VAD 于2019 年开始临床试验,重量为350 g,直径为56 mm,长为31 mm,转速为3000 r/min 时,流量为5 L/min[16]。离心式磁悬浮CorHeart6目前处于临床试验阶段,体积小、重量轻、功耗低[17]。
2 VAD的临床需求
VAD 主要通过机械方式提供血液流动,因此临床上需要VAD 的流量大于3 L/min,以确保血液供给充足[18],目前介入式VAD 可提供流量为2.5~5 L/min,峰值流量可达5 L/min,心脏所需流量为3.6~3.8 L/min[19]。机械工作方式会对血液产生压迫,特别是转子叶片对血液的剪切作用,可能导致血栓的形成,同时长期的高速旋转带来的VAD 发热也可能引发血栓,因此临床上要求VAD 的血栓生成率极低甚至没有。最新的VAD 血栓率极低,中风率降低了50%[20]。为了减小VAD 的安装难度和安装后的感染风险,也要求其体积尽可能小,便于实现经皮血管介入和植入。而对VAD 性能要求最严苛的是其工作过程的稳定性,即单次连续无故障稳定运行的时间。VAD 的治疗方式可分为暂时性治疗、心脏移植前辅助支持治疗、永久替代治疗[21]3 类。暂时性治疗主要用于高危手术过程中辅助血液流动,避免手术过程中突发供血不足导致的并发症,VAD 的工作时间通常在数个小时不等;心脏移植前辅助支持治疗主要用于心脏移植患者在等待心脏器官前的辅助和替代供血功能,要求VAD 能安全稳定的工作时间通常为几个月到数年不等;而永久替代治疗中则直接使用VAD 替代心脏,需要VAD 稳定工作几年甚至几十年,对其可靠性要求极高。
VAD 的临床应用已经有部分尝试。钱坤喜等[22]研究的离心式VAD,重量约200 g,人体试验期间,左VAD 转速为3500 r/min 左右,流量约1.5 L/min;右VAD 转速为3000 r/min 左右,流量也是1.5 L/min。临床试验方面,在抢救一名患有法乐氏三联症的6 岁患者过程中,VAD 作双心室辅助了43 h。辅助期间各数据正常,验证了心室辅助是抢救急性心功能衰竭的有效方法。刘淑琴等[23]研发的磁悬浮离心式VAD,为直径为85 mm、重量为56 g、转速为0~5000 r/min、额定功率为70 W、工作电压为24 V、最大电流为4 A。动物试验方面,VAD 在组成的体外循环系统应用中,试验期间,试验羊从心脏停跳到自主循环恢复,持续了3 d 并自主撤机。目前VAD 的小型化和低血栓生成率基本可以实现,但是其长期工作的可靠性有待进一步提高,主要需要对VAD 的叶轮设计、支承方式、体外模拟循环系统和并发症产生机理等方面进行深入研究,进一步优化现有VAD,逐步实现VAD 的平稳可靠长期工作。
3 VAD核心部件
3.1 叶轮
叶轮式VAD 经过半个多世纪的研究和发展,已经达到了血液相容性、可植入性、耐久性等临床要求。根据原理不同,VAD 分为轴流式、离心式、气动式和电动式[24],本文主要讨论离心式和轴流式的叶轮相关设计。叶轮作为VAD 装置内的核心部件,对泵血功能至关重要。本文通过比较现有叶轮的优缺点,总结其中不足,为后期VAD 叶轮的设计提供参考。
3.1.1 离心式VAD叶轮
离心式VAD 叶轮根据其盖板形式的不同分为3 类,见图2a。闭式叶轮有前后盖板,其结构复杂、效率较高,加工难度大。半开式叶轮仅叶片侧有盖板,即后盖板。开式叶轮无前后盖板。半开式与开式叶轮结构简单、加工难度小,但是效率较低[25]。与传统单级叶轮不同,见图2b,曲洪一等[26]设计的VAD,叶轮为多级离心式设计,其中导流锥结构改善流场结构,提高生物相容性,且装置结构紧凑,流量大,出口直径D2为12 mm,D1为25 mm。
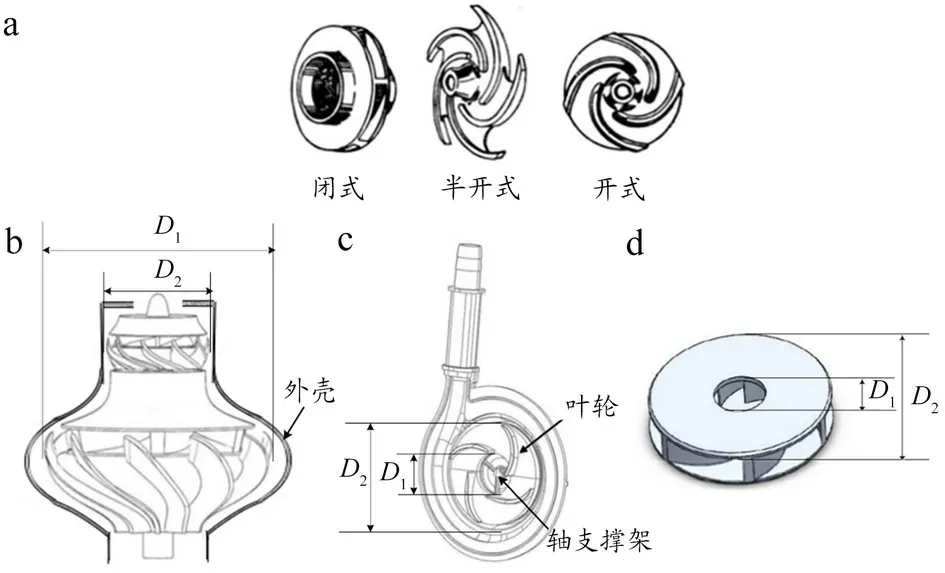
图2 离心式VAD叶轮图
刘树红等[27]和牛彦文[28]设计的半开式和闭式叶轮如图2c~d 所示。半开式的设计中,叶轮采用磁驱动旋转,其中轴支撑架的支撑腿径向截面为翼型,可使血流均匀,且溶血率低。进口当量直径D0为17 mm,进口直径D1为20 mm,外径D2为50 mm。对于牛彦文[28]的设计,其装置流量为5 L/min,转速为2600 r/min,扬程为100 mmHg,进口直径D1为16 mm,出口直径D2为40 mm。叶片入口设置为圆弧,无尖角,对血液损伤较低。上述例子的不同叶轮设计都可在不同程度上减少对血液的损伤,曲洪一等[26]的设计相对其他设计更为复杂,加工难度大且对支承方式提出了新的挑战,目前较少应用于临床。刘树红等[27]和牛彦文[28]设计的相对尺寸较大,为磁悬浮叶轮的一般设计,但不能微型化是一直以来的难题。
3.1.2 轴流式VAD叶轮
对于轴流式VAD,叶轮作为核心部件对提高装置的水力性能,减小溶血率有极大影响。如图3a 所示,周冰晶[29]设计的VAD 通过增级降速降低溶血率。如图3b~c 所示,马鑫蕊[18]和唐雨萌等[30]的设计中,前者比后者多一个导头,后者叶轮采用磁悬浮,避免了叶顶间隙泄漏涡。导头和尾椎(后导锥)使血流更加稳定地流入下一级,可降低溶血率。

图3 轴流介入式VAD叶轮
不同于以上举例,如图3d 所示,Cardiobridge 设计研发的Reitan,其泵血能力强,装置外壳在植入工作区后可膨胀,呈灯笼造型,直径可达19 mm;叶轮可折叠,工作时展开[31]。
综上,离心式和轴流式在叶轮设计上都采用了多级设计,有各自的优点,但会使装置偏大,一般实际应用中很少采用。二者都采用了磁悬浮,离心式叶轮可降低机械磨损,在第三代VAD 中使用较多;轴流式叶轮有其优点,但因尺寸限制,植入时很少使用。目前,离心式叶轮更偏向磁悬浮、单级叶轮的设计;轴流式叶轮更偏向于加有导头和尾椎、微型化、大流量的设计。
3.2 支承方式
现代临床常用的VAD 多采用滚动轴承、滑动轴承和磁悬浮轴承。滚动轴承、滑动轴承的机械摩擦较大,易导致溶血和血栓问题。目前,VAD 更趋向于磁悬浮轴承,可减小机械摩擦、增加寿命,但其结构复杂、尺寸较大[32]。随着VAD 向着可植入式发展,其中轴流式叶轮恰好满足尺寸和结构要求[33]。所以在VAD 支承方式设计时,不同方案决定了最终装置的结构和性能。本文讨论了轴流式和离心式支承方式的相关设计,通过举例,比较各自优点,总结其中不足,为后期VAD 支承设计提供参考。
3.2.1 离心式VAD支承
如图4a 所示,韩青[34]研究的VAD 采用了液力悬浮支承,轴向:锥形止推轴承;径向:圆柱向心轴承与锥形结构,流量高、支承力强。其次,主轴开设的螺旋槽可减小血栓。本文中的举例为混合磁力轴承,见图4b,方思源[35]研究的VAD,采用电磁永磁混合支承,径向:3 个电磁铁的向心效应,轴向:永磁体产生偏置磁场,电磁铁产生控制磁场。其次,3 个霍尔传感器检测调节电流,降低功耗和发热量,其结构紧凑,承载能力提高。如图4c 所示,王静月[36]研究的VAD,采用永磁液力悬浮支承,径向:永磁轴承和轴向磁通无刷直流电机组成,永磁轴承靠异磁极相吸产生与电机磁拉力平衡的磁力;轴向:螺旋槽与转子形成液力悬浮;优点:结构紧凑,性能良好。

图4 离心式VAD支承图
离心式VAD 支承多采用悬浮设计,可以减小血液损伤、机械磨损,但结构复杂、体积难以减小。其中液力悬浮相较于磁力悬浮功耗小、发热少且传感元件的加入使得装置更加精确灵敏。
3.2.2 轴流式VAD支承
轴流式VAD 支承方式除磁悬浮方式外,还有很多其他的支承结构。如图5a 所示,黄铭文[37]研究的植入式VAD 采用径向动压支承,轴向Pivot 轴承相结合。Pivot 轴承使轴头和球窝之间形成开放式间隙,因而血液不易滞留、血栓率低,且装置结构简单、尺寸小、能耗低。轴头半径R2=0.2 mm,球窝半径R1=0.5 mm,顶尖锥度a=35°,间隙d=0.161 mm。与传统支承相类似,见图5b,唐智荣等[38]研究的VAD,其轴承元件除起到支撑和辅助旋转的作用外,添加有内外层流道,可供液体在装置高速旋转时排出不溶性微粒并及时换热,避免过热损害。
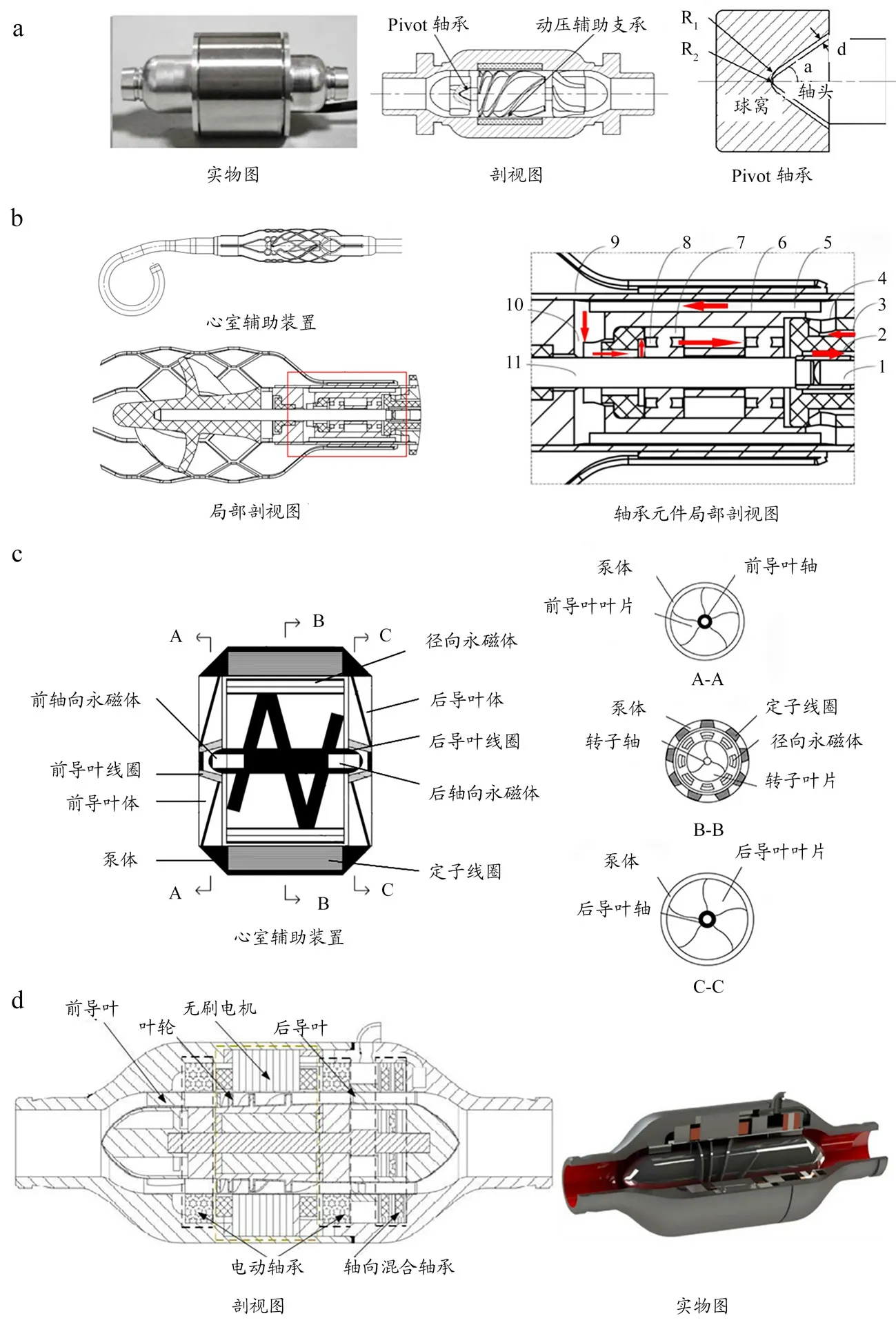
图5 轴流式VAD支承图
与离心式VAD 类似,轴流式VAD 在支承方面磁悬浮应用也很频繁。如图5c~d 所示,李博等[39]和李明[40]研究的VAD 都具有磁悬浮支承。前者径向:定子线圈与永磁体驱动转子转动;轴向:前后永磁体和前后导叶线圈,形成磁悬浮脉动状态。后者径向:电动轴承;轴向:混合磁轴承,可有效降低溶血和血栓。
总结上述离心式和轴流式VAD 支承方式的设计,都采用了悬浮设计,离心式采取液力、电磁和永磁悬浮两两相结合或者单独使用,使用磁悬浮的设计居多;轴流式类似。都采用了开槽设计,离心式为辅助设计,减小血栓;轴流式为支承的一部分。其中VAD 的悬浮设计可减小机械摩擦、血栓和溶血,但结构复杂、体积较大,不适合介入治疗,目前,第三代离心式VAD 使用较多。介入式一般向微型化发展,多为轴流式,通过合理的叶轮设计和支承结构,减小机器耗损、产热,提高机器的性能。同时在尺寸和体积受限制的情况下,提高流量输出也是VAD 目前面临的主要问题。
3.3 体外模拟循环系统
体外模拟循环系统可模拟人体内的工作环境,对VAD 的各项性能进行检测评估,方便其在植入前优化改进。本文通过对体外模拟循环系统进行举例,对比得出其构成、功能及发展趋势,为后期系统的设计提供借鉴。本文以人体常规状态血流参数和血液循环路径作为设计体外模拟循环系统的基础。
早期的体外模拟循环系统结构较为简单,可对VAD的基本性能进行检测。如图6 所示,Yoshino 等[41]设计的体外模拟循环系统,可检测装置的流量和压差,且电阻可调节流量。目前的体外模拟循环系统更为复杂,功能更为广泛。如图7~9 所示,设计大致相似,系统设计包含模拟左心室、主动脉瓣和二尖瓣、外周阻力、主动脉、静脉、心房等。其中,主动脉瓣和二尖瓣均为单向阀模拟,使溶液单向流动,防止回流。对于系统外周阻力的模拟,董尧[42]和王若辰[43]的设计均采用节流阀;谭建平等[44]的设计为电比例节流阀,黄峰[45]的设计为电比例阀,秦金祥[46]的设计为阻性调节阀;后三者的设计对于阀口开度控制更为精密准确。在模拟主动脉的顺应性方面,董尧[42]和王若辰[43]的设计为上气下液的密封容腔,黄峰[45]和秦金祥[46]的设计为密封有气的容器,通过调节气量模拟。静脉用于存储大量血液,具有远高于主动脉的顺应性,一般采用敞口容器模拟静脉和心房腔,但心房具有微弱的搏动性,王若辰[43]设计的系统采用有弹性膜片顶部密封的容器模拟。其中秦金祥[46]设计的系统包含4 个压力传感器,分别用于测量控制腔、动脉容腔、心室、静脉容腔的压力;1 个激光位移传感器,用于测量控制腔内心室囊的体积变化。

图6 Yoshino设计体外模拟循环系统实物图(a)和示意图(b)[42]
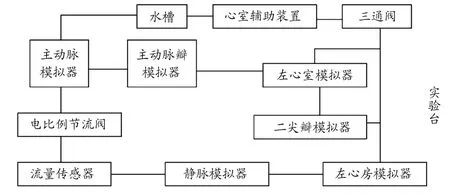
图7 谭建平设计体循环模拟回路[44]
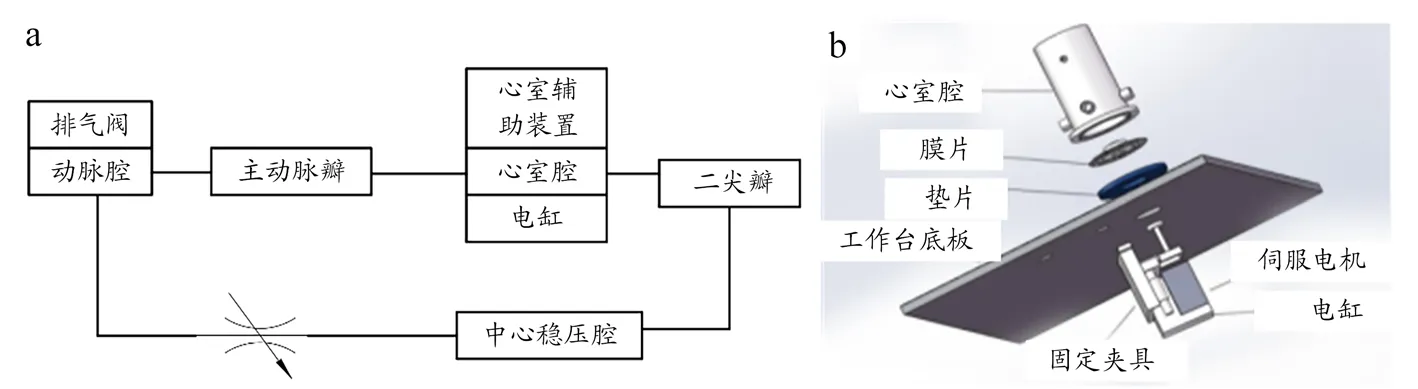
图8 董尧设计体循环模拟回路(a)及心室腔(b)[42]
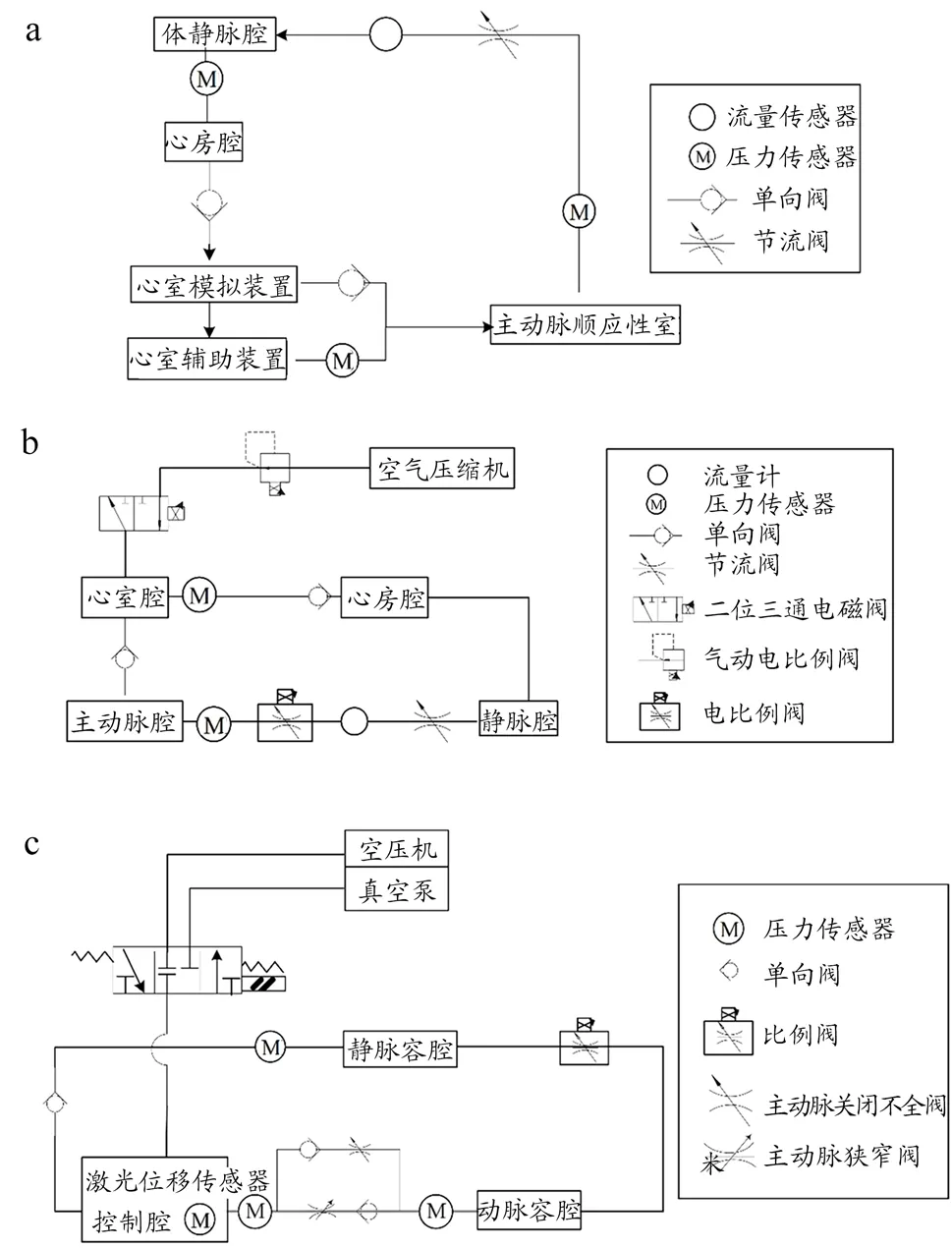
图9 模拟循环系统图
模拟左心室相比其余部件较为复杂,谭建平等[44]的设计与王若辰[43]的设计相似,前者为伺服电动缸和活塞,另加有压力传感器;后者电机带动活塞运动。董尧[42]的设计为伺服电机与电缸带动膜片运动,模拟其搏动。黄峰[45]的设计为调节气动电比例阀模拟搏动强弱,通断二位三通电磁阀模拟心动周期。秦金祥[46]的设计为比例阀和真空泵控制压力,挤压控制腔内心室囊模拟搏动。上述例子除了使用了各类传感器用于检测,还有控制系统通过软件编译程序来控制系统内的装置,通过数据采集卡采集传感器的信息,输送到工控机,完成数据采集、处理以及波形显示[43-46]。
总结上述体循环模拟系统,左心室在简单模拟其搏动的基础上,添加控制部件对其实时调节,使其更加灵活,可模拟不同情况下的心脏。控制系统的添加便于控制各个装置,并使系统数据更加精确。体循环模拟系统更趋向于智能化、精确化、复杂化。
4 VAD的并发症
VAD 植入后引起的并发症中,感染率占29.5%,右心衰竭占8.4%,装置失功(装置失灵和连接管道脱血管或梗阻等)占8.4%,呼吸衰竭占4.5%,出血占3.2% 等[47]。这些对于患者的健康和生命有着不同程度的危害,因此研究并发症形成的内在机制,并针对性地给出防治和治疗措施是目前研究的重点。
感染是植入VAD 术后常见的并发症,也是机械循环支持患者发病率和死亡率增加的重要原因,主要分为VAD 特异性感染、VAD 相关感染和非VAD 感染[48]。感染通常由大量不同的微生物引起,感染病原菌主要是革兰氏阳性菌(金黄色葡萄球菌和表皮葡萄球菌)和革兰氏阴性菌(铜绿假单胞菌)[49]。可采用18F-FDG PET/CT无创性手段检测感染并监测抗菌药物治疗反应,对感染进行评价和定位,其临床治疗意义重大[50-51]。术后护理对防止感染也很重要,对埋植在皮肤下的驱动线路需要频繁进行护理和保护,并在活动时预防驱动线路意外拔出[52]。术后对于可疑或者确诊的感染患者,须及时使用抗生素治疗[53]。
右心衰竭由术后左心室排血和回血量增加,右心功能不足导致左心室充盈不足流量骤降,进一步增加跨肺压,肺动脉压力增高导致。其发生时间不定,发生率为10%~40%[54]。可通过增加右心收缩力或者降低肺动脉压力的药物进行紧急处理,使用高流量的辅助器械进行治疗;对于急性右心衰竭需要使用双心室辅助系统,该方式最为危险,术后诊治难度最大[55]。
当VAD 植入后,其各个运动部件需要以10 万次/天运转,极易发生机械故障[56]。若装置轴承为接触式,那么VAD 长时间工作,摩擦会产生机械失效和发热。第三代磁悬浮和液力悬浮轴承的使用减少了机械摩擦问题[57]。除了机械故障,装置停机也是装置失功的原因。排除可致VAD 低血流量的可能原因,包括低血容量、右心衰竭、泵内血栓、心律失常、导管脱位等,当装置停机,尝试重启检查电源供应、连接器,必要时更换电池或控制器[58]。心律失常在VAD 患者中很常见,其病因包括手术插入点瘢痕、心肌缺血、微结构改变导致的去极化异常及某些药物等所致[58-60]。VAD 植入后,针对心律失常程度的不同,可先进行除颤处理,若效果不佳,应采取胸外机械按压和肾上腺素等进一步复苏措施[58]。
除此之外,VAD 在运行中,不可避免地会对装置内血液造成一定损伤,导致红细胞溶血并诱发血栓,血栓会导致装置内部流道阻塞,流量急剧下降,或随着管路运往人体其他部位,堵塞重要心脑血管,对人体健康造成巨大的威胁[61]。溶血是指VAD 运行时产生的机械应力可能会对红细胞造成破坏,同时破裂的红细胞会失去携氧功能,引起低氧血症等一系列问题[62],该破坏产生的原因有机械碰撞损伤、叶轮带动血液流动产生的剪切损伤、液体流动形成动压力导致的压溃或者负压破裂,上述因素交织在一起使红细胞碎裂过程研究困难,导致其损伤机理不明确。
出血是VAD 植入或取出引起凝血-纤溶系统的异常激活而导致的最常见的术后早期并发症,高达30%成人患者和50%儿童患者需因出血再次手术。按照术后出现出血的间隔时间长短可分为30 d 内早期出血和6 个月内延迟出血[63]。其中术后胃肠道出血较为突出,可以采用奥曲肽、外科手术(内镜)、VAD 速度调节等进行治疗[64-65]。
VAD 的设计对血液损伤率有很大的影响,如何设计VAD 能减小血液损伤率,是一直以来人们关注的重点。雷白等[63]研究显示,目前能够提示VAD 血栓形成的临床标志是溶血和功耗增加。其中与成人相比,VAD 应用于儿童和青少年时出血和血栓之间的平衡更难控制。流场对红细胞的影响主要体现在剪切应力、撞击、压差和湍流等对红细胞造成的损伤[66]。
目前,无论是离心式还是轴流式VAD,大多通过叶轮高速旋转泵血。在叶轮设计中影响血液相溶性的参数方面,压力、转速、叶片数、角度、宽度等对血液损伤有显著影响[67]。Kawahito 等[62]研究显示,溶血由剪切应力的大小和暴露时间决定的。剪切应力的大小与速度直接相关,而暴露时间与流量成反比。Wu 等[68]通过CFD模拟分析,在流量为2.5 L/min、转子转速为3000 r/min 时,以50、100 和200 μm 的叶尖间隙为研究对象,定量计算得出最佳叶尖间隙为100 μm,水力效率最大化,溶血最小化。Ozturk 等[69]在流速为3~5 L/min、转速为2000 r/min的条件下,对包角为0°~240°的5 个叶轮进行水力试验,得出包角为120°时,水力和溶血性能最佳。Sahand 等[67]以离心式VAD 为研究对象,得出转速一定,增加叶片数量,剪切应力和标准溶血指数更高;较高的转速下,减少叶片数量,溶血率降低;转速一定,当出口角度较高时,剪切应力和溶血指数略有增加;对比得出出口角度的变化对溶血的影响要比叶片数量的变化小得多;增加出口宽度,溶血的概率更高。叶片高速旋转产生的剪切应力对红细胞等血细胞具有很强的破坏力,易形成血栓,引发中风、多器官衰竭等严重后果[70]。
与叶轮泵对比,搏动式VAD 因其具有与心脏相似的供血规律,能够提供搏动血流,对血细胞破坏小,搏动产生的压力有利于各主要脏器的血液微循环灌注,可有效减少血栓形成,更符合人体的生理特点。但体积较大,植入较为困难[70]。阜外医院在使用VAD 之后,通过术后随访经验,总结了国际和国内术后并发症的种类,得出国际和国内并不完全一样。国际上出现的较大问题为消化道出血、感染、卒中、右心衰。国内消化道出血、卒中发生比较少见,感染、心律失常出现得更多,但与因照顾不良而死亡表现则一致,造成该结果的原因可能为国内外人种之间的不同。
5 总结与展望
本文对VAD 的不同方面进行总结。发现其存在较大的改进空间:结构设计方面,相较于电机内置,电机外置时对电机的结构大小没有限制,但其柔性传动轴在远距离、有弯曲段的情况下确保其能量正常传输是一个挑战。VAD 在使用时,不可避免会产生血液损伤,但血液损伤的理论还有待进一步探究,如何降低损伤概率还需要进一步研究。
未来VAD 发展更趋向于超微型、轻量化。柔性传动轴设计和材料可使装置在不同情况下的能量完成正常传输。叶轮的结构设计优化,既能保证血流量,又可减少血栓和溶血。装置的材料方面进一步改善,生物相容性随之发展,使使用期间的血栓和溶血率降低,植入成功率更高。
