基于深度学习的图像重建算法在下肢动脉病变CTA诊断中的研究
2024-05-13陈芸朱彦王扬赵天李月峰陈兴兵
陈芸,朱彦,王扬,赵天,李月峰,陈兴兵
1. 江苏大学附属医院 医学影像科,江苏 镇江 212001;2. 高邮市人民医院 放射科,江苏 扬州 225600
引言
下肢动脉病变是临床常见的狭窄或闭塞疾病[1],准确的血管参数评估对该疾病治疗决策和健康管理至关重要。数字减影血管造影(Digital Subtraction Angiography,DSA)具备高分辨率血管图像的卓越优势,被认为是该疾病诊断的“金标准”[2]。然而,DSA的参数局限性限制了其在临床实践中的应用,包括侵入性强、放射线暴露量大以及无法提供三维解剖信息等[3]。随着CT 血管成像(Computed Tomography Angiography,CTA)技术的发展[4],信息提供的全面性和随访便捷性使其在无创性检查领域受到了广泛认可。不断改善CTA图像质量以获得更佳的诊断效果已成为学界共同的技术目标。近年来,基于深度学习的图像重建技术(Deep Learning Image Reconstruction,DLIR)已成熟应用于心脏、主动脉等多个成像领域[5-8]。DLIR 能够通过学习大量的图像数据,优化图像质量、减少噪声以及提升对比度,提供更加清晰准确的图像信息[9,10]。本研究旨在基于DLIR 来改善下肢动脉病变CTA 图像质量,为疾病诊断和治疗提供更加可靠、精准的图像支持。
1 资料与方法
1.1 一般资料
回顾性收集2021 年6 月至2022 年2 月我院血管科收治的下肢动脉狭窄病变的51 例患者资料。纳入标准:① 下肢动脉经DSA 和CTA 检查确诊为双侧或单侧下肢动脉狭窄或闭塞;② 年龄20~50 岁;③ 源图像存在并可重建至0.625 mm 层厚。排除标准:① 外伤或占位性病变;② 图像质量不佳。共计51 例患者资料(65 条下肢动脉),其中男性28 例,女23 例,平均年龄(62.3±7.2)岁。51 例患者中,51 例合并糖尿病,34 例合并高血压病,26 例合并高脂血症,22 例合并冠心病,14 例有脑梗死病史。51 例患者均有不同程度的肢端发凉、红肿,间歇性跛行,静息痛,皮肤溃疡等提示下肢动脉供血不足的迹象。所有受试者对影像学资料的使用均知情同意,本研究经本院伦理委员会批准(批准文号:SWYXLL20210401)。
1.2 检查方法
以DSA 结果为“金标准”,检查动脉包括患侧髂总动脉、髂外动脉、股动脉(股深动脉及股浅动脉)、腘动脉、胫前动脉、胫后动脉、腓动脉及足背动脉。DSA 检查:采用Innova 4100 DSA(GE,美国)。采用Seldinger 法经股动脉或桡动脉穿刺,将插管送至患肢动脉。CTA 检查:采用256 排Revolution CT 机(GE,美国)。患者取仰卧位,足头位,扫描范围自L3 椎体上缘至足尖。用高压注射器将对比剂碘海醇(扬子江药业集团有限公司,300 mgI/mL)以4.0 mL/s 注射入肘前静脉80~100 mL,再以相同流率注射0.9% 氯化钠溶液20 mL,以自动跟踪触发技术扫描,选取L3 水平的腹主动脉作为监测层面,感兴趣区(Region of Interest,ROI)强化幅度达到平台期后触发扫描,阈值设为120 HU。扫描参数:管电压120 kV,管电流采用智能控制,准直器数量及宽度64×0.625 mm,螺距0.61 mm,球管转速0.75 s/r。获得的原始数据以DICOM 格式传入工作站,用于后续进行混合迭代重建(Hybrid Iterative Reconstruction,HIR)和DLIR[11]。在HIR 中,使用噪声抑制技术与滤波反投影(Filtered Back Projection,FBP)相结合。根据我院目前的临床扫描标准,通常将噪声抑制技术的比例调整为60%。DLIR 生成在额定辐射剂量下获得的FBP 输入正弦图上训练的图像,有低、中和高强度设置下的DLIR 算法可供用户选择,鉴于增加的DLIR 权重预计可能会带来更好的图像质量[12],本文选用了高强度权重DLIR 进行图像重建。所有操作均由经验丰富的影像科技师和护师共同完成。
1.3 评估方法
图像噪声、信噪比(Signal to Noise Ratio,SNR)和对比噪声比(Contrast Noise Ratio,CNR)被用于图像质量的客观性评价。分别在3 段下肢动脉观察层面进行测量,CT 值用CT动脉表示,ROI 面积尽可能大,同时避开钙化和伪影。将ROI 置于髋关节周围、髌骨下方及踝关节周围,以空气测量CT 值的标准差作为背景噪声,用CT背景噪声表示;并测量股二头肌、腓肠肌及踝关节层面跟腱CT 值,用CT肌肉或肌腱表示。SNR 被定义为CT动脉/CT背景噪声,CNR 被定义为(CT动脉-CT肌肉或肌腱)/CT背景噪声。CTA 检查的图像均由具有5 年工作经验的两位医师采用盲法阅片。对诊断不一致的病例进行协商报告,报告内容包括狭窄部位和分级。血管分支定义为:膝上动脉,包括髂总动脉、髂外动脉至股浅动脉;膝下动脉,包括腘动脉、胫前动脉、胫后动脉、腓动脉;足背动脉。血管狭窄程度定义为:轻度狭窄,狭窄程度<50%;中度狭窄,50%≤狭窄程度≤75%;重度狭窄或闭塞,75%<狭窄程度≤100%[13]。
1.4 统计学分析
采用SPSS 22.0 统计学软件进行数据分析。采用Shapiro-Wilk test 和Levene's test 分别对数据进行正态性检验和方差齐性检验。非正态分布的连续变量用M[P25,P75]表示,组间比较行Mann-WhitneyU检验。用Kappa 检验对两名医师在HIR 和DLIR 图像的诊断结果进行一致性分析,Kappa>0.8 为一致性好,0.4≤Kappa≤0.8 为一致性较好,Kappa<0.4 为一致性较差。以DSA 结果为“金标准”,分别计算下肢动脉CTA 诊断中度和重度狭窄病变的敏感度、特异性、准确度,并使用McNemar 检验来评估HIR 组和DLIR 组敏感度和特异性是否存在显著差异。以P<0.05 为差异有统计学意义。
2 结果
2.1 下肢动脉狭窄患者DSA诊断结果
51 例患者共计65 条下肢动脉病变,每条下肢动脉的3 段动脉均取其中狭窄程度最严重的一处病变进行分析,其中膝上动脉(56.9%)和足背动脉(53.8%)以轻度狭窄为主,膝下动脉(38.5%)以中度狭窄为主。DSA 检查结果如表1 所示。

表1 下肢动脉病变患者DSA诊断结果(例)
2.2 两种重建算法图像客观质量评估比较
与HIR 相比,DLIR 显著降低了下肢动脉各段图像噪声(Z膝上动脉=8.36,Z膝下动脉=9.46,Z足背动脉=7.19,均P<0.001),改善范围为25.9%~34.6%。相应地,SNR 提高了43.8%~53.3%(Z膝上动脉=-7.32,Z膝下动脉=-7.91,Z足背动脉=-8.45,均P<0.001),CNR 提高了38.9%~53.3%(Z膝上动脉=-8.66,Z膝下动脉=-9.21,Z足背动脉=-8.52,均P<0.001),见表2、图1~2。

图1 下肢动脉狭窄患者HIR图像(a)和高强度DLIR图像(b)

表2 两种重建算法图像客观质量评估比较{M[P25,P75]}
2.3 观察者间一致性分析
Kappa 检验报告了两种重建算法均具备医师间良好的观察一致性,但DLIR 的观察者间一致性(Kappa=0.86)仍高于HIR(Kappa=0.75)。对于不同的局部解剖部位,HIR 与DLIR 的观察者间一致性如下:膝上动脉(0.82vs. 0.91)、膝下动脉(0.76vs. 0.85)、足背动脉(0.71vs. 0.84)。
2.4 下肢动脉病变的诊断效能分析
与HIR 相比,DLIR 的图像对膝下动脉重度狭窄的敏感度(72.2%vs. 94.4%)、特异性(78.7%vs. 95.7%);足背动脉中度狭窄的特异性(86.0%vs. 97.7%)及重度狭窄的敏感度(50.0%vs. 87.5%)均显著提高(P<0.05);膝上动脉及膝下动脉中度狭窄、膝上动脉重度狭窄的诊断效能无显著差异(P>0.05),见表3。
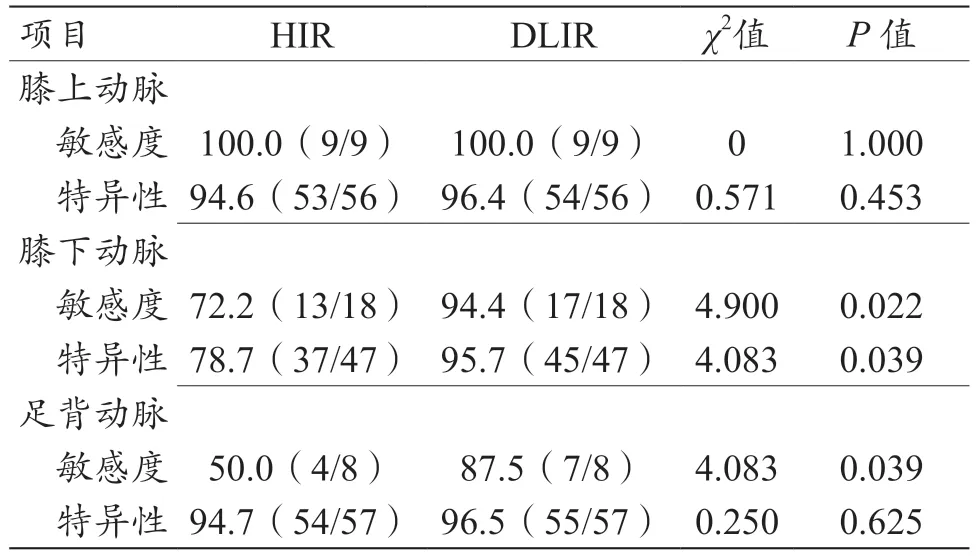
表3 两种算法对CTA重建后诊断下肢动脉重度狭窄的效能比较[%,(n/N)]
3 讨论与结论
本研究在深度学习算法的医学应用、医师诊断效能以及降低辐射剂量方面具有显著创新性。相较于既往手动、效率低下的图像处理算法,深度学习模型依靠其强大的特征学习能力,对图像特征进行高级提取和优化,极大增强了图像的对比度、清晰度和精确性[14]。这一优势尤其适用于处理下肢动脉这类具有复杂血管结构和噪声干扰的图像。其次,伴随着下肢动脉CTA 图像质量的优化,医师的诊断效能也得到了提升。医学图像在下肢动脉病变的诊断中扮演着关键角色,而图像质量更是直接影响着医师对病变的准确诊断和治疗规划。深度学习增强的图像使医师能够更容易识别和定位病变部位,从而有效减少误诊和漏诊风险。最重要的是,这一算法的应用降低了图像对对比剂的依赖性,有助于降低患者的辐射暴露和不良反应风险,对于需要长期接受多次检查和肾功能损害的患者至关重要。深度学习算法通过减少图像噪声,有望在保持图像质量的前提下减少辐射剂量和碘剂使用。
通过在下肢动脉CTA 的图像处理中引入深度学习算法,客观图像质量得到了显著提升。相应地,医师间对于同一病例的诊断也更为一致。这是基于先进算法优化后提供了更精准的图像[15],而非图像美化后病变失真造成的误诊一致。在此基础上,本文针对优化前造成CTA 病变部位误诊或漏诊的病例进行了详细分析,与DSA 的诊断分歧总是表现为过度评价或评价不足。图像中密集钙化血管常表现出高衰减特性,其衍生的晕染效应及硬化伪影可能是高估的根本原因。既往研究利用双能量CT 测量不同能量下的图像特征来区分钙化和非钙化组织,并在后处理中可减去血管壁中含有钙的体素[16]。然而,设备成本高、技术复杂、适用范围有限、操作依赖性强等缺点限制了其临床应用[17]。另一方面,组织中的小血管因受部分容积效应的影响,狭窄区域的密度被扭曲则可能会造成低估。对于假阴性病例,这样的影响在图像中会呈现出模糊的特征,从而导致漏诊。虽然延迟扫描时间、减小体素尺寸或使用较小的层厚等方案可缓解这些不良影响,但受试者无法避免地接受更多的辐射剂量。对于假阳性病例,其中一部分是图像中的运动伪影引起的。尽管本研究在DLIR-CTA 中进行了针对高流速血液的对比度优化,但在某些情况下,仍可能出现运动伪影,导致狭窄区域的误判。本研究构建的DLIRCTA 能有效应对上述多样化的图像质量问题,包括在常规降低噪声,改善SNR 的基础上,增强了脉管内外和小血管边缘的对比度;减弱甚至去除钙化伪影;以及对空间分辨率进行重建改善。
首先,本研究展示了DLIR 技术在医学图像处理中的成功应用。在处理类似的医学图像中的噪声、对比度下降等问题时,可以通过引入深度学习模型来辅助客观图像质量提升。其次,针对钙化伪影这类医学图像中的常见问题,可以通过DLIR 对大量图像数据的学习来识别其结构和纹理特征,然后模型自适应地将其判别为异常结构并去除,以使图像更清晰和准确[18]。最后,小血管边缘的对比度增强处理提示了类似的小结构可视化的改善策略。DLIR 模型中包括多个卷积层,这些层能够逐渐提取和强化小结构的边缘特征并进行标记,以便于将其更清晰地与周围组织分开[19]。
深度学习作为近年来新兴的机器学习方法,已广泛应用于医学领域的辅助诊断、分类、图像处理等方面。Su 等[20]基于心肌灌注成像的深度学习算法对心肌缺血进行辅助诊断;Tian 等[21]利用深度学习算法模型超声内镜图像实时区分胰腺癌或非胰腺癌病变。本研究是基于深度学习在脉管系统图像处理方面的应用,冠状动脉CTA 和主动脉CTA 的DLIR 模型应用均取得了令人满意的效果,Koo 等[22]评估了DLIR 算法在冠状动脉CTA图像重建的临床可行性;Heinrich 等[23]证明了在主动脉CTA 中DLIR 改善图像质量的能力超过了目前最先进的迭代重建水平,而关于下肢动脉病变CTA 图像质量改善的研究却鲜有报道。与其他相关研究相比,本研究的主要亮点在于借鉴了既往开发的脉管系统深度学习模型经验,创新性地将DLIR 引入下肢动脉病变的诊断中。这些研究均是以临床实际问题为导向构建的图像质量优化算法,以提高医师诊断效能和降低患者辐射暴露为目标。
本文的研究仍存在以下局限性:① 回顾性收集的病例仅来源于单中心的医疗机构,可能会存在选择偏倚,未来需要联合多中心研究来验证DLIR 模型在不同临床环境和硬件设备上的适用性;② 仅考虑各段动脉狭窄程度最严重的一处病变,限制了对动脉病变全貌的理解。未来将扩展病变评估范围,更全面地了解模型的综合表现,随着持续的模型优化和更丰富的训练数据,有望进一步提升DLIR 模型的性能。
