3D-STI参数评价抗HER-2药物对乳腺癌患者心室功能变化的价值
2024-05-13勉丽张茜王霞
勉丽,张茜,王霞
新疆医科大学第二附属医院 超声科,新疆 乌鲁木齐 830000
引言
乳腺癌是女性常见恶性肿瘤,全球每年新增乳腺癌病例约160 万人,随着近年来生活方式改变、诊断技术提高,乳腺癌发病率有显著升高的趋势,严重威胁女性身心健康[1]。相关数据显示,2019 年约有170 万女性被诊断出患有乳腺癌,其占所有癌症发病率29%,已成为仅次于肺癌的全球第二大常见癌症[2]。手术切除是根治乳腺癌的治疗手段,术后辅助化疗可降低复发率和死亡率。在确诊乳腺癌时,约20%患者出现人表皮生长因子受体-2(Human Epidermal Growth Factor Receptor-2,HER-2)过度表达情况,当HER-2 基因过度表达或出现扩增时,会促使肿瘤生长、存活和分化[3]。乳腺癌患者HER-2 过度表达一般考虑与不良预后有关。目前抗HER-2 药物已被美国列为抗HER-2 阳性乳腺癌规范治疗程序,抗HER-2 药物包括曲妥珠单抗、拉帕替尼、帕托珠单抗等。其虽可提高乳腺癌患者生存率,但会引起严重心脏毒性且呈剂量依赖性,早期发现、有效治疗,对预防患者左室心肌功能障碍非常重要[4]。临床常用心电图、核磁共振等检测抗HER-2 药物心脏毒性,但因缺乏特异性、有创性、价格昂贵等原因导致临床应用受到限制[5]。三维斑点追踪成像(Three Dimensional Speckle Tracking Imaging,3D-STI)技术可评价左心室心肌力学变化[6]。本研究旨在探讨3D-STI参数评价抗HER-2 药物对乳腺癌患者心室功能变化的价值。
1 资料与方法
1.1 一般资料
选取我院2021 年6 月至2022 年6 月收治的50 例需行辅助化疗的乳腺癌患者作为观察组,年龄30~65 岁,平均年龄(48.22±3.12)岁,体质指数(Body Mass Index,BMI)(21.35±1.25)kg/m2。选择同期30 名健康志愿者作为对照组,年龄32~68 岁,平均年龄(48.51±3.18)岁,BMI(21.43±1.22)kg/m2。两组上述资料对比无统计学差异(t年龄=0.400、t体重指数=0.280,P>0.05)。本研究经医院伦理委员会批准(批准文号:20211012-24C)。
纳入标准:① 符合《乳腺癌诊治指南与规范》[7]标准;② 均行抗HER-2 药物治疗者;③ 化疗周期为6 周期;④ 年龄在30~65 岁;⑤ 常规生化指标无明显异常;⑥ 自愿参与本研究者。排除标准:① 合并糖尿病等有损心血管疾病者;② 有药物过敏史者;③ 既往有心脏疾病史者;④ 超声检查图像不清晰者;⑤ 恶液质及严重贫血者;⑥ 合并其他恶性肿瘤者。
1.2 检查方法
仪器:Vivid E9 型超声心动图仪(GE,美国),M5Sc-D 常规心脏探头(频率1.7~3.3 MHz),四维矩阵探头V4-D(频率1.7~3.3 MHz)。
常规超声心动图采集:研究对象取左侧卧位,同步连接心电图,于胸骨左缘3 与4 肋间隙使用探头,获得标准左室长轴切面图,在M 型图像上测量左心室收缩末期内径(Left Ventricular End-Systolic Diameter,LVEDs)、 左心室舒张末期内径(Left Ventricular End-Diastolic Diameter,LVEDd)、室间隔厚度(Interventricular Septum Diameter,IVSd)、 左室后壁厚度(Left Ventricular Posterior Wall Diameter,LVPWd),于心尖四腔心切面测E 峰、A 峰,获取E/A 值。再将探头调节至心尖四腔心切面获得清晰心内膜面,启动全容积成像,使用改良双平面辛普森法收集4 个连续心动周期图像,估算出心室容量后自动显示左心室射血分数(Left Ventricular Ejection Fractions,LVEF)。
3D-STI 数据处理:保持上述患者体位及心电图连接,切换彩色多普勒超声诊断仪为四维矩阵探头V5,获取标准心尖四腔心切面后,平行缓慢向外移动探头,至清晰显示左室心内膜面,存储实时左心三维全容积图像。须注意,整个心脏全容积图像采集过程中均显示全部左心室。使用可移动磁盘将四维图像拷贝到电脑上,操作左室自动分析软件后,屏幕上出现心尖区视图、交叉视图,按系统提示步骤操作,系统可自行校准二腔心图像,也可手动调整获取最佳心脏轮廓,系统自动获取常规数据,单击相应应变及扭转按钮可得到整体纵向应变(Global Longitudinal Strain,GLS)、整体圆周应变(Global Circumferential Strain,GCS)、整体径向应变(Global Radial Strain,GRS)、 左心室扭转(Left Ventricular Twist,LVtw)等参数值,心肌综合指数(Myocardial Composite Index,MCI)=GLS×LVtw。系统自动生成左室壁应变17 节段牛眼图,见图1。

图1 乳腺癌患者左室心肌面积应变牛眼图及应变-时间曲线
1.3 统计学分析
2 结果
2.1 常规参数
观察组化疗第6 周期E/A 值低于对照组和化疗前(P<0.05),对照组与观察组化疗前、化疗第2、4、6 周期LVEDs、LVEDd、IVSd、LVPWd、LVEF 差异无统计学意义(P>0.05),见表1。
表1 对照组与观察组常规参数比较(±s)
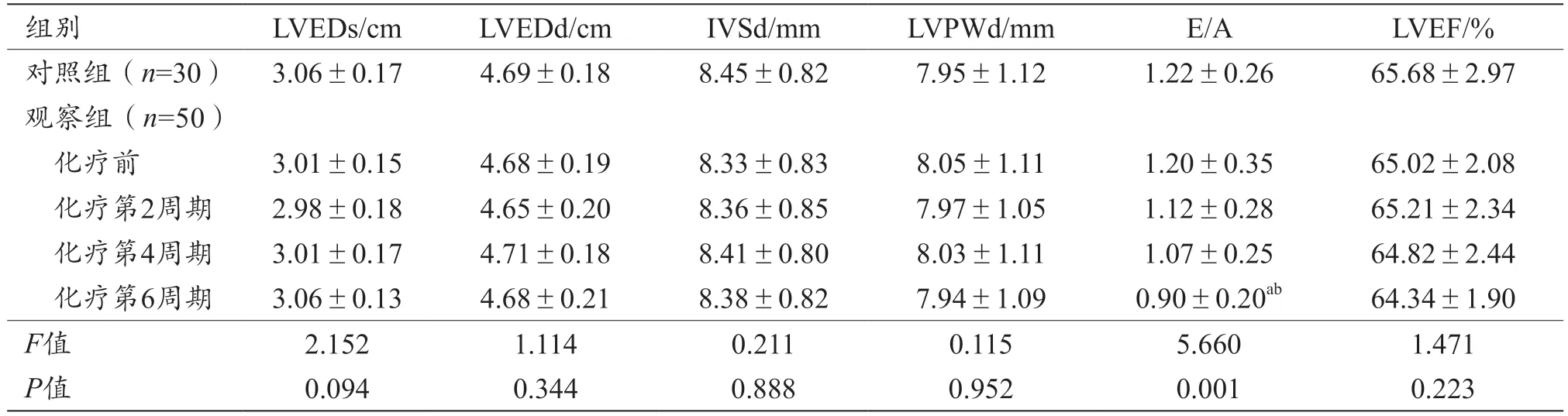
表1 对照组与观察组常规参数比较(±s)
注:aP<0.05,与对照组比较;bP<0.05,与化疗前比较。LVEDs:左心室收缩末期内径;LVEDd:左心室舒张末期内径;IVSd:室间隔厚度;LVPWd:左室后壁厚度;LVEF:左心室射血分数。
组别LVEDs/cmLVEDd/cmIVSd/mmLVPWd/mmE/ALVEF/%对照组(n=30) 3.06±0.174.69±0.188.45±0.827.95±1.121.22±0.2665.68±2.97观察组(n=50)化疗前3.01±0.154.68±0.198.33±0.838.05±1.111.20±0.3565.02±2.08化疗第2周期2.98±0.184.65±0.208.36±0.857.97±1.051.12±0.2865.21±2.34化疗第4周期3.01±0.174.71±0.188.41±0.808.03±1.111.07±0.2564.82±2.44化疗第6周期3.06±0.134.68±0.218.38±0.827.94±1.090.90±0.20ab64.34±1.90 F值2.1521.1140.2110.1155.6601.471 P值0.0940.3440.8880.9520.0010.223
2.2 3D-STI参数
观察组化疗第2、4、6 周期LVtw、MCI 低于对照组和化疗前(P<0.05),化疗第4、6 周期GLS 低于对照组和化疗前(P<0.05),两组GCS、GRS 差异无统计学意义(P>0.05),见表2。
表2 3D-STI参数比较(±s)
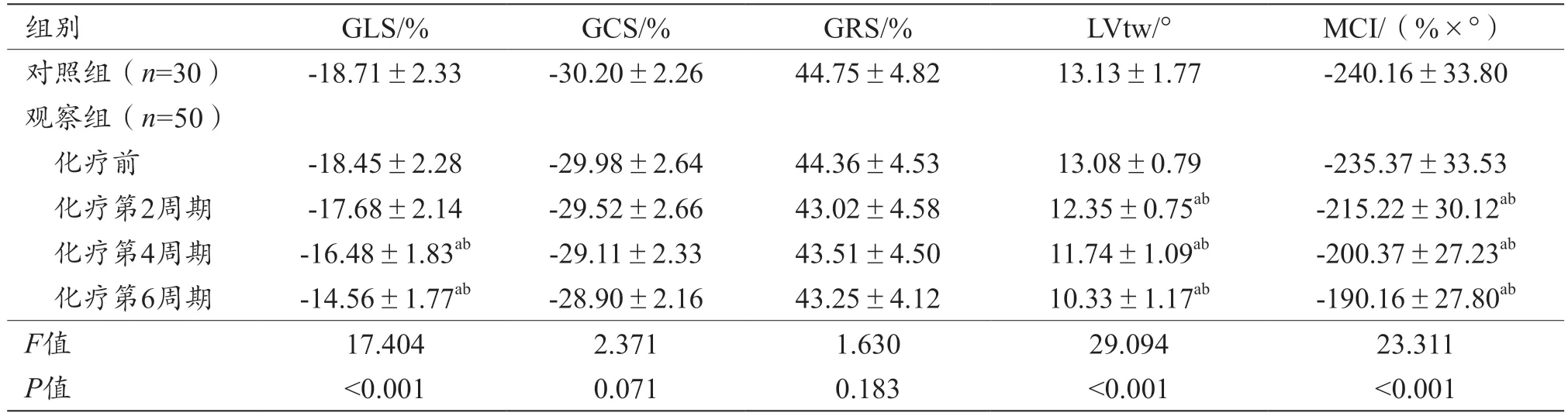
表2 3D-STI参数比较(±s)
注:aP<0.05,与对照组比较;bP<0.05,与化疗前比较。GLS:整体纵向应变;GCS:整体圆周应变;GRS:整体径向应变;LVtw:左心室扭转;MCI:心肌综合指数。
组别GLS/%GCS/%GRS/%LVtw/°MCI/(%×°)对照组(n=30)-18.71±2.33-30.20±2.2644.75±4.8213.13±1.77-240.16±33.80观察组(n=50)化疗前-18.45±2.28-29.98±2.6444.36±4.5313.08±0.79-235.37±33.53化疗第2周期-17.68±2.14-29.52±2.6643.02±4.5812.35±0.75ab-215.22±30.12ab化疗第4周期-16.48±1.83ab-29.11±2.3343.51±4.5011.74±1.09ab-200.37±27.23ab化疗第6周期-14.56±1.77ab-28.90±2.1643.25±4.1210.33±1.17ab-190.16±27.80ab F值17.4042.3711.63029.09423.311 P值<0.0010.0710.183<0.001<0.001
2.3 3D-STI参数评估心室功能变化价值
GLS、GCS、GRS、LVtw、MCI 的ROC 曲线下面积分别为0.972、0.657、0.619、0.945、0.891,最佳截断值(cut-off 值) 分别为-16.584%、-26.735%、43.055%、11.727°、-214.645%×°,敏感度分别为96.00%、30.00%、60.00%、92.00%、80.00%, 特异性分别为86.67%、96.67%、70.00%、83.33%、83.33%,见表3,ROC 曲线如图2 所示。

表3 3D-STI参数评估心室功能变化价值[n(%)]

图2 3D-STI参数评估心室功能变化价值的ROC曲线
3 讨论与结论
乳腺癌的病因是乳房腺上皮发生基因突变导致细胞增生失控,癌细胞组织学表现为大量癌细胞无限增殖,挤压并侵蚀周围正常组织,乳腺细胞丧失正常细胞特性,形成早期远端转移,因此乳腺癌成为严重威胁人类生命的恶性疾病[8]。目前临床关于乳腺癌侵袭和转移机制尚不明确,涉及肿瘤细胞外基质降解、肿瘤细胞侵入淋巴管、肿瘤细胞间黏附力降低、向外诱导血管生成等过程,从理论上讲,阻断上述过程中任一环节均可能阻断乳腺癌侵袭和转移。抗HER-2 药物具有较强抗癌作用,可显著提高患者术后生存率。但抗HER-2 药物还会引起头发脱落、抑制骨髓增生等不良反应,其中心脏毒性是最严重的副作用之一。关于抗HER-2 药物诱发心脏毒性机制包括氧化应激、钙超载、代谢产物及分子信号传导等,心肌细胞暴露于HER-2 抗体后,下调抗凋亡因子,增加促凋亡因子表达,导致心肌细胞凋亡[9]。还有研究显示,蒽环类药物多聚集在线粒体中,导致心肌细胞过氧化,而心肌细胞耗氧量比其他组织更多,故线粒体含量更丰富,同时其还会加重心肌细胞毒害[10]。
临床常用于评估抗HER-2 药物诱发心肌损害的方法主要有:心内膜活检、利钠肽、心脏CT、心脏磁共振、组织多普勒速度成像等[11-12]。常规检查方式在临床应用受限,导致患者错过最佳治疗时机,对患者心脏功能产生不可逆损害,进而影响临床治疗及预后,临床亟须寻找一种安全高效的方式评估早期左室收缩功能。3D-STI技术可从任何空间角度提供心脏结构实时三维图像,斑点跟踪技术是通过跟踪超声窗口内自然声反射和图样分析运动的图像处理算法,分析心室壁收缩和舒张功能,常用于各种心肌受累疾患的临床诊断中,二者结合可提供应变、扭曲等新变形参数[13]。3D-STI 通过追踪心肌斑点位置,获取心肌组织在三维空间内圆周、径向、纵向信息,与二维斑点追踪成像相比,可全面评价心脏局部、整体收缩和舒张功能[14]。通过三维心脏立体空间扫描检查过程中获取心肌声学斑点实时描绘心肌运动轨迹,获得心脏全容积图像,可更好地反映心肌功能。张艳等[15]研究显示,乳腺癌患者抗HER-2 治疗药物包括曲妥珠单抗、拉帕替尼等,均具有心脏毒性,而3D-STI技术参数作为预测患者心脏毒性的敏感指标。卜智斌等[16]研究显示,左心室扭转变化可检测蒽环类药物治疗患者左室收缩功能变化。
本研究中,观察组化疗第6 周期E/A 值显著低于对照组和化疗前,提示抗HER-2 治疗药物可较早影响左心室舒张功能。LVEF 在化疗过程中虽表现出降低趋势,但仍在正常范围内,无统计学意义,分析原因可能是心肌具有较强的代偿收缩能力,由此也说明LVEF 对评价心功能不够敏感。GLS、GCS、GRS 可测量心肌的形变发生程度,评价心功能变化[17-18]。GLS 体现的是收缩期各节段纵行心肌纤维发生形变增厚的程度,其可较敏感觉察早期心肌功能异常;GCS 体现的是收缩期各阶段心肌周长发生形变后变小的程度;GRS 体现的是收缩期各节段心肌在心脏横向上发生形变增厚的程度。3D-STI 技术评估心脏扭转运动的主要指标为LVtw,可作为化疗患者心肌亚临床损伤的有效指标,较应变参数更灵敏。 Mornoş 等[18]在研究抗HER-2 药物损害心肌亚临床时将GLS 与LVtw 结合,提出MCI,从应变和扭转的角度综合分析心肌运动,可客观全面地评价心肌亚临床功能。有学者提出,GLS 降低幅度大于15%即可说明心脏收缩功能已发生异常[19]。本研究应用3D-STI技术获得左心室GLS、GCS、GRS 等指标并引入MCI,评价左心室功能,结果显示,观察组化疗第2、4、6 周期LVtw、MCI 显著低于对照组和化疗前,化疗第4、6 周期GLS 显著低于对照组和化疗前,与既往研究结果相符[20-21]。ROC 曲线显示,GLS、GCS、GRS、LVtw、MCI 的ROC 曲线下面积分别为0.972、0.657、0.619、0.945、0.891,其中GLS 敏感度最高,为96.00%,GCS特异性最高,为96.67%。王宝震等[22]应用3D-STI 技术将心肌应变与心肌扭转结合,结果显示,LVtw、MCI检测抗HER-2 药物心脏毒性的ROC 曲线下面积最高,分别为0.891、0.873,MCI 敏感度为98.3%,LVtw 特异性为75.7%。这与本研究结果略有出入,可能与研究使用的样本量差异和机器类型不同有关。
综上所述,3D-STI 参数可评估乳腺癌患者抗HER-2药物化疗后心室功能变化,为临床早期干预提供诊断依据。本研究也存在一些局限性:① 样本量不足,随访周期不长;② 3D-STI 要求心内膜轮廓清晰,若患者存在手术疤痕,会导致图像效果不佳;③ 本研究得出的结论能否推广到临床中,还需更大样本量试验。今后可进一步开展大样本量、多中心试验,获得更客观的证据。
