内窥镜设备安全性评价在新旧标准中的差异要点解读
2024-05-13蒋硕万敏李庆雨裴晓娟张在爱冯乐菲陈一依张克
蒋硕,万敏,李庆雨,裴晓娟,张在爱,冯乐菲,陈一依,张克
1. 山东省医疗器械和药品包装检验研究院,山东 济南 250101;2. 国家药品监督管理局医用卫生材料及生物防护器械质量评价重点实验室,山东 济南 250101
引言
随着医学水平的发展和进步,光学医疗产业得到了快速发展,越来越多的光学治疗设备用于人体病变的诊断和治疗。1806 年,德国人Philipp 首创了硬性医用内窥镜,用于检查膀胱和尿道,打开了医用内窥镜的应用之路[1-2]。内窥镜的进一步发展,派生了“微创操作”的医学概念[3-5]。随着现代外科手术逐渐向智能化和微创化发展,内窥镜微创手术在全球范围内得到了快速推广,内窥镜医疗器械行业也在快速发展,各种内窥镜器械应运而生[6-7]。
内窥镜系统主要包括冷光源、摄像系统、内窥镜照明用光缆、内窥镜,有的还包括滚压式冲洗吸引器、液体膨腔泵、内窥镜附件等[8-10]。当然,现在也有一部分电子内窥镜不再采用传统的光学波导结构,而是整合了上述各部件,设计了全新的内窥镜系统结构[11-13]。内窥镜设备的安全与性能直接影响所观察区域的视觉效果,关乎患者的安全。新版9706 系列标准[14-15]已于近几年集中发布,其中,绝大部分在2023 年5 月1 日集中实施。本次标准的集中实施,一方面可快速推动行业的发展和进步;另一方面也给相关单位带来了标准理解方面的困难,许多生产企业一再表示一时难以掌握标准的变化,因此,尽快掌握新版标准精神要义对于科学有效地对此类产品进行质量控制十分重要。
1 相关标准
根据国内最新相关标准[14]规定,内窥镜是指通过自然腔道或手术创建通道进入人体体腔内,采用光学或非光学方式进行查看,用于检查、诊断和治疗的医疗器械;内窥镜设备是指预期用途所需的,和供给装置一起的带电内窥镜;带电内窥镜是医用电气设备的应用部分,利用能量进行内部观察或成像,包括仅通过光能传递的内窥镜;供给装置是直接与内窥镜相连接的医用电气设备的部分,因提供必要的功能而构成带电内窥镜,例如冷光源、摄像系统、气腹机、液体膨腔泵等。内窥镜设备涉及的电气安全通用标准GB 9706.1-2020[15]和配套安全专用标准GB 9706.218-2021[14]在2023 年5 月1 日同步实施,代替了GB 9706.1-2007[16]、GB 9706.15-2008[17]和GB 9706.19-2000[18]。根据《医疗器械监督管理条例》《医疗器械生产监督管理办法》的要求,医疗器械注册人、备案人应当确保其生产的相关产品符合强制性标准,另外,国家鼓励医疗器械注册人、备案人提前实施新标准。
新版标准较旧版标准而言有很大变化,具体到内窥镜设备的安全性评价,也有很多理念方面的变化。尽快掌握新旧标准的差异要点,有助于推动企业尽快完善产品设计或更新,加速产品满足上市要求;有利于促进行业的科学监管,保障人民的生命安全与健康。本文将对内窥镜设备安全性评价在新旧标准中的差异要点进行分析,以供相关人员参考。
2 内窥镜设备安全性评价在安全通用标准中的主要变化
2.1 基本性能
GB 9706.1-2020[15]引入了基本性能的概念。基本性能是指与基本安全不相关的临床功能的性能,其丧失或降低到超过制造商规定的限制会导致不可接受的风险。旧版的GB 9706.1[16]中并没有基本安全的概念。此次标准换版后,在电气安全通用标准、专用标准和电磁兼容并列标准中统一了基本性能的概念。对于制造商而言,需要通过风险分析识别产品是否具有基本性能。若具有基本性能,则需要制造商在风险管理文档中明确基本性能及其限值,评估相关风险,并实施风险控制措施以减少相关风险。对于内窥镜设备,制造商应注意,在识别基本性能时要考虑GB 9706.218-2021 中的增补条款201.4.3.101[14],该条款列出了内窥镜设备潜在的基本性能,见表1,产品基本性能的制定要遵从该专用标准的指导精神。型式试验和生产企业质量控制过程中也要注意标准中的一些条款与基本性能有关,例如机械强度试验后、电源中断又恢复后等,都不应导致基本性能的丧失。

表1 GB 9706.218-2021中补充的关于内窥镜设备潜在的基本性能列表
2.2 医用电气设备的超温
新版GB 9706.1-2020[15]中正常使用时的可能被触及部件、应用部分最高温度限值根据医用电气设备外表面可能接触的时间来规定,见表2~3。对比而言,旧版GB 9706.1-2007[16]则是直接规定了不同部位的温度限值,显然,新版标准的规定更尊重实际使用的情况。

表2 医用电气设备可能被触及部件容许的最高温度
此外,更大的差异在于新版GB 9706.1-2020[15]在超温的规定中引入了风险管理,例如,当临床受益应用部分需超过表3 中的温度限值时,制造商可通过科学合理的风险管理来确定温度限值,此种情况需要制造商在风险管理文档中增加收益优于任何相关风险的文档。
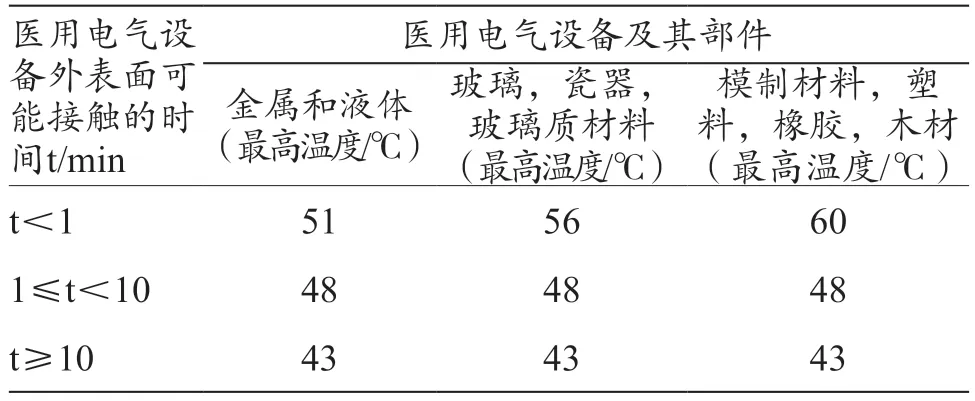
表3 医用电气设备应用部分容许的最高温度
对于内窥镜设备,比较常见的是冷光源、内窥镜照明用光缆、内窥镜等在一些光路窗口或接口位置的温度会超过上述限值。作为一种选择,制造商可通过风险管理确定临床影响,并进行收益风险分析,从而制定适合产品的温度限值。
2.3 防火外壳
GB 9706.1-2020[15]中新增了防火外壳的结构要求。其要求主要有2 个方面:一是防火外壳内的绝缘线、连接器、印刷电路板和安装在元器件上的绝缘材料应具有不低于标准规定的可燃性等级;二是防火外壳的结构对于底部、侧面开孔、挡板有着位置和数值的要求,同时外壳和挡板应为镁除外的金属或满足标准要求等级的可燃性非金属材料。
在内窥镜设备中,一些供给装置因为有散热需求,常常在主机机身上留有散热孔。旧版标准未此类结构加以限制,但是在执行新版标准时,特别是对于位于主机底部的散热孔,应注意其开孔的位置、尺寸和结构,必要时应加防护挡板。
2.4 清洗、消毒、灭菌
对于内窥镜设备中的内窥镜、内窥镜照明光缆等应用部分,制造商通常会在说明书中规定其详细的清洗、消毒、灭菌程序。对于在说明书中明确清洗、消毒、灭菌方法的医用电气设备,GB 9706.1-2007[16]要求重复进行20 次消毒或灭菌后,不损坏或影响其安全防护性能。
而GB 9706.1-2020[15]中规定这些部件应能承受使用说明书中规定的清洗或消毒过程,同时不损坏或使其安全防护劣化。这就要求制造商评估这些部件在预期使用寿命期间内多次按使用说明书规定的方法进行清洗/消毒的影响,并确保这些过程不会导致基本安全或基本性能的丧失;同时要对其进行一次消毒,消毒后不会出现会导致不可接受风险的劣化迹象,且能通过电介质强度和漏电流试验。GB 9706.1-2020[15]还规定,预期进行灭菌的部件,应形成评估文档,且经过灭菌程序后不能出现导致不可接受风险的劣化现象,并能通过电介质强度和漏电流试验。显然,对于清洗、消毒和灭菌方法的确定,两版标准对于验证次数和文档要求方面存在一定的差异。新版标准需要制造商在产品设计研发阶段就将清洗、消毒和灭菌方法纳入风险管理的范围。
2.5 可用性
新旧标准的一个重要差异是在GB 9706.1-2020[15]中增加了对可用性的要求,制造商应通过可用性来考虑可用性不足的风险,降低与设备控制器和指示器相关的风险。可用性旨在考虑用户接口的有效性、效率、用户医学性和用户满意性,它既打破了以往安全性评价中正常状态和单一故障状态的固有评估角度,又考虑了人类行为习惯、能力限制、合理误用等情形引入的风险。对于该变化,制造商首先需要做的是规定产品的应用规范和经常使用的功能,再进行与可用性有关的危险(源)和危险情况的识别。在这个过程中,对于内窥镜和光缆,要特别注意识别产品是预期一次性使用还是可重复使用,是无菌形式提供还是有用户灭菌。基于这些问题,对于包装、标识、灭菌方式等进行评价;对于冷光源,宜充分考虑是否有不希望的能量输出,特别是高能辐射光的辐射带来的不良影响;对于摄像系统,要基于接口条件,考虑错误连接的可能性、接口通信可靠性是否会影响图像的真实性和实时性。针对不同的内窥镜设备,要确定基本操作功能,编制可用性规范,并通过适宜的方式进行可用性验证和确认[19]。此外,可用性方面,GB 9706.218-2021[14]规定,如风险管理过程中没有与可用性相关的不可接受的风险出现,那么可用性方面的要求则不适用。
3 内窥镜设备安全性评价在安全专用标准中的主要变化
3.1 定义和范围
要掌握内窥镜设备新旧版标准的差异,首先要理解两版标准的定义和范围。旧版标准GB 9706.19-2000[18]和新版标准GB 9706.218-2021[14]中一些定义的名称发生了变化,旧版标准中的内窥镜附件和供电装置分别对应新版标准中的内治疗器械和供给装置。
旧版标准GB 9706.19-2000[18]规定的范围是内窥镜设备和内窥镜附件互连条件的安全要求,而新版标准GB 9706.218-2021[14]则规定了内窥镜设备的基本安全和基本性能,连同其相关的互连条件和接口条件。值得注意的是,两版标准均提到了互连条件,但是这两个互连条件的范围却有很大不同。GB 9706.19-2000[18]提及的互连条件中的内窥镜附件是指同内窥镜一样通过患者内相同的孔道插入患者体内的附件;而在GB 9706.218-2021[14]中的互连条件,则既包括通过内窥镜相同孔道,也包括通过第二或附随的孔道进入患者体内的情况。因此,新版标准扩大了适用范围。基于该变化,一些并非通过相同孔道进入患者体内的互连情况容易被忽视,例如与内窥镜共同使用高频手术设备通过第二孔道进入患者体内,并与内窥镜设备结合使用,制造商应当在风险管理过程中考虑该情形下对患者或操作者造成的热危害和其他风险。
3.2 应用部分
旧版标准中,应用部分是指正常使用的设备的一部分,包括设备为了实现其功能需要与患者有身体接触的部分,或可能会接触到患者的部分,或需要有患者触及的部分。在新版通用标准中,应用部分是指为了实现功能,在正常使用时需要与患者身体接触的部分,也包括通过应用风险管理过程的结果需要被作为应用部分却不满足应用部分定义的部分。在内窥镜设备中,与患者接触的典型部件是内窥镜的插入部分,至于内窥镜的接口、内窥镜照明用光缆等部分是否为应用部分仍有待商榷。旧版内窥镜设备专用标准也未对此作进一步指导,新版的GB 9706.218-2021[14]中则提到“本文件规定光导电缆是医用电气系统与患者接触的应用部分,除非风险管理文件表明另有特别配置”以及供给装置中“摄像机也是应用部分”,可见根据新版专用标准,内窥镜整体、光导电缆、摄像机均是标准认为的应用部分,当然风险管理文档可另作分析说明。应用部分的定义不可避免地影响着电击危险的防护、超温、标识、标记和文件等条款的执行,因此制造商应在设计阶段就逐步明确应用部分的范围。
3.3 辐射安全
内窥镜设备涉及可见电磁辐射的设备,旧版标准并未对此有明确的要求。对于可见电磁辐射、红外线辐射、紫外线辐射,新版专用标准要求制造商在风险管理过程中给出相关风险,这就需要制造商在设计阶段就开始对电磁辐射相关风险进行分析、评估和控制。
3.4 高频互连风险
对于与高频手术设备互连使用的风险,旧版专用标准规定高频手术设备应用部分的内窥镜附件和内窥镜共同使用时,相互之间必须提供有效的隔离和(或)绝缘,以防止由于热量的释放对患者和操作者产生安全性伤害。隔离和(或)绝缘可由内窥镜附件或内窥镜二者提供,且应有具体的互连试验来验证隔离和(或)绝缘性能。新版标准评估该风险时,首先要求制造商在风险管理过程中对二者结合使用的风险进行说明。带电内窥镜和带电内治疗器械均作为高频手术设备的一部分时,二者应绝缘,防止其受到电容耦合高频电流的热效应伤害。制造商应通过风险管理过程确定电容耦合高频电流是否可能从带电内窥镜器械传导到外露导电部分,若存在该可能,则需要通过试验测试电容耦合高频电流是否超过限值。
3.5 电磁兼容性
关于内窥镜设备对电磁兼容性的专用要求,新版标准变化也较大。旧版专用标准主要补充了对超声内窥镜及其供电装置、与体外碎石相连的内窥镜附件及其医用电气设备、与组织的超声波吸引相连的内窥镜附件及其医用电气设备的要求。而新版专用标准则增补了具体几例抗扰度的符合性准则,一定程度上改变了产品设计要求。例如,供给装置的操作面板显示清晰时会出现照明或图像显示的短暂干扰或被重置为“待机”模式,这在旧版专用标准的规定中是不符合准则要求的,但在新版专用标准中则被认为是可接受的故障。可见,新版标准更注重从风险的角度出发,当故障不会导致不可接受的风险时,可能会被认为是可接受的故障。
需要注意的是,新版专用标准还根据内窥镜产品的特殊性,进一步明确了一些试验要求,弥补了旧版标准一些不明确的地方。例如,新版标准规定了对于仅通过光能传递的内窥镜,如果其使用时的隔离由供给装置提供,则这类内窥镜不再需要进行新版通用标准中的电气安全型式试验;再例如,使用前需要灭菌的部分在相关测试前可不进行潮湿预处理,但应替代通用标准中的清洗、消毒和灭菌过程。
4 讨论与结论
新版9706 系列标准[14-15]发布以来,相关单位先后几次组织了集中的标准宣贯。但由于标准繁多,单个标准的分析讲解仍存在一定的局限性,目前在执行新版标准方面尚未有针对内窥镜设备特殊性的分析研究。正因如此,一年多来,本研究团队收集了很多内窥镜设备生产企业在针对新版标准进行产品设计和质量控制中遇到的疑问和难题,针对不同的内窥镜设备进行了系统的针对性分析,以便相关单位和人员快速、精准地掌握标准的变化和相关注意事项。
内窥镜设备作为一种逐步成为主流应用的诊断和治疗辅助设备,近年来获得了行业内的很多关注,在应用技术层面还在不断发展。电子内窥镜、胶囊内窥镜、荧光光源、5K 摄像系统的出现,也在不断唤起内窥镜设备领域的新生机。新技术的发展也得到了国内很多资金项目的支持,未来将继续面临技术的迭代更新。
本文依据内窥镜设备的工作原理、结构特征和主要功能,分析了其在执行安全性标准时,在新旧版本中的主要差异要点,并对差异要点进行了分析解读,为此类产品的设计开发提供了一定的思路,为产品质量评价体系的完善提供参考。
