金属及碳基材料电催化还原CO2研究进展与展望
2024-05-12赵峻标于秋阳郝海刚
赵峻标,于秋阳,姜 洋,郝海刚,高 瑞
(内蒙古大学 化学化工学院,内蒙古自治区 呼和浩特 010021)
0 引 言
化石燃料的开发利用,为人类社会带来巨大进步。然而也造成了严重的能源短缺、温室效应等问题[1-2]。从碳循环角度看,大气中过量CO2的存在与紧缺的含碳化石燃料之间的矛盾,表明地球碳平衡已遭受严重破坏。为此,我国于2020年提出了“双碳”政策。由于CO2过量排放,碳中和成为最重要的环境目标之一,因此将CO2还原成有价值的化学物质或燃料,是解决碳循环,实现碳中和的重要策略[3]。
回顾过去32年的全球CO2排放量,与能源消费相关的CO2排放量由1990年的200亿t增至2023年的372亿t,增幅超过86%[4],相应地,大气中CO2体积分数于2023年达到421×10-6,比350×10-6的安全上限高出了20%[5]。从攀升趋势来看,除去2008年全球金融危机爆发和2019年COVID-19病毒大流行外,CO2排放量基本急剧上升[4]。因此亟需开发领先的技术手段减少大气中CO2浓度。
就目前技术而言,减少大气中CO2浓度仍艰巨,原则上有3种可行的策略[6]:降低CO2的排放;存储CO2;转化与利用CO2。从源头上降低CO2排放需要工业生产打破化石能源传统利用模式,开拓化石能源利用的新方法,提高能源转化和利用效率,同时政府出台政策,积极优化能源结构。存储大气中的CO2需将CO2从固定排放源排放的尾气或其他气体中分离并存储,碳捕集与封存(CCS)技术仍存在高成本的压缩与运输以及泄漏风险等[7-10]。与前二者相比,转化CO2是一种更有前景的清洁解决方案[11]。利用CO2还原为C1产物乃至其他多碳产物,不仅可缓解大气中CO2排放,还能生产一些有价值的燃料和工业化学品,可为能源领域提供新的燃料供给[12]。因此,大力发展CO2转化技术是当今减少大气中CO2浓度最有潜质的途径之一。
笔者总结了CO2转化技术、电催化还原CO2原理、主要产物、反应途径、评价参数和催化剂材料的选择和影响等。基于目前发展迅速的金属基及非金属碳基材料电催化剂进行综述。金属基、非金属碳基材料以及其复合材料是目前研究热点,通过新的制备手段和更深入的机理探究,可进一步挖掘其在CO2还原上的应用。最后,对电催化还原CO2研究进行总结与展望,以期促进CO2RR发展。
1 CO2转化技术现状

近年来,研究人员在CO2转化方式上进行大量研究,主要CO2转化技术分为生物转化和化学转化。由于生物转化CO2是利用或模拟自然界中植物和微生物等自然光合作用过程,所以CO2转化速率和生物效率受限,存在环境和生态风险,且应用规模小。相比之下,化学转化CO2可通过设计和调控催化剂及器件等条件达到理想的选择性和转化率,已成为当前研究热点。化学转化是将CO2在能量场作用下催化转化成CO、HCOOH、C2H5OH等碳氢化合物[11],主要分为催化加氢[14]、光电化学还原[15]和电催化还原[16]。
催化加氢是在高温高压下,外加可再生H2,利用催化剂的作用将CO2还原并合成化学品。该过程能产生如CO、甲醇、甲酸、碳氢化合物和乙醇等多种燃料和化学物质。此反应过程的主要挑战是高氢气消耗量和高工作压力,并且由于存在不可避免的多种反应路径,实际催化过程中会同时形成不同产物(如CO、甲酸、甲醇、高级醇等),很大程度上降低目标产物的选择性[17-21]。“萨巴蒂尔反应”于1912年通过催化加氢将CO2转化成CH4[22],之后,“费-托法”以合成气(CO、H2和CO2混合物)为原料,合成碳氢化合物(CH3OH、C2H5OH等产品)。CO2催化加氢生产的甲醇是目前工业广泛应用的最重要产物之一,高效稳定的甲醇催化剂已成为当下研究重点。CO2催化加氢制甲醇技术最大问题之一是氢源,直接决定该工艺的经济性,其次,仍需通过改进催化剂提高其转化率和选择性,且催化加氢的苛刻反应条件也在一定程度上限制其应用前景[14]。
光电化学还原是在能量输入相对较低的温和条件下,利用具有特殊能带结构的半导体光催化剂,由太阳能等外部光源激活,从而产生光电子和空穴[15],以实现光催化还原CO2为碳氢化合物,被称为“人工光合技术”。光化学还原CO2实现了太阳能到化学能的转化,是达成自然界碳循环平衡过程中前景广阔的的转化方法[23]。然而,受太阳能的强间歇性、波动性等局限,导致CO2转化效率和有用化学产物选择性很低,在技术上难以实现大规模应用。因此,如何开发高效的催化剂、实现太阳能有效利用等问题是光催化还原CO2面临的巨大挑战。
相比催化加氢和光电化学还原方法,电催化还原CO2(CO2RR)具备更多优势:① 温和的操作条件(常温常压反应),更高的安全性;② 由清洁的可持续能源为反应提供动力,达成人为的闭合碳循环,完全实现能源的绿色循环;③ 电解池装置分为阴极区和阳极区2部分,相互隔离的两极各有产物,还原产物在阴极电极上产生,分离收集难度小;④ 具有广泛的产品分布,可通过设计催化剂、调整各种应用参数加速反应速率和控制产品的选择性;⑤ 廉价的无机盐电解液接近中性,且可完全回收利用,使整体化学品消耗量最小化;⑥ 电化学反应器模块化、反应紧凑,易开展规模化试验并放大应用;⑦ 电催化氧还原反应(ORR)和析氢反应(HER)的发展为CO2RR研究提供丰富理论和经验,有助于CO2RR重要框架的构建。CO2RR技术更适合生产碳氢小分子化合物的精细化工,迄今已实现小规模运行。
综上所述,就现有CO2转化技术而言,CO2RR呈现出独特的工业应用优势,在研究和应用方面展现出卓越的前景。
2 电催化还原CO2技术
2.1 电催化还原CO2的原理

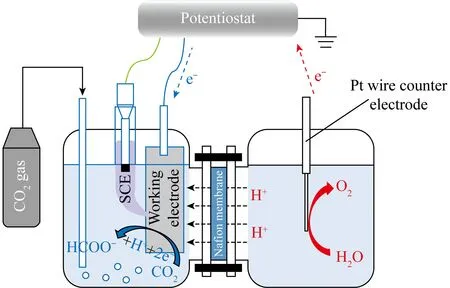
图1 电催化CO2还原反应装置[24]
2.2 电催化还原CO2的产物及反应途径


表1 电催化还原CO2各产物的反应路径和对应的平衡电极电势[29]
由表1可直观看出析氢反应(HER)与CO2RR产生目标产物所需电势相近。因此,实际反应过程中,析氢反应成为竞争反应。为实现高效的CO2还原并产生目标产物,必须克服析氢反应的竞争,这是一项具有挑战性的任务[30]。此外,不同反应路径之间的平衡电势差异相对较小,使CO2成功还原为特定目标产物更加困难。

对于CH4、CH3OH和HCHO,理论和试验研究表明,*CO是CO2RR反应的主要中间体[35-36]。通过*CO进一步加氢,可生成*HCO、*H2CO和*H3CO中间体,其中*H2CO中间体解吸可生成HCHO,*H3CO中间体可还原为CH3OH。目前,从*CO到CH4的转化主要有2种反应路径:① 由NIE等[37]提出,通过*COH中间体还原为*C的过程生成CH4,即*C被逐步还原为*CH、*CH2、*CH3,直至最终生成CH4。这一假设的可行性在后来铜负载聚合物氮化碳催化剂上的CO2还原计算中得到了验证[38]。② *CO→*CHO→*CHOH→*CH→*CH2→*CH3→*+CH4路径,这一路径由ZHANG等[39]通过理论和试验相结合的方法证实,是在-1.0 V(相对于标准氢电极)条件下还原生成CH4最受青睐的路径。
在CO2还原为C2+产物的途径中,认为*CO中间体的后续还原反应决定了催化剂在电催化CO2过程中最终生成何种C2+产物[40]。如C2H6的形成过程是*CO通过质子耦合电子转移形成*CH,随后质子化形成*CH3,最终,*CH3经过二聚反应形成C2H6;而对于形成CH3COOH(或CH3COO-),则是通过共插入*CH2实现[41]。CO2RR生成常见的C1和C2+产物的可能反应途径如图2所示。

图2 CO2RR常见产物的反应路径[42]
2.3 电催化还原CO2中重要评价参数
目前报道中性能评价参数有起始电位、法拉第效率、电流密度、塔菲尔斜率、电化学阻抗、电化学活性表面积、转化频率、催化稳定性等。需要注意的是,电催化还原CO2的性能不仅受催化剂本身影响,还与电解液、反应装置、电极类型等因素有关。
1)起始电位。CO2分子首先需在外加电位下提供能量,进而活化被激发成反应中间体才能进行CO2RR步骤。初步生成产物时的外加电位即为起始电位,由于实际CO2RR过程中不可避免的动力学壁垒及能量损耗,通常情况下,起始电位比理论值更负。理论还原电位和起始电位的差值即为过电位。到达起始电位后,CO2RR产生的电流密度显著增大。起始电位是评估CO2RR催化剂性能的重要指标之一,所需过电位越低说明反应越容易发生。
2)法拉第效率。法拉第效率是评估CO2RR催化剂性能最关键的指标,直观反映单个产物的选择性。其定义为生成某一产物所需电荷量与通过电路传递的总电荷量的比值,代表着反应电流的利用效率。催化剂对特定产物的选择性与其法拉第效率呈正相关,即法拉第效率越高,催化剂越有利于生成该产物。研究表明,大多数产物的法拉第效率与外加电压之间的关系呈现出典型的火山型分布[43]。
3)电流密度。电流密度分为总电流密度和各个产物的部分电流密度。总电流密度是试验中测得的总电流与工作电极面积比值。而分电流密度则是总电流密度与不同电位下该产物法拉第效率的乘积[44]。二者的接近程度体现出CO2RR生成目标产物活性大小。由于受到CO2在水溶液中溶解度及在碳酸氢盐中扩散速率的影响,大多数在H型电解池中进行的反应对产物的分电流密度通常低于50 mA/cm2[45-46]。
5)电化学阻抗。在CO2RR中,利用电化学阻抗谱(EIS)曲线拟合结果可评估催化剂在反应过程中的阻抗大小。阻抗值反映了CO2RR反应中的动力学和传质特性。阻抗越小,意味着传质速率越快,越有利于电催化还原CO2反应进行。
6)电化学活性表面积。电化学活性表面积(ECSA)与活性位点数量紧密相关,由于ECSA与双层电容(Cdl)之间存在线性关系,通过在非法拉第电势区间测量不同扫速下的循环伏安曲线(CV)可确定Cdl,进而计算得到催化剂的ECSA,对参与电催化还原反应的有效面积做出判断。
7)转化频率。转化频率(TOF)是单位时间内每个催化活性中心上转化生成目标产物所发生的电催化反应次数,反映电催化剂的本征活性[48]。因此,在评估不同催化剂的转化频率(TOF)时,通常无需关注具体的几何尺寸或催化剂负载量等参数。当前大多数研究中,常假定催化剂所有活性点都参与电化学反应,这样的假设导致计算所得TOF偏低。然而,TOF仍能为探究催化剂的本征活性提供重要信息。
8)催化稳定性。催化稳定性是在催化过程中,催化剂能够保持原有的催化活性、选择性和原有结构特性的能力。通常使催化剂在最佳电位下进行长时间还原反应,并测量该时间段内电流密度和目标还原产物的法拉第效率。稳定性越好的催化剂,其电流密度和还原产物的法拉第效率下降幅度越小。
3 电催化还原CO2催化剂研究进展
早在20世纪初期,已开启CO2RR领域的金属催化剂研究,汞(Hg)、钯(Pd)等具有高析氢过电位的金属材料是研究重点,甲酸(盐)是这些材料主要还原产物[49]。随着研究不断深入,金(Au)、银(Ag)、锡(Sn)、铋(Bi)等金属逐渐并应用到CO2RR中。研究表明,选择合适的催化剂对于降低电催化还原CO2反应中的活化能至关重要,这一过程可显著减少催化反应所需过电位,同时增强目标产物的选择性和提高电流密度[50]。值得注意的是,整个还原反应主要在电极表面进行,说明选用的催化剂材料不仅对还原产物种类具有决定性影响,还影响反应过程的电流密度。因此,在CO2RR研究领域,电极材料的筛选与改进成为重点[51]。如今,金属基材料已成为CO2还原反应电催化剂的主导力量。根据现有研究,图3虚线框内的金属均被证明具有电催化还原CO2的能力[52]。

图3 可作为CO2RR 催化剂的金属元素[52]
在诸多催化领域中,Au、Ag和Pd等贵金属催化剂均表现出优异的催化活性和耐久性,这同样适用于CO2RR反应。这些贵金属具有空的d电子轨道,可有效形成配位键并参与反应。此外,还具有较小的能级间距,表现出强大的配位能力和多样的配位方式。同时,由于Au、Ag和Pd等贵金属催化剂与*CO中间体结合能较低,导致生成的CO很容易从电极表面解离[53],这正是其具备良好的电催化还原CO2为CO性能的重要原因之一。然而,由于贵金属较高的价格及资源稀缺,其规模化应用受到了极大限制。
因此,研究重点转向成本更低、资源更丰富的非贵金属催化剂,这些催化剂在CO2RR中已取得了很大进展[54-56]。随科学水平进步和表征技术发展,非贵金属催化剂的研究与开发正稳步前行,促进了开发成本效益高、效率优异的催化剂,这些催化剂有望在CO2RR中替代或部分替代传统贵金属基催化剂。这不仅提供了新研究方向,也为实现更加可持续的化学转换过程开辟新途径。
3.1 贵金属催化剂
金(Au)、银(Ag)、钯(Pd)等贵金属由于其未填满的d电子轨道,表面具有较强的吸附能力,能有效吸附反应物形成中间活性物,因此展现出卓越的电催化性能。此外,还具备抗氧化、耐高温、耐腐蚀等特性,因而被认为是最理想的贵金属催化剂材料[57]。目前已有大量研究证明,在适中电位下,贵金属能有效将CO2还原为CO或C2+产物[58-60]。
近年来,金属-氧化物界面因其独特的催化性能,在许多催化领域广泛研究。SONG等[61]使用贵金属Pd设计合成了一种Pd/Cu2O纳米立方体,该催化剂通过Pd纳米颗粒修饰Cu2O界面,提供稳定的*H中间体,反应过程中有效控制界面处氢态,从而抑制HER反应,并提高了催化剂对C2H4的选择性。此外,Pd和Cu2O界面之间的直接键合增加了活性位点的电荷密度,激活了Pd-Cu界面上的*CO,形成稳定的*CHO,增强了*CHO与*CO中间体的耦合,因此使Pd纳米颗粒改性后的催化剂C2H4/H2产率由0.4显著提高至2.0,提高近5倍。这一研究为设计具有优异活性和选择性的贵金属Pd改性的金属氧化物界面催化剂提供新方法,在CO2多电子还原过程中具有重要意义。
除已有的关于贵金属Pd催化剂的研究报道,对于Au电催化CO2还原的研究也取得深入进展。WANG等[62]制备的Au28(C2B10H11S)12(tht)4Cl4(缩写为Au28-S)纳米簇催化剂可高效还原CO2,其CO法拉第效率可达98.5%(图4)。Au28-S采用与所报道的炔基保护的Au28-C相同的Au28金属骨架,通过改变Au金属核的配体壳,导致其金属团簇的整体电子结构发生变化,价电子由Au28-C的13e-转变为Au28-S的12e-。相比Au28-C,该催化剂对CO的法拉第效率提升约1.4倍,CO分电流密度提升2倍以上。此外,还表现出不同的光学吸收特征,Au28-S的近红外发射强度增加5倍。通过密度泛函理论计算,表明Au28-S吸附*COOH反应中间体的吉布斯自由能ΔG更低,因此表现出更优异的催化活性和选择性。这项工作为研究金纳米团簇的保护层活性关系提供理想平台,也为金属团簇基催化剂未来设计提供指导。
与Pd和Au相比,具有相对较低成本且催化性能优异的贵金属Ag备受关注。LIANG等[63]开创了一种全新的原位吸附还原法制备了负载在CeO2上的Ag-SAC(Ag1/CeO2)单原子催化剂。Ag单原子通过强金属-载体相互作用锚定在CeO2上,每个Ag原子伴随3个界面氧空位,从而形成了协同双功能催化位点Ag-O-Ce3+原子界面。Ag1/CeO2在电催化还原CO2反应中表现出优越性能,H池中CO最高法拉第效率(EF(CO))高达99.5%,并在流动池中实现403 mA/cm2的工业级电流密度和97.2%的高EF(CO)。通过试验结果与密度泛函理论计算相结合,发现Ce—O结构被氧空位激活,作为Ag单原子吸附CO2和*COOH的协同活性位点,从而降低了Ag-O-Ce3+界面上*COOH向-*CO转化的能垒。
3.2 非贵金属催化剂
尽管上述一些贵金属催化剂展现出了优良的催化性能,但高成本和资源稀缺性限制其商业化应用。相比之下,非贵金属以低成本、丰富的地球储量和良好的催化活性等优点,成为备受关注的贵金属替代品。目前,研究发现不同非贵金属及其氧化物在电催化还原CO2的产物也不尽相同。如,Bi[64]、In[65]等金属主要催化产物为HCOOH(或HCOO-),Fe[66]、Ni[67]、Zn[68]等金属催化剂主要还原产物为CO,金属Cu[69]的还原产物组成相对复杂,可涵盖各类C1产物并产生多种C2+产物。
自发现金属Cu是唯一能独立将CO2还原为碳氢类产物的催化剂以来,对Cu的研究呈现出多样化趋势[69-71]。YANG等[72]合成了一种具有稳定Cu+-Cu0位点和富氧缺陷的硼掺杂CuxO催化剂(B-CuxO)。在初始CO2RR过程中,原始的B-CuxO催化剂被还原,并逐渐原位重建为Cu+和Cu0位点,且硼的掺杂促进催化剂中氧缺陷高度覆盖。在H池中,5% B-CuxO催化剂在-1.0 V(vs.RHE)下,12 h内表现出48.44%的C2+产物法拉第效率。通过结合密度泛函理论计算和原位结构表征,表明催化剂表面较高的电子损耗抑制了Cu位点周围的电子积累,从而保持正电荷并抑制Cu+的完全还原,证明Cu+-Cu0作为主要活性位点及氧缺陷对Cu位点电子结构的影响。这项研究为Cu+-Cu0位点和氧缺陷对CO2RR影响的作用提供了新见解。
最近,研究人员在CO2RR生产增值化学品上取得进一步突破。SANG等[73]利用固态合成法在铜基催化剂中引入Cu2P2O7结构,通过电化学还原原位重建具有丰富缺陷和大量低配位原子的多孔Cu。重构后的Cu2P2O7催化剂对C2+选择性最高可达73.6%(EF(C2H4)=39.8%,EF(C2H5OH)=23.8%),同时电流密度保持在350 mA/cm2。通过进一步原位拉曼光谱和DFT计算结果证明,低配位Cu原子改善了位于顶位和桥位的*CO吸附,优化了C—C耦合途径,且降低了C2+产物形成的能垒。CHENG等[74]报道了一种利用单宁酸(TA)分子自适应调节Cu基材料的原位分子修饰策略(图5,j为电流密度)。通过电化学原位重构的TA-Cu催化剂在-1.2 V电位下,电流密度为497.2 mA/cm2,C2H4法拉第效率达63.6%,相比生成CH4的初始Cu催化剂高约6.5倍。原位X射线吸收光谱和DFT计算研究表明,TA中羟基对于稳定Cuδ+起关键作用,Cuδ+/Cu0界面降低了*CO二聚化的活化能垒,此外,TA分子可通过氢键相互作用优化*CO+*COH中间体结合强度,促进*CO和*COH二聚化,进一步提高C2H4选择性。这种分子工程调节电子结构为实现高选择性CO2还原为增值化学品提供了一种有前途的策略。

图5 不同施加电位下获得的各种气态还原产物的EF和TA-Cu电解CO2的稳定性[74]
随着对非贵金属催化剂的研究不断深入,发现不仅Cu基催化剂具有电催化还原CO2能力,大多数过渡金属催化剂也可应用于CO2RR中。特别是改性后,如铁、钴、镍等具有较优异析氢性能的金属,其在CO2RR中的催化活性得到极大提升。目前普遍关注的方法是将过渡金属锚定在N掺杂的碳材料上,以形成“金属-氮-碳(M-N-C)”催化剂。CAO等[75]通过电纺热解协同策略将过渡金属Ni成功以双核原子的形式与4个氮和2个碳原子形成独特的桥接结构(即Ni2-N4-C2),热解温度由900 ℃调节至1 100 ℃,Ni-N-C纤维中的原子结构由单原子构型(Ni-N3-C、Ni-N-C-900)有规律地调节为双核Ni桥接结构(Ni2-N4-C2、Ni-N-C-1000)和碳基体上的小Ni团簇(Ni4-N-C、Ni-N-C-1100)。结果表明(图6),配位结构优化后的Ni-N-C-1000催化剂在H池中具有出色的能力,能高效将CO2电催化还原为CO,在-0.8 V(vs.RHE)下表现出96.6%的最大法拉第效率(EF(CO)),在-1.0 V下表现出4.6×103h-1的极高TOF,而在具有碱性电解质的流动电池中,在-0.5 V时EF(CO)更大(97.8%)。试验结果和理论计算表明,与氮和碳原子桥接的双核镍的独特化学结构调节了d态的电子性质,以优化CO2和中间体的吸附,从而通过热力学上更有利的途径诱导CO2还原显著增强。

图6 H型电池中的电化学CO2还原测试及产物分析[75]
SU课题组用羧基二茂铁预改性金属有机框架(IRMOF-3(Zn)),热解后成功将Fe纳米颗粒嵌入N掺杂海绵状多孔石墨碳结构中[76]。结果表明所制备的M-N-C材料具有较好的电催化还原CO2的性能,在H池中-0.6 V(vs.RHE)下EF(CO)最大达92.1%。且在流动池中-0.3~-1.1 V宽电位窗口内,均保持高于90%的EF(CO)。这种卓越的催化性能归因于Fe位点和氮掺杂碳基质之间的协同作用,改善了CO2吸附并加速了*COOH中间体的积累。
JIANG课题组精确构建了一种新型Fe1-Ni1-N-C催化剂,其相邻的Fe和Ni单原子对修饰在氮掺杂的碳载体上[77]。该催化剂在电催化还原CO2方面显著增强,远超具有单独Fe或Ni单原子的Fe1-N-C和Ni1-N-C。其在-0.5 V电位下实现了高达96.2%的EF(CO)。理论计算表明,单个Fe原子可通过非键相互作用被相邻的单个原子Ni高度活化,并降低*COOH中间体的形成能垒,显著促进*COOH中间体的形成,从而加速CO2整体还原。
这项工作提供了一种构建含有多种过渡金属的单原子催化剂的通用策略,并揭示了相邻单原子之间的协同效应,对改进M-N-C催化剂具有重要的意义。
3.3 碳纳米材料催化剂


图7 不同杂原子(N、B、S)的碳材料构型[85]
研究表明,由N原子掺杂的碳材料展现出较高的电催化还原CO2活性,已被证明是极有前景的非金属催化剂材料[86]。ZHANG等[87]将吡啶分子轴向接枝到N掺杂的碳纳米管上,构建出一种无金属氮掺杂碳纳米管复合催化剂。该复合催化剂的主要活性位点是碳纳米管中掺杂的氮,而吡啶作为助催化剂,不仅能显著促进CO2吸附,还能有效抑制HER。DFT计算进一步证明吡啶的氮原子能与关键中间体*COOH的氢原子形成氢键,从而降低生成*COOH的反应自由能,并稳定关键中间体。在-0.99 V下,其对CO的法拉第效率达96%,分电流密度为18.4 mA/cm2,而在宽电位窗口内,该复合催化剂的EF(CO)均保持在90%以上,性能优于大多数报道的无金属碳催化剂,甚至足以与金属催化剂媲美。
同时掺入2种杂原子也是提高碳材料催化性能的有效策略之一。CHEN课题组通过调控碳的杂化轨道巧妙设计了一种B、N共掺杂的无金属碳催化剂[88]。该催化剂包含嵌入相邻硼和氮位点的sp3/sp2杂化碳界面,界面处硼位点的电子结构和键合构型受到相邻氮位点和sp3碳的调节,而且由于sp3碳的引入,在B、N和C原子周围引发了电子密度重构,有利于生成稳定的*OCHO中间体,分别削弱了竞争*COOH和*H物种的硼-碳和硼-氢杂化。所设计的催化剂实现了无金属催化剂在H池中创纪录的甲酸盐分电流密度(高达50.8 mA/cm2),甲酸盐选择性保持在90%以上,并具有108 h的长期稳定性。这项工作不仅揭示了碳界面在提高CO2还原方面的关键作用,还为设计碳基无金属催化剂提供了新的指导方向。
4 结语及展望
目前对于CO2转化技术的研究发展迅速,本文综述了电催化转化CO2的原理、反应产物及途径、重要评价参数等。对于目前CO2还原催化剂的研究主要分为两大类:一类是金属基催化剂,包括贵金属的Au、Ag、Pd等,以及非贵金属的Cu、Ni、Fe、Zn、Bi、In等;另一类是非金属基的碳纳米材料,包括CNT、CNF、石墨烯等。虽然目前对于CO2还原技术已进行大量研究,但仍存在许多问题与挑战,亟需开发高效稳定的催化剂及高效的还原体系,以改善所面临的反应过电位高、反应活性低、产物选择性差、稳定性差等问题。改善与提高电催化还原CO2催化性能的可行建议与方法如下:
1)催化剂形貌和表界面的改性。提升电催化剂效能的一大策略在于增加和强化催化活性位点。为此,设计催化剂材料时,应旨在最大限度暴露活性位点,以此扩大其数量,并通过精确调节表面电子结构提升固有催化活性。鉴于金属纳米材料在电化学还原(电催化还原CO2过程中对结构高度敏感,通过调节尺寸、晶面、边界、成分、界面及配体修饰等方面进行结构优化,成为一种提高催化效率的有效途径。如金属纳米粒子(NPs)尺寸和形态会影响其表面的配位不饱和位点数量和化学吸附特性。金属合金催化剂中的几何和电子效应可调整关键中间体在催化表面的化学结合方式。同时,金属纳米材料与金属、金属化合物、载体、配体等其他组成部分的协同互作,能形成新的界面活性位点,从而优化关键活性物种的吸附与稳定性。
2)制备并利用复合材料。大多数催化剂的单一材料结构和较小的比表面积限制了其实际应用。通过在2种或更多种复合材料之间建立独特的相互作用,能同时增强催化剂的活性和稳定性。这种方法有效利用不同材料之间的协同效应,达到提升性能和保持稳定的双重目的。如金属-碳材料、金属-金属氧化物和金属氮化物-碳材料的结合都是具备应用前景的复合材料,能有效用于电催化还原CO2。
3)优化反应条件。合理的反应条件可显著提高电催化还原CO2的效率和产品选择性。主要外界影响因素包括电解质的选择、浓度、pH等。合理的反应条件可显著提高CO2还原的效率和产品选择性。以pH为例,电催化还原CO2作为一个气-液-固三相催化反应,其催化速度受反应物在液相中的溶解度影响很大。反应物除CO2,还有无处不在的H+,H+浓度越高,参与反应的质子电子对(H++e-)越多,加氢能垒越低。但随H+浓度上升,pH下降,促进析氢反应HER,相应地,催化剂表面的CO2RR受抑制[89-90]。因此,适当增加局部OH-密度,可促进CO2RR发生。值得注意的是,在OH-密度过大的碱性条件下,CO2可能与OH-离子反应生成碳酸盐/碳酸氢盐,从而增加电解液的整体电阻,易导致盐分积累,阻塞气体扩散通道,进而对CO2RR过程产生不利影响。此外,已有研究指出,较低的pH有利于产生CO2加氢还原的产物(如CH4),而较高的pH则适合形成CO等产物[91]。
4)改进CO2RR的反应装置。与传统H型电解池相比,目前主流气体流动池的传质效率显著提升,且电流密度大幅增加。但气体流动池相比,H型电解池稳定性差,难以保证长期连续运行。因此,尽管现有CO2RR反应装置在某些方面取得进步,但仍无法满足工业应用的高标准。未来发展方向应集中于设计和开发能在高电流密度下稳定运行的新型反应装置。
5)结合原位表征技术深入探究反应过程的变化机理。目前多数研究仅通过一些静态化学表征手段探究形貌结构及反应活性位点,但缺乏对CO2RR反应过程中的动态表征。如今,原位Raman光谱、原位红外光谱和原位XAS光谱等一系列动态表征技术已逐渐应用于深入研究催化剂活性中心在反应过程中的变化机理,从而为在本征结构上调控催化剂的合成与制备提供重要指导意义。
6)加深对催化剂活性位点及催化机理的探究。除通过原位测试技术揭示CO2RR的反应过程,DFT理论计算也是深入探究催化机理的强有力方法,CO2RR的反应路径当下仍缺少确切结论,仍需进一步采用DFT理论计算全面深入揭示CO2RR的反应过程。
