硫酸铵强化石膏溶解矿化制备高纯CaCO3
2024-05-12刘妍汝唐思扬李红娇
刘妍汝,钟 山,2,3,唐思扬,杨 柯,宋 磊,李红娇,梁 斌,4
(1.四川大学 化学工程学院,四川 成都 610065;2.四川发展环境科学技术研究院有限公司,四川 成都 610095;3.四川省工业废水污染治理及低碳资源化工程技术研究中心,四川 成都 610095;4.四川大学 新能源与低碳技术研究院,四川 成都 610207)
0 引 言
目前,CO2捕集利用与封存技术(CCUS)是减少碳排放和向低碳未来转型的国家发展战略的重要组成部分[1]。矿物质封存主要是矿物中的碱性离子与溶解的CO2反应生成稳定碳酸盐的过程,通过将CO2转化为固体碳酸盐,可实现CO2大规模永久储存[2],这是一种安全、经济、可持续的CO2封存技术[3]。CO2矿化可分为直接矿化和间接矿化2种方式[4]。直接矿化指模拟自然风化过程,利用活化处理矿化原料或引入氨水等碱性溶液,加速CO2矿化速率。间接矿化指先利用酸性化学试剂在低pH下提取分离原料中的钙镁等具有矿化活性的阳离子,再利用碱性化学试剂在高pH下吸收CO2后与溶液中钙镁等阳离子反应生成碳酸盐固体沉淀。
磷石膏是在磷酸肥料生产过程中产生的一种固体废弃物,目前国内磷石膏堆存量已达到4亿t,且每年新增约5 000万t[5]。磷石膏主要成分为CaSO4·xH2O,干基硫酸钙含量在70%~95%,另外含少量二氧化硅、氧化铝、五氧化二磷和氟等杂质,是一种碱性固废[6]。利用废石膏矿化固定CO2,如磷石膏、脱硫石膏等,不仅能同时处理工业固废和CO2,还能生成肥料、CaCO3等高附加值产品,实现双重废物的资源化利用[7]。CaCO3被广泛应用于纸张、塑料、橡胶、食品中的填充材料和医药产品,有较高利用价值,其中纯度及粒径等因素对CaCO3实际应用有重要影响[8-9]。
由于石膏固废化学成分复杂、分离纯化困难等因素,石膏矿化工艺存在成本与CaCO3产品品质难以兼顾的矛盾,矿化工艺流程优化及产物性能提升等关键技术亟待突破。
赵红涛等[10]将磷石膏加入硫酸和磷酸三丁酯的混合溶液中,90 ℃下密闭反应30 min后分离出上层含杂质的有机相和下层含净化石膏的硫酸水溶液,再将净化石膏和稀氨水混合均匀后在加压条件下矿化固定CO2,CaCO3纯度由86.5%增至99.1%。叶龙泼等[11]提出一种有机溶剂萃取与Ca2+矿化的耦合反应过程,以三丁胺为萃取剂将HCl从水相萃取到有机相,Ca2+矿化率达98.31%。DING等[12-13]利用强电解质氯化铵提取磷石膏中的Ca2+,再向Ca2+的浸出液中通入CO2制备高纯CaCO3,最后矿化产物为球形球霰石,纯度99.80%,白度99.2%。WANG等[14-15]提出一种综合吸收-矿化工艺,利用脱硫石膏对胺溶剂捕获的CO2进行解吸和矿化,并用ASPEN模拟计算得到CO2净固定效率为87.6%。
这些方法实现了石膏固废与CO2的矿化减排,但存在引入杂质离子,影响矿化产品纯度,增加分离回收成本等问题。吴林等[16]研究石膏矿化反应动力学,发现矿化反应过程中硫酸钙的溶解是矿化反应速率控制步骤,而硫酸铵的浓度对石膏溶解速率及溶解度有直接影响。硫酸铵作为石膏矿化反应产物,其循环反应不仅可促进矿化反应强度,还可避免引入杂质离子。
为探究硫酸铵对石膏浸取分离矿化过程的影响及强化作用,笔者以石膏矿化的液相产物硫酸铵作为浸取液,基于盐效应理论,采用相转移法,对硫酸钙进行溶解强化,固相中的钙元素溶出后,经过滤分离实现相转移,再以富Ca2+浸出液为矿化原料,通入CO2制备高纯球霰石CaCO3联产硫酸铵。该方法可在矿化固定CO2的同时获得高品质CaCO3产品,同时以矿化产品硫酸铵作为原料溶出剂,降低工业成本,为钙基固废的资源化利用提供新思路。
1 试 验
1.1 试验原料
为探究硫酸铵溶液对石膏矿化反应的影响,先后选用高纯硫酸钙试剂(w(CaSO4)≥99%)及磷石膏作为矿化原料,磷石膏化学组成见表1,选用硫酸铵(AR)作为钙溶出剂,选用氨水(AR,浓度为25%)作为浸出液pH调节剂及CO2吸收剂,CO2气体(99.9%)作为矿化碳源。另外,为表征溶液中钙离子浓度,选用氢氧化钠、乙二胺四乙酸二钠(EDTA-2Na)标准溶液和钙羧酸指示剂用作钙离子滴定。

表1 磷石膏的化学组成
1.2 试验方法
1.2.1 硫酸钙的溶解
称取一定质量的硫酸钙置于250 mL圆底烧瓶中,向圆底烧瓶中加入一定量的特定浓度的硫酸铵溶液,将圆底烧瓶置于恒温水浴锅中,搅拌速度为600 r/min,在25 ℃下恒温溶解一段时间后进行抽滤,滤液用于Ca2+浓度测定、后续的矿化反应与CaCO3制备,Ca2+浓度采用EDTA-2Na滴定分析,CaCO3的纯度按照GB/T 19281—2014《CaCO3分析方法》检测,物相采用X-射线衍射仪XRD分析,粒度分布采用Bettersize-2600E型纳米激光粒度分析仪分析。
硫酸钙溶解浸出过程如式(1)所示,采用单因素变量试验确定优化的溶解浸出工艺条件,硫酸铵物质的量浓度分别为0、1、2和3 mol/L;溶解时间分别为15、30、60、120和300 min。基于前期探索试验,溶解时间60 min时,探讨了硫酸铵浓度对硫酸钙溶解特性的影响,在硫酸铵物质的量浓度为3 mol/L时,探讨溶解时间对硫酸钙溶解特性的影响。

(1)
1.2.2 Ca2+浸出液矿化固定CO2制备CaCO3
硫酸钙经硫酸铵强化溶解后,经真空抽滤分离固液两相。量取200 mL Ca2+浸出液倒入烧杯中,向烧杯中加入一定体积的氨水,将烧杯置于恒温水浴锅中,当溶液温度达设定温度后,按150 mL/min流率向溶液中通入CO2,搅拌反应一段时间后出现白色CaCO3沉淀,对悬浊液进行抽滤,滤饼经过多次洗涤后在105 ℃下烘干,即得CaCO3产品,滤液经定容后测定Ca2+含量。
间接矿化流程示意如图1所示,试验研究了氨水浓度、温度及矿化反应时间对矿化反应的影响,该间接矿化工艺流程如图2所示,具体试验方案及条件见表2。

图1 间接矿化反应流程示意

图2 硫酸钙间接矿化工艺流程

表2 Ca2+浸出液矿化的影响因素研究及试验条件
1.2.3 磷石膏矿化

1.3 样品表征
利用XRD (中国丹东方圆仪器厂DX-2007型X射线衍射光谱仪,Cu靶(λ=0.154 056 nm),2θ在10°~70°,步进角度为0.03°,步进耗时为0.5 s,管电压40 kV,管电流30 mA对原料及产物的物相进行表征;利用激光粒度分析仪(中国丹东百特仪器有限公司Bettersize-2600E型纳米激光粒度分析仪)对产品CaCO3粒度分布进行表征;通过扫描电子显微镜(SEM,仪器型号为JSM 7610F,加速电压15 kV,分辨率1 nm)对矿化产品CaCO3形貌进行表征;通过EDTA-2Na法对浸出液和矿化产物中的钙离子含量进行表征;根据GB/T 19281—2014《CaCO3分析方法》对产物CaCO3纯度进行表征。
2 结果与讨论
2.1 硫酸钙溶解浸出强化

(2)

图3 (NH4)2SO4浓度及溶解时间对硫酸钙溶解量的影响
(3)
(4)
即
(5)
式中,α(i)为活度,mol/kg;γ(i)为活度系数;m(i)为质量物质的量浓度,mol/kg;Kap为硫酸钙溶度积常数,仅与温度有关,(mol/kg)2;γ±为平均离子活度系数;Ksp(T)为硫酸钙浓度积,(mol/kg)2;i为组分。
根据前期研究,硫酸铵物质的量浓度超过3 mol/L时,不利于硫酸铵继续溶解硫酸钙,一方面,硫酸铵溶液与硫酸钙溶液形成共饱和溶液后,易析出固体形成铵石膏的新物相,溶液体系中固体样品的XRD图谱如图4所示,另一方面,由试验现象可见,高浓度硫酸铵会增加溶液黏度,不利于溶解,并增加物料的搅拌与泵送能耗。所以,选用3 mol/L作为优化的硫酸铵浓度条件。

图4 3.0和3.2 mol/L硫酸铵-硫酸钙溶液体系中固体样品的XRD图谱
溶解时间对硫酸钙溶解量的影响如图3(b)所示,溶解15 min时,硫酸钙的溶解量为5.50 g/L,时间增至30 min时,溶解量增至5.62 g/L,时间继续增加,溶解速度增加缓慢,当溶解时间延长至300 min时,溶解量仅为5.68 g/L。为提高生产强度,选用溶解浸出时间为30 min。
2.2 浸出液分离矿化制备CaCO3工艺
2.2.1 氨水浓度对矿化反应及矿化产物的影响


图5 不同氨水浓度条件下硫酸钙浸出液的矿化反应转化率、矿化产物粒径分布和矿化产物XRD图谱
由图5(a)可知,氨水物质的量浓度为0.6 mol/L时,Ca2+矿化率,即硫酸钙转化率不高,仅为87.9%,提高氨水物质的量浓度至1.2 mol/L,Ca2+转化率提高至93.3%,增至1.5 mol/L时,Ca2+转化率达95.9%,继续增至1.7 mol/L时,Ca2+转化率略升至96.2%。氨水在本体系中提供碱性环境,加速CO2吸收溶解,浓度较小时,溶液吸收CO2速率慢,矿化生成CaCO3速率低,即结晶反应推动力较低,在相对较短的矿化时间内,矿化反应不完全,因此反应转化率不高;提高氨水浓度,单位体积溶液中溶解的CO2增多,CaCO3浓度升高,CaCO3过饱和度增大,即反应推动力增大,且较高的碱性环境利于CaCO3沉淀,因此反应更完全,转化率提高。
不同氨水物质的量浓度条件下Ca2+浸出液矿化制备的CaCO3产物粒径分布变化如图5(b)所示。氨水物质的量浓度为0.6 mol/L时,反应不完全,产物尺寸较大,提高浓度,CaCO3的D50降低,氨水物质的量浓度为1.2 mol/L时,产物CaCO3的D50为3.95 μm,进一步提高氨水浓度,产物CaCO3粒径反而增加,即随氨水浓度升高,产物CaCO3粒径先减小后增大。这是由于在氨水未过量的情况下,提高浓度可促进CO2溶解,增加CaCO3浓度,有利于CaCO3成核,此时晶体成核增长速率大于晶体生长增长速率,因此增大氨水浓度可生成数目更多粒径更小的CaCO3产物;但随着氨水浓度继续增加,晶体生长速率大于成核速率,晶体粒径增大,同时溶液中生成的碳酸根富集,可能导致颗粒团聚,从而导致颗粒尺寸增大。对不同浓度条件下制备的矿化产品CaCO3进行XRD表征,结果如图5(c)所示,所得矿化产品均为球霰石型CaCO3。尽管氨水物质的量浓度为1.2 mol/L时轻质CaCO3产品粒径为3.95 μm,但此时Ca2+转化率为93.3%,当提升氨水物质的量浓度至1.5 mol/L时,Ca2+转化率提高至95.9%,提高浓度至1.7 mol/L时,Ca2+转化率提高不明显,综合考虑,选取1.5 mol/L作为优化的氨水浓度。
2.2.2 温度对矿化反应及矿化产物的影响
在CaCO3成核和生长过程中,温度对成核速率和生长速率有重要影响,同时温度还会影响溶液中离子的扩散速率及CO2的吸收与解吸平衡,进而影响反应转化率和矿化产物的粒径。图6(a)为在200 mL Ca2+浸出液,氨水物质的量浓度为1.5 mol/L,反应时间60 min,温度在25、35、45、55 ℃时,温度对Ca2+转化率的影响。由图6(a)可知,25 ℃时,Ca2+转化率为95.9%,温度升至45 ℃时,反应转化率达99.9%,继续升高温度,Ca2+转化率不再变化。升高温度可加快反应速率,提高气液传质速率与离子扩散速率,相同时间内Ca2+矿化反应程度更加完全,表现为矿化反应转化率升高。

图6 不同矿化反应温度下矿化反应转化率、矿化产物粒径分布及矿化产物XRD图谱
不同温度Ca2+浸出液制备CaCO3产物的粒径变化如图6(b)所示。在CaCO3结晶过程中,成核速率和生长速率对晶体的粒径大小起关键作用,但二者对温度的敏感度不同,升高温度更有利于提高晶体生长速率,从而导致CaCO3晶体的粒径增加。25 ℃时,产物D50为6.11 μm,当温度升至55 ℃时,产物D50为18.79 μm,即随温度升高,产物CaCO3粒径增大。这是由于升高温度会促进Ca2+与碳酸根结合增加晶体生长速率,增大溶液中不同颗粒间相互碰撞团聚的机率,同时也会增加CaCO3的溶解度,在一定时间内使小颗粒消失,大颗粒进一步成长,从而导致产物CaCO3的粒径增大[20]。由图6(c)可知,不同温度条件下制备的矿化产品均为球霰石型CaCO3。尽管45 ℃时转化率可达99.9%,但考虑该温度能耗相对较高,氨逃逸明显增加,且一般情况下,轻质CaCO3产品粒径越小,价值越高,而当矿化温度由35 ℃升至45 ℃时,产物粒径明显增大,综合考虑下,选取35 ℃作为优化的矿化温度。
2.2.3 反应时间对矿化反应及矿化产物的影响
图7(a)为在200 mL Ca2+浸出液,氨水浓度为1.5 mol/L,温度为35 ℃,反应时间分别为30、60、90、120 min条件下,Ca2+转化率随反应时间的变化。反应30 min时,Ca2+转化率为97.9%,反应90 min时,Ca2+转化率达99.9%,继续增加反应时间,转化率不再变化,因此选取90 min作为较优反应时间。
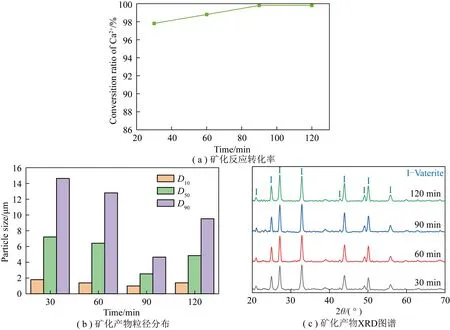
图7 不同反应时间矿化反应转化率、矿化产物粒径和矿化产物XRD图谱
不同时间条件下Ca2+浸出液矿化制备的CaCO3产物的粒径变化如图7(b)所示。当反应30 min时,反应不完全,产物尺寸较大,CaCO3的D50为7.21 μm,当反应时间为90 min时,产物D50为2.53 μm,进一步增加反应时间,产物CaCO3粒径反而增加,即随反应时间增加,产物CaCO3粒径先降低后升高。这是由于CaCO3晶体在形成过程中存在CaCO3的溶解与沉淀的平衡过程[21],反应开始时,CaCO3过饱和度相对较低,成核速率低于晶体生长速率,产物颗粒较大。随反应时间增加,溶液中吸收CO2增多,转化率升高,晶核数量增加,溶出的部分CaCO3又重新生长在新的CaCO3晶核上,颗粒平均粒径减小,随反应时间继续延长,颗粒团聚,尺寸增大。由图7(c)可知,不同时间制备的矿化产品均为球霰石型CaCO3。
为直观表现矿化产物CaCO3中球霰石的含量,利用球霰石含量计算公式进行计算[18],如式(6)、式(7)所示。不同工艺条件下反应过程及产品结果汇总见表3。

表3 不同矿化反应条件下的转化率与产物分析
(6)
XC+XV=1,
(7)
式中,XC为方解石摩尔分数,%;XV为球霰石摩尔分数,%;IC104为方解石104晶面衍射峰强度;IV110为球霰石110晶面衍射峰强度。
通过上述研究,最终确定Ca2+浸出液矿化制备CaCO3的优化工艺条件为:氨水物质的量浓度1.5 mol/L,温度35 ℃,反应时间90 min时,该条件下Ca2+转化率为99.9%,产品D50为2.53 μm,产品粒径分布曲线如图8所示,产品SEM图如图9所示。采用EDTA-2Na法对产物进行CaCO3含量分析,产品纯度为98.8%。

图8 CaCO3产物粒度分布曲线

图9 CaCO3产物SEM图
2.3 磷石膏矿化
为验证上述溶解矿化方法对固废磷石膏的矿化效果,对磷石膏进行间接矿化和直接矿化试验,并对试验结果进行对比。其中直接矿化试验条件见第1.2.3节,间接矿化试验按照硫酸铵物质的量浓度为3 mol/L,溶解时间30 min,氨水物质的量浓度为1.5 mol/L,矿化温度为35 ℃,矿化反应时间为90 min的条件进行,对CaCO3产品进行表征,结果显示直接矿化后产品CaCO3的纯度为82.2%,D50为22.00 μm,间接矿化产品中CaCO3的纯度为98.6%,D50为10.98 μm,其粒度分布如图10所示。间接矿化工艺可有效降低矿化产物粒径分布,并提高CaCO3产品品质,其纯度满足HG/T 2226—2019《普通工业沉淀碳酸钙》标准。

图10 磷石膏矿化产品CaCO3的粒度分布曲线
3 结 论
1)硫酸钙溶解浸出过程中,试验研究了硫酸铵浓度及溶解浸出时间对硫酸钙溶解特性的影响。在盐效应作用下,硫酸铵的加入可有效促进硫酸钙溶解。随硫酸铵浓度升高及溶解时间延长,硫酸钙溶解量逐渐增大。溶解浸出过程的优化工艺条件选为硫酸铵物质的量浓度3 mol/L,溶解时间30 min,此时硫酸钙的溶解量为5.62 g/L,为水溶解中溶解度的2.8倍。
2)石膏溶解浸出分离后,试验研究了氨水浓度、反应温度、反应时间等条件对矿化反应转化率及矿化产物的影响。结果表明,提高氨水浓度、反应温度及反应时间有利于提高Ca2+矿化转化率,最高可达99.9%;反应温度升高利于CaCO3生长,CaCO3粒径增加;随氨水浓度增加,CaCO3粒径先降低再升高。综合考虑下,选定Ca2+浸出液矿化制备CaCO3的优化工艺条件为:氨水物质的量浓度1.5 mol/L,反应温度35 ℃,反应时间90 min,该条件下可得到纯度为98.8%,D50为2.53 μm的高纯球霰石型CaCO3。
3)基于以上优化反应条件,对磷石膏矿化进行研究。结果表明,与直接矿化相比,间接矿化可使矿化产品CaCO3纯度由82.2%升至98.6%,且产品粒度D50由22.00 μm降至10.98 μm。最终合成的CaCO3产品纯度满足HG/T 2226—2019《普通工业沉淀碳酸钙》。
4)本研究利用石膏矿化液相产物硫酸铵溶液有效强化了石膏的溶解过程,避免了外加介质的引入,并通过间接矿化制备了高纯度轻质CaCO3,可为固废石膏的矿化强化及高值产品的制备提供基础数据与工艺支撑。
