不同浓度阿达帕林诱导SH-SY5Y细胞的分化及凋亡
2024-05-10刘娜娜张俊娇张樊吴聪英姜玉武
刘娜娜 张俊娇 张樊 吴聪英 姜玉武
(1.北京大学第一医院儿科,北京 100034;2.儿科遗传性疾病分子诊断与研究北京市重点实验室,北京 100009;3.北京中医药大学东直门医院针灸科,北京 101121)
神经母细胞瘤(neuroblastoma, NB)是儿童时期最常见的颅外实体瘤,主要见于婴幼儿,约占儿童癌症相关死亡率的15%[1]。它是一种起源于神经嵴的发育性肿瘤[2]。NB 预后差异较大,可自行消退,发展为良性神经节细胞瘤,以及逐渐进展为难治性肿瘤[3]。促进肿瘤细胞分化及凋亡的分子可能为治疗NB的有效候选药物。
神经元分化是一个复杂的生物过程,受多种信号通路调控,包括转化生长因子-β信号通路[4]、SHH 信号通路[5]、Wnt 信号通路[6]、Notch 信号通路[7]和RARs 信号通路[8]等。神经元凋亡是神经元的程序性死亡,是一种由基因决定的自我破坏过程。诱导肿瘤细胞凋亡有利于阻止肿瘤细胞的无限增殖,能有效抑制肿瘤的发生与发展。明确神经元分化及肿瘤细胞凋亡的发生,有利于神经系统疾病的治疗。
阿达帕林是一种人工合成的第三代维甲酸类药物,目前主要用于普通型痤疮等皮肤病的外用治疗[9-10]。有研究表明,阿达帕林可诱导黑色素瘤细胞(A375 和M14 细胞)[11]和角质形成细胞(HaCat 细胞)的增殖和凋亡[12];阿达帕林可抑制三阴性乳腺癌TNBC 细胞的生长、集落形成和迁移[13-14];在结直肠癌细胞系中抑制肿瘤细胞增殖及诱导其凋亡[15],从而发挥抗肿瘤作用。然而,该药物对NB和神经元发育的影响尚不明确。本研究旨在研究不同浓度阿达帕林对神经母细胞瘤细胞系SH-SY5Y 的影响,为阿达帕林可能用于治疗NB提供理论依据。
1 材料与方法
1.1 SH-SY5Y细胞培养
SH-SY5Y 细胞系由北京大学神经科学研究所王韵教授所赠。SH-SY5Y 细胞用含10%胎牛血清(Gibco,美国)和1%青霉素-链霉素溶液(Gibco,美国)的DMEM/F12培养基(Thermo Scientific,美国),培养于细胞培养皿中。置于37℃、5% CO2及95%湿度的培养箱(Thermo Scientific,美国)中孵育。培养基每周更换2次。
1.2 阿达帕林处理
将培养皿中密度为70%~80%的SH-SY5Y 细胞用0.25%胰蛋白酶(Gibco,美国)室温消化30 s,加入SH-SY5Y细胞培养基终止消化,离心后取SHSY5Y 细胞沉淀,PBS 洗涤3 次后培养于新的培养皿中。SH-SY5Y 细胞传代后第2 天,采用3 种不同浓度,即0.1 μM(低浓度)、1 μM(低浓度)、10 μM(高浓度)阿达帕林(Med Chem Express,美国)处理SH-SY5Y 细胞。在阿达帕林处理后7 d内,观察SH-SY5Y 细胞的形态变化过程。细胞实验分为对照组和0.1 μM、1 μM、10 μM 阿达帕林组。
1.3 延时显微拍摄
采用延时显微拍摄技术观察各组SH-SY5Y 细胞形态的动态变化。将SH-SY5Y 细胞置于INU 显微镜培养箱(Tokai Hit,日本)中孵育,设置该培养箱参数为37℃和5% CO2。使用CKX41 倒置显微镜(Olympus,日本)于第1、3、7 天进行拍摄,观察并记录同一区域SH-SY5Y 细胞及其突起的形态变化情况。
1.4 免疫荧光染色
1 μM 阿达帕林处理SH-SY5Y 细胞后,用4%多聚甲醛固定20 min,然后用0.3% Triton X-100 处理15 min。用含3%牛血清白蛋白和0.1% Triton X-100 的封闭液在室温下封闭1 h,加入兔抗β-微管蛋白Ⅲ(βⅢ-tubulin;CST,美国;1∶400)和小鼠抗神经丝重链多肽(neurofilament heavy polypeptide,NFH;CST,美国;1∶400)一抗,4℃下过夜。PBS 洗涤3 次后,加入Alexa Fluor 488(Invitrogen,美 国;1∶500) 和Alexa Fluor 568(Invitrogen,美国;1∶500)二抗,室温下孵育1 h。在室温下用2 μg/mL Hoechst 33258处理15 min以使细胞核染色,于共聚焦显微镜(Olympus,日本)下进行观察。实验独立重复4次。
1.5 多电极阵列记录
利用多电极阵列(3Brain,瑞士)技术记录阿达帕林诱导SH-SY5Y 细胞的自发放电活动。将未处理的SH-SY5Y细胞培养在多电极阵列CMOS芯片(Plexon,中国香港)上,用1 μM阿达帕林进行处理后,继续培养于CO2孵育箱中。予1 μM 阿达帕林处理4 d后进行自发放电活动监测,每组于同一时间点均至少记录5 min,使用BrainWave 4分析软件(3Brain,瑞士)进行离线分析。实验独立重复3次。
1.6 细胞凋亡检测
将SH-SY5Y 细胞培养于共聚焦显微镜皿内,予10 μM 阿达帕林处理1 d,按照磷脂结合蛋白Annexin V-FITC细胞凋亡检测试剂盒(C1062L,碧云天,中国)和活细胞半胱氨酸天冬氨酸蛋白酶(caspase)-3 活性与Annexin V 细胞凋亡检测试剂盒(C1077M,碧云天,中国)说明书进行检测。Annexin V/碘化丙啶(propidium iodide, PI)双染为每皿细胞加入195 μL Annexin V-FITC 结合液、5 μL Annexin V-FITC 和10 μL PI 染色液的混合液;caspase-3/Annexin V 双染为每皿细胞中加入194 μL Annexin V-mCherry 缓 冲 液、 5 μL Annexin VmCherry 和1 μL GreenNuc ™ caspase-3 Substrate(1 mM)混合液。将上述混合液分别摇匀后于室温下避光孵育20 min。随后于共聚焦显微镜下进行观察。实验均独立重复5次。
1.7 统计学分析
使用GraphPad Prism软件对数据进行统计学分析。符合正态分布的计量资料以均值±标准差(±s)表示。组间比较采用单因素方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 不同浓度阿达帕林对SH-SY5Y 细胞形态的影响
对照组SH-SY5Y 细胞突起较少且短。给予0.1 μM 阿达帕林处理后,SH-SY5Y 细胞被诱导形成较长突起,且突起可见分支,随培养时间延长,突起之间可相互连接形成网络。1 μM 阿达帕林处理后,SH-SY5Y 细胞被诱导形成较长且分支状突起,随培养时间延长,突起之间也可相互连接形成网络。10 μM 阿达帕林处理后,第1 天SH-SY5Y细胞突起较长,可见分支;第3、7 天SH-SY5Y 细胞突起消失,胞体呈球形。见图1。
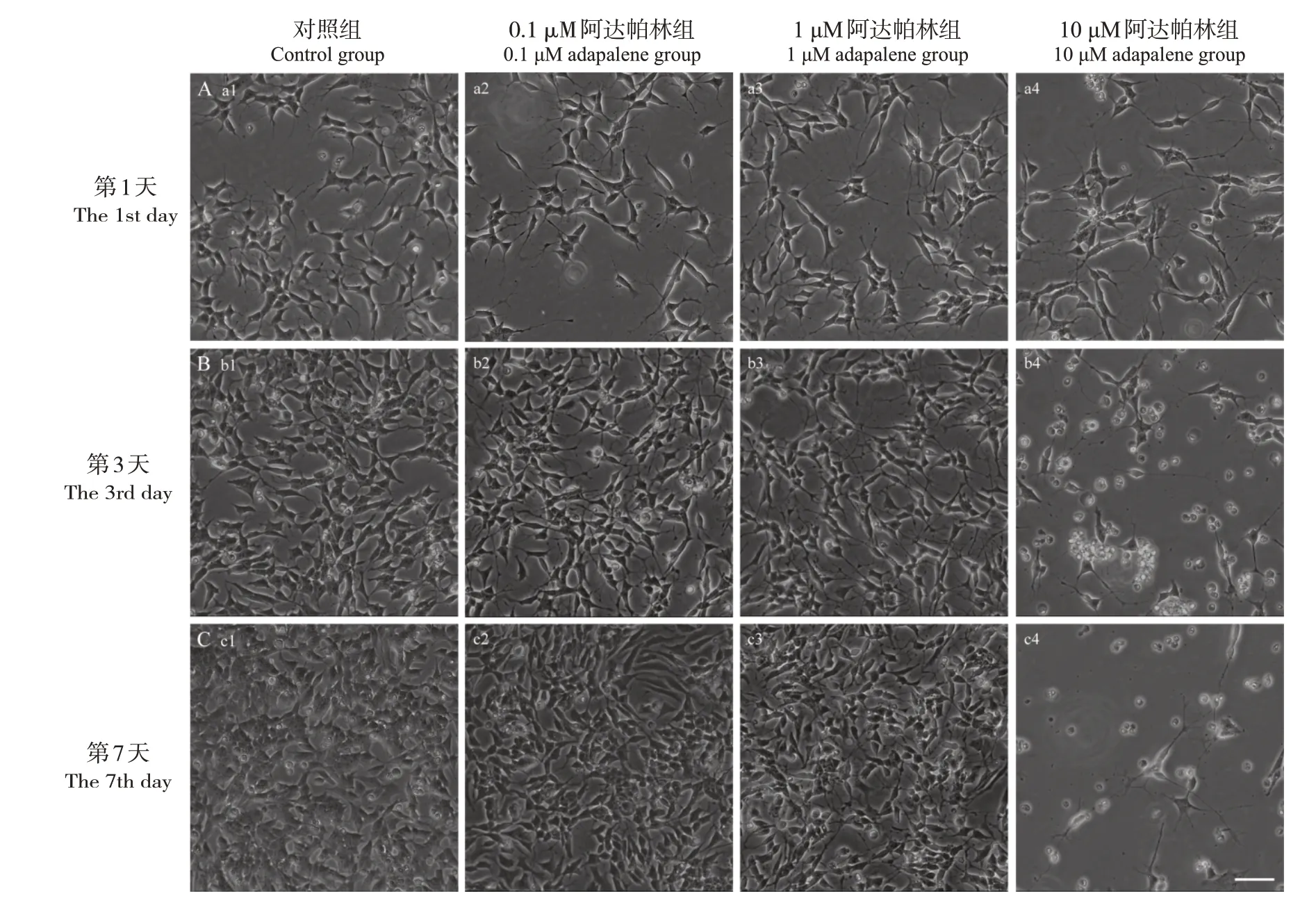
图1 不同浓度阿达帕林处理第1、3、7天SH-SY5Y细胞形态变化(×20) 对照组细胞突起较少且短。不同浓度阿达帕林处理后,0.1 μM、1 μM阿达帕林组细胞突起较长,可见分支;随培养时间延长,突起之间可相互连接形成网络。10 μM阿达帕林组处理后第1天细胞突起较长,可见分支;第3、7天细胞突起消失,胞体呈球形。

图2 1 µM阿达帕林处理4 d后SH-SY5Y细胞βⅢ-tubulin及NFH表达(共聚焦显微镜,×60) βⅢ-tubulin阳性表达为绿色荧光、NFH阳性表达为红色荧光。与对照组相比,1 μM阿达帕林组βⅢ-tubulin和NFH的相对荧光强度升高。
2.2 1 μM 低浓度阿达帕林诱导SH-SY5Y 细胞突起形成过程中的βⅢ-tubulin和NFH表达
与对照组相比,1 μM 阿达帕林组SH-SY5Y 细胞βⅢ-tubulin 和NFH 的相对荧光强度升高(分别为57.3±6.1 vs 65.4±3.5,44.5±1.7 vs 65.5±13.3;P<0.05)。提示低浓度阿达帕林可诱导SH-SY5Y 细胞突起形成,即神经纤维的形成;同时,可诱导SH-SY5Y细胞向成熟神经元分化。
2.3 低浓度阿达帕林诱导SH-SY5Y 细胞的功能变化
结果显示,0.1 μM 及1 μM 低浓度阿达帕林处理SH-SY5Y 细胞4 d 后,均可观察到自发电活动(图3);对照组中未观察到自发电活动。提示低浓度阿达帕林可诱导SH-SY5Y 细胞分化成为成熟的功能性神经元。

图3 低浓度阿达帕林处理SH-SY5Y 细胞4 d 后电活动的多电极阵列测定 0.1 μM(A)和1 μM(B)阿达帕林组可观察到自发电活动。
2.4 高浓度阿达帕林对SH-SY5Y细胞凋亡的影响
与对照组相比,10 μM 阿达帕林组Annexin V和PI 的相对荧光强度升高(分别为71.2±3.2 vs 96.3±19.5,51.4±1.1 vs 56.4±2.5;P<0.05),而且可观察到Annexin V和PI的部分共染现象。见图4。提示高浓度阿达帕林可诱导SH-SY5Y 细胞的凋亡。
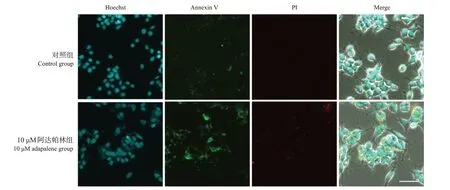
图4 10 µM阿达帕林处理1 d后SH-SY5Y细胞的细胞凋亡情况(共聚焦显微镜,×60) Annexin V-FITC为绿色荧光,PI为红色荧光。与对照组相比,10 μM阿达帕林组Annexin V和PI相对荧光强度升高。
与对照组相比,10 μM阿达帕林组caspase 3和Annexin V 的相对荧光强度升高(分别为51.6±4.9 vs 77.8±13.5,65.4±3.5 vs 133.6±63.4;P<0.05),而且可观察到caspase 3 和Annexin V 的部分共染现象。见图5。提示高浓度阿达帕林可诱导SH-SY5Y细胞凋亡,这一凋亡作用可能由caspase 途径介导。
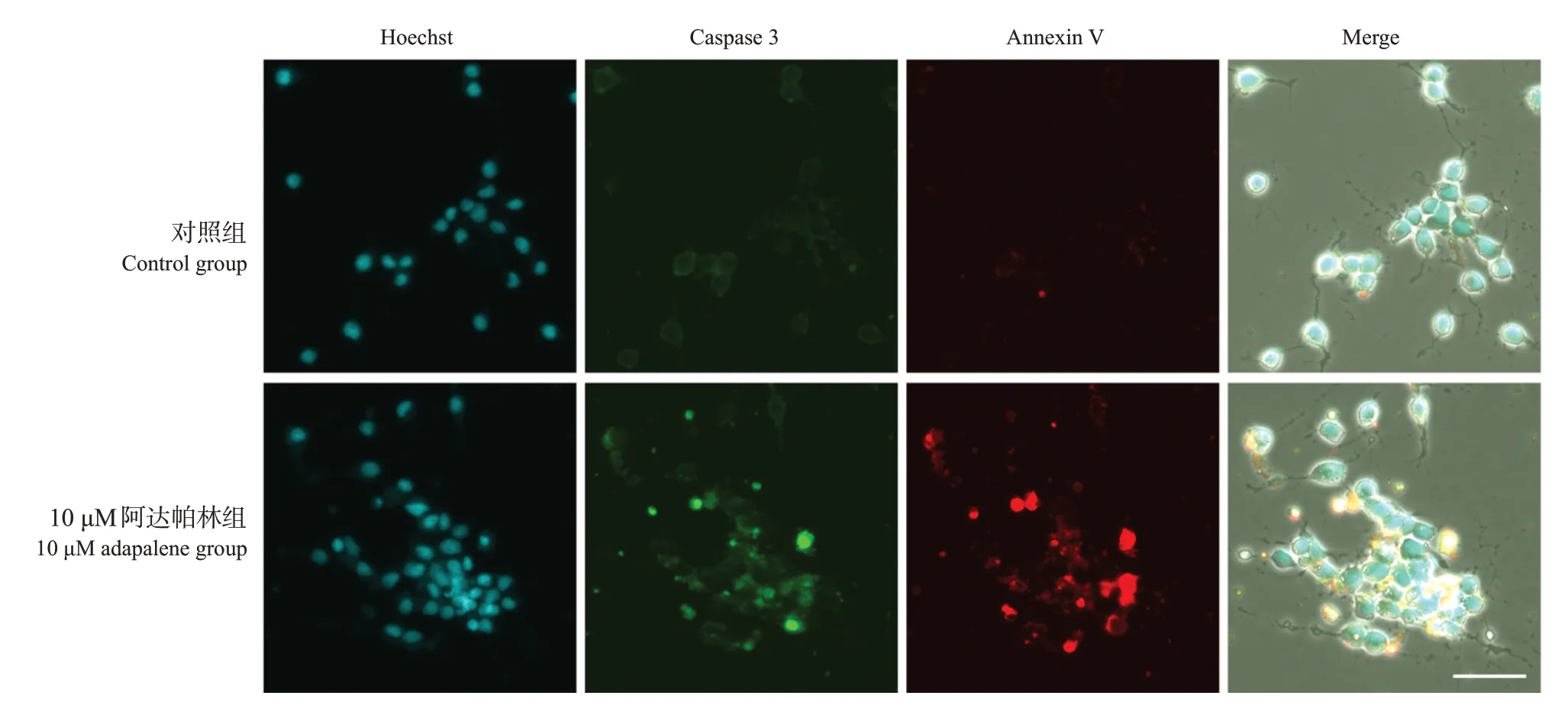
图5 10 µM 阿达帕林处理1 d 后SH-SY5Y 细胞中caspase 3 活性和细胞凋亡情况(共聚焦显微镜,×60)细胞内caspase 3 活性高的凋亡细胞核呈绿色荧光,凋亡细胞的细胞膜呈红色荧光。与对照组相比,10 μM 阿达帕林组caspase 3及Annexin V相对荧光强度升高。
3 讨论
SH-SY5Y 细胞是由人神经母细胞瘤SK-N-SH细胞经历克隆形成,被广泛用于神经系统疾病研究[16-18]。未分化的SH-SY5Y 细胞不完全具备神经元的特征,而分化成熟的SH-SY5Y 细胞可具备成熟神经元的特征,如形态学上可见明显细胞突起,功能上细胞兴奋性增强,可通过添加多种化合物诱导SH-SY5Y 细胞的分化[19],并可通过添加特定物质诱导其分化成特定类型神经元[20]。该细胞系状态稳定且易于生长。
以往研究中,维甲酸是维生素A 活性代谢产物之一,通常被用来将神经母细胞瘤细胞系SHSY5Y细胞诱导分化为神经元[21]。本研究中,使用阿达帕林研究其对SH-SY5Y细胞的诱导分化作用,使用不同浓度阿达帕林处理SH-SY5Y 细胞,通过采用延时显微拍摄技术于不同时间点观察SHSY5Y 细胞形态,结果提示低浓度阿达帕林可促进SH-SY5Y 细胞的突起形成,突起之间形成网络结构进而促进细胞之间的相互联系。由此可知,SHSY5Y 细胞可被诱导分化为神经元样细胞,可以观察到神经元样突起形成。为明确低浓度阿达帕林可诱导SH-SY5Y 细胞成神经元,本研究通过免疫荧光观察神经元特异性标志物βⅢ-tubulin 和成熟神经元标志物NFH 的表达情况。结果表明,低浓度阿达帕林组SH-SY5Y 细胞βⅢ-tubulin 和NFH 表达高于对照组。NFH具有稳定神经元轴突的作用,常作为成熟神经元的重要标志物。以上提示,低浓度阿达帕林可诱导SH-SY5Y 细胞分化为成熟神经元。为了明确低浓度阿达帕林诱导分化的成熟神经元功能,本研究采用多电极阵列技术对诱导分化后的SH-SY5Y 细胞进行电生理记录,观察到低浓度阿达帕林诱导分化后的SH-SY5Y 细胞有自发放电活动,提示低浓度阿达帕林可诱导SHSY5Y 细胞成为成熟的功能性神经元。这与以往研究中使用AM580 诱导SH-SY5Y 细胞分化为有功能的成熟神经元的研究结果一致[19]。
促进肿瘤细胞凋亡是大多数抗肿瘤药物发挥药效的重要机制。既往研究证实,随培养时间延长,不同浓度阿达帕林(2.5 μM、5 μM、10 μM)可抑制黑色素瘤A375 和M14 细胞的集落形成,通过抑制DNA 修复进而引发细胞显著的S 期阻滞和凋亡[11];另有研究表明,不同浓度阿达帕林(2 μM、4 μM、6 μM)可抑制HaCat细胞的克隆形成,引起细胞S期阻滞和凋亡,这一机制可能使阿达帕林用于表皮增生性疾病的治疗[12]。在本研究中,为了明确高浓度阿达帕林对SH-SY5Y 细胞的影响,阿达帕林处理浓度升至10 μM,发现SHSY5Y 细胞突起逐渐消失,胞体逐渐回缩成球形,随培养时间延长,上述现象逐渐明显。为了进一步明确高浓度阿达帕林对SH-SY5Y 细胞凋亡的影响,通过检测细胞凋亡标志物,结果表明,高浓度阿达帕林组SH-SY5Y 细胞表达神经元早期凋亡标志物磷脂结合蛋白Annexin V、晚期凋亡及坏死标志物PI 以及神经元凋亡标记物caspase 3 均高于对照组。以上表明,高浓度阿达帕林可以诱导SHSY5Y细胞凋亡。
综上所述,本研究发现低浓度和高浓度阿达帕林对SH-SY5Y 细胞分别具有诱导分化为成熟的功能性神经元和诱导凋亡的作用。为NB的临床有效药物治疗提供实验依据。
作者贡献声明:刘娜娜负责SH-SY5Y 细胞多电极阵列检测细胞放电实验及细胞凋亡检测实验、实验数据分析、文章撰写和修改;张俊娇负责SHSY5Y 细胞的培养及形态学观察实验;张樊负责SH-SY5Y 细胞的培养及不同浓度药物处理;吴聪英老师提供实验技术支持,帮助进行数据分析和统计,修订文章初稿;姜玉武教授提供基金支持,负责课题的设计、指导和监督,并在实验过程中提供宝贵的专业意见。
利益冲突声明:所有作者声明不存在利益冲突。
