上海市某腹泻猪群猪流行性腹泻病毒检测及全基因序列分析
2024-05-09康龙山于慧茹杨德全沈海潇杨显超徐丽娜葛菲菲
康龙山,于慧茹,杨德全,李 鑫,沈海潇,杨显超,王 建,徐丽娜,葛菲菲
(1.河北工程大学生命科学与食品工程学院,邯郸 056009;2.上海市动物疫病预防控制中心,上海 201103)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus, PEDV)引起的一种急性接触性传染病,主要引起仔猪发病,感染部位在小肠。临床特征为急性衰弱性腹泻、脱水、呕吐和高死亡率[1]。1971年,英国首次出现了PED在育肥猪中暴发的报道,该病与传染性胃肠炎极为相似,但对4~5周龄仔猪进行致病性研究后发现,该病与已经报道的TGEV的临床症状不同[2]。1978年,比利时根特大学的科学家从当地发病猪场中分离出1株该病毒,并命名为CV777[3]。2010年以后,PED在中国各省开始广泛流行,仔猪死亡率高达80%~100%,严重危害我国养猪业[4]。PED还出现在韩国[5]、日本[6]等亚洲其他国家。2013年,PED首次在美国暴发,仅在一年内造成了美国国内约10%的猪只死亡,总计约700万头,随后PED传播到加拿大和墨西哥等美国周边国家[7]。目前为止,PEDV已经成为威胁全球养猪业的重要传染病之一[8]。
PEDV是一种有囊膜的单股正链RNA病毒,属于冠状病毒科(Coronaviridae),甲型冠状病毒属(Al-phacoronavirus),基因组全长约28 kb,编码4种结构蛋白(S蛋白、E蛋白、M蛋白和N蛋白),4种非结构蛋白(1a、1b、3a、3b)[9]。S蛋白是由1383个氨基酸组成的位于病毒粒子表面的Ⅰ型膜糖蛋白,由S1蛋白和S2蛋白组成[10],S1蛋白的主要功能是识别和结合宿主细胞受体,同时与病毒毒力有关;S2蛋白主要介导病毒感染过程中的细胞膜融合过程[11]。S蛋白在诱导中和抗体产生方面起到重要作用[12],通过S蛋白基因组分析可以了解PEDV的流行特点和毒株的遗传变异情况,同时在疫苗研发过程中起到重要作用。PEDV目前分为两个基因群,GⅠ群和GⅡ群,GⅠ群分为GⅠ-a和GⅠ-b亚群,GⅡ群分为GⅡ-a、GⅡ-b、GⅡ-c亚群。自2010年10月以来,PEDV在我国多个省份流行,并随时间不断发生变异,给我国PEDV防控带来更大的挑战[1]。赵攀登等[13]对2017—2018年河南省8个规模化猪场采集的部分PEDV阳性样本的S基因序列分析发现,与CV777分处于不同基因群,同源性低。王娜等[14]分离出1株PEDV上海株,对其进行基因序列分析后发现与国外毒株和CV777等经典毒株亲缘关系较远。杨丹娇等[15]对2018年1~12月份采集的甘孜州12个藏猪养殖场的144份腹泻样本中获得了7株PEDV毒株完整的S基因,分析发现7个S蛋白的核苷酸在重要位点发生突变,7株毒株的S基因在G1群和G2群之间形成亚群,可能代表两种新的基因型。以上研究表明了我国PEDV的复杂性。本研究对上海某猪场暴发的PEDV进行了病毒检测及全基因序列分析,以期为上海地区PEDV的科学防控提供理论依据。
1 材料和方法
1.1 样品来源 样品来源于上海某规模化猪场,发病猪为产房3~5日龄仔猪。临床症状为严重腹泻、精神沉郁、脱水、消瘦。对死亡仔猪进行病理剖检,主要病理变化有小肠胀气,肠壁变薄,肠系膜充血,肠系膜淋巴结肿大,小肠内有黄色液体。采集发病仔猪粪便样本共4份用于后续检测。
1.2 主要试剂 PEDV、TGEV和ROTA荧光RT-PCR试剂盒均购自广州维伯鑫生物科技股份有限公司;核酸提取试剂盒购自广州美基生物科技有限公司。
1.3 样品处理 分别称取0.5g粪便样本置于4个1.5 mL灭菌离心管中,每管加入1 mL无菌PBS后混匀,在4℃条件下8000 ×g离心2 min,取上清液100 μL于新的1.5 mL灭菌离心管中备用。
1.4 核酸提取 核酸提取按照试剂盒说明书步骤操作。取96孔板,A1~A4孔中加入10 μL磁珠-蛋白酶k混合液、90 μL Buffer MLB和50 μL上清液;B1-B4孔中加入150 μL Buffer MW1;C1-C4和D1-D4孔中加入150 μL Buffer MW2;E排、F排和G排为空白孔,H1-H4孔加入50 μL ddH2O,使用核酸提取仪提取核酸,整个过程需要23 min。
1.5 荧光PCR检测 参照试剂盒说明书进行PCR检测。将PEDV、TGEV、RV反应液20 μL和酶液1 μL分别加入PCR反应管后,分别加入提取的4份核酸样本、阳性对照、阴性对照各4 μL,混匀后使用荧光PCR仪进行检测。反应条件为:42℃ 20min;95℃10 min;94℃ 15s,55℃ 30s,共40个循环。
1.6 基因组氨基酸同源性比较 借助MegAlign分析软件,将毒株编码蛋白氨基酸序列与对应的疫苗株编码蛋白氨基酸的序列对齐后,使用Lipman-Pearson方法对毒株与疫苗株CV777和AJ1102的结构蛋白氨基酸做同源性比较。
1.7 全基因测序及系统发育分析 样本RNA送上海探普生物科技有限公司进行二代测序:使用随机六聚体进行逆转录,用DNA酶处理和清除之后,然后进行第二链合成,使用Nextera XT试剂(Illumina)进行文库制备,并在NovaSeq 6000(Illumina)上进行测序。测序完成后,将该病毒全基因序列提交到NCBI数据库。使用MEGA3.1分析软件,采用邻接法(Neighbor-Joining method)对全基因和S基因进行序列对比,Bootstrap计算进行1000次重复,构建全基因和S基因系统进化树,进行系统发育分析。
2 结果
2.1 荧光PCR检测结果 采用仔猪粪便样本进行荧光RT-PCR检测,结果判定标准为:Ct值≤35,且曲线有明显的指数增长曲线为阳性;检测通道35<Ct值≤38,为可疑建议重复检测;样本检测结果Ct值>38或无Ct值为阴性。结果显示:TGEV、RV检测为阴性,PEDV检测为阳性。阳性对照Ct值为25.767;1~4号样本的Ct值分别为16.563、 16.019、20.963、22.452(图1)。
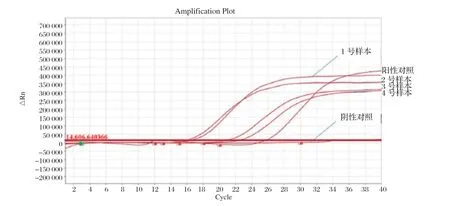
图1 PEDV 荧光RT-PCR 检测结果Fig.1 The results of PEDV real-time RT-PCR detection
2.2 CMMZH2110全基因组测序结果 对毒株进行二代测序后拼接成全基因组,上传至NCBI数据库(GenBank登录号为OL347994),该毒株命名为CMMZH2110。结果显 示:CMMZH2110基因组全长28 038 bp,包括以下基因:5'UTR(nt 1-292)、ORF1a(nt 293 ~12601),ORF1b(nt12601~20637)、S(nt 20634~24794)、ORF3(nt 24794~25468)、E(nt 25449~25679)、M(nt 25687~26367))、N(nt 26379~27704)、3'UTR(nt 27705~28038)。
2.3 氨基酸同源性比较 将CMMZH21110所有结构蛋白与疫苗株CV777和AJ1102做同源性比较,结果可知,CMMZH2110与CV777的S蛋白同源性最低,为91.9%;与M蛋白的同源性最高,为97.3%;E蛋白和N蛋白的同源性分别为94.7%和97.1%。CMMZH2110与AJ1102的E蛋白同源性最低,为97.4%;M蛋白的同源性最高,为99.1%;S蛋白和N蛋白的同源性分别为97.8%和97.5%(表1)。结果表明,毒株CMMZH2110与疫苗株CV777的结构蛋白同源性较低,与AJ1102的同源性整体高于CV777。
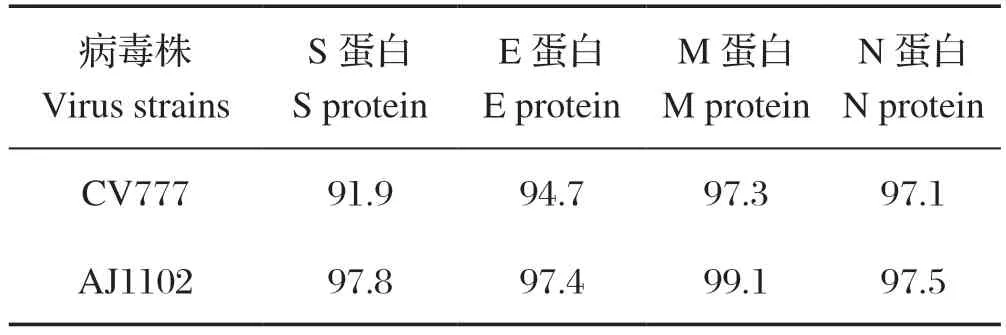
表1 CMMZH2110 编码蛋白的氨基酸同源性比较Table 1 The Comparison of amino acid homology of CMMZH2110 encoding protein
2.4 CMMZH2110全基因组及S基因系统进化分析 参考文献[18]中使用的近年来全球部分国家的PEDV流行株,绘制PEDV全基因及S基因进化树。全基因遗传进化分析结果可知:CMMZH2110全基因与中国西南地区毒株MH061339CH/SCA210/2017、福建毒株XM2-4和上海毒株shxx1902(本课题组之前在上海某猪场分离到的1株PEDV毒株)亲缘关系最近,和来自美国的毒株OH851属于一个群,都属于GⅡ-c亚群。CV777原代株属于GⅠ-a亚群,CV777疫苗株属于GⅠ-b亚群,中国目前使用的疫苗株AJ1102属于GⅡ-b亚群(图2)。S基因的系统进化树分析显示(图3),CMMZH2110S基因与中国毒株CH HNLB2017、CH HNPJ2017亲缘关系最近,与AJ1102同属于GⅡ-b亚群,但不在同一支上,与CV777不在同一个亚群。结果表明,毒株CMMZH2110全基因和S基因均与CV777和AJ1102亲缘关系较远,属于新型流行毒株。

图2 CMMZH2110 全基因组序列系统进化分析Fig.2 Phylogenetic analysis of the complete genome sequence of CMMZH2110

图3 CMMZH2110 S 基因序列系统进化分析Fig.3 Phylogenetic analysis of the S gene sequences of CMMZH2110
3 讨论
中国是养猪大国,近年来,PEDV在我国各省均有暴发,已成为我国养猪业 的巨大威胁[16]。PEDV可导致各年龄段的猪群发病,对7日龄以下仔猪的危害最大[17]。目前对PEDV的防控主要以疫苗免疫为主,近年来我国PED V多发生变异,传统疫苗株难以提供好的保护,准确分析当地流行毒株的分子生物学特性,根据毒株流行特点开发针对性的疫苗至关重要。上海某猪场暴发的仔猪腹泻,产房3~5日龄仔猪出现腹泻、脱水和死亡,发病率为30%~50%,死亡率为20%~30%。采集病死仔猪的肠道组织及内容样本进行RT-PCR检测,结果显示PEDV呈阳性。猪场此前使用了大北农活疫苗进行过免疫,但是仍然出现PEDV暴发,排除疫苗质量、接种方式等人为因素,提示原因可能是由于疫苗与毒株基因型不匹配引起的。
按照Wang等[18]对PEDV基因群的划分方法,对毒株进行全基因系统进化分析,结果表明,我们的基因进化结果与上述参考文献一致。CMMZH2110属于GⅡ-c亚群,与本课题组在上海另一猪场分离到的毒株shxx1902属于同一亚群。全基因和S基因均与CV777分属于不同亚群,S基因与中国目前使用的疫苗株AJ1102同属于一个亚群,但是全基因分属于不同亚群。Guo等[19]研究表明,GⅡ-c亚群病毒属于嵌合病毒,CMMZH2110全基因组属于GⅡ-c亚群,S基因属于GⅡ-b亚群,符合嵌合病毒特点,提示CMMZH2110可能是由不同亚群之间的病毒重组产生的。S基因序列对比分析显示,CMMZH2110与AJ1102属于同一亚群,但不属于同一分支,S蛋白同源性为97.8%,与CV777不在同一亚群,S蛋白同源性为91.9%,与二者的同源性都不高。大多数PEDV的S1基因比S2基因更易突变,多作为遗传进化分析和疫苗研发的目标蛋白[20]。研究上海地区PEDV流行毒株的S基因的遗传进化特点,可为上海地区PEDV科学防控提供理论支持。
分析表明PEDV新基因型在上海地区出现,今后如何对PEDV进行有效防控,可从以下几方面进行:首先,加强流行病学监控和分子生物学特性研究,及时对母猪进行与流行 毒株匹配的疫苗免疫。其次要保证产房的温度处于稳定,为仔猪和母猪提供适宜的环境。再次,母猪在妊娠阶段使用微生态制剂饲喂,保证母猪肠道健康,提高母猪整体的健康状况,使母猪可以分泌更多乳汁,仔猪可以获得更多的母源抗体。最后,分娩猪舍不同的猪舍间粪污分开,及时清空和消毒,并留出足够的空栏时间,防止病毒的循环传播。
