实时荧光定量PCR 检测鸭源鹅细小病毒方法的建立与应用
2024-05-09杨挺懿黄欣梅韩凯凯赵冬敏章丽娇刘宇卓张小飞刘青涛
杨挺懿,杨 婧,黄欣梅,韩凯凯,赵冬敏,章丽娇,刘宇卓,李 银,张小飞,刘青涛
(1.南京农业大学动物医学院,南京 210095; 2.江苏省农业科学院兽医研究所,南京 210014)
鸭源鹅细小病毒(Duck-origin goose parvovirus,D-GPV)是细小病毒科,细小病毒亚科依赖病毒属的单链DNA病毒[1],它的典型临床症状是短喙,胫骨短,生长迟滞[2],有学者指出,此病毒可能是通过影响肠道菌群从而导致发病[3]。该病首次报道是在1971年的法国西南地区,在我国最早出现在台湾[4],而后分别于1995年和2000年在波兰和匈牙利暴发[5]。2014年以后我国许多地区如福建、山东、河北、河南、安徽、江西等地暴发该病,给养鸭业造成了巨大经济损失[6]。
自D-GPV暴发以来,许多学者纷纷建立各种检测方法,王劭等[7]建立了PCR-RFLP技术,有效杜绝了假阳性,但是检测敏感性较低;刘铭[8]通过重组VP2建立了D-GPV ELISA检测方法;Liu等[9]将重组酶聚合酶扩增(recombinase polymerase amplification,RPA)技术与垂直流(vertical flow, VF)可视化试纸相结合,该方法特异性好和敏感性高,但是由于还没有用于RPA检测的引物设计软件,因此方法的普及受到限制。实时荧光定量PCR(quantitative real-time PCR, qPCR)技术,通过在PCR反应体系中加入荧光染料,实时监测整个过程中荧光信号的累计强度,从而达到对反应产物进行定量的目的,省去了普通PCR需要借助核酸电泳进行分析的步骤,结果一目了然,减少了检测时间,大大增加了检测效率,具有快速、简便、特异性好、敏感性高、稳定性好等特点,自问世以来就受到广泛的青睐[10]。
1 材料和方法
1.1 病毒和实验动物 鸭源鹅细小病毒(Duckorigin goose parvovirus, D-GPV)、番鸭细小病毒(Muscovy duck parvovirus, MDPV)、鸭瘟病毒(Duck plague virus, DPV)、鸭圆环病毒(Duck circovirus, DuCV)、禽腺病毒血清4型(Fowl adenovirus serotype 4, FAdV-4)、H9亚型禽流感病毒(H9N2 subtype of avian influenza virus, H9N2 AIV)、鸭甲型肝炎病毒(Duck hepatitis A virus,DHAV)、坦布苏病毒(Tembusu virus, TMUV)、鸭呼肠孤病毒(Duck reovirus, DRV)、新城疫病毒(Newcastle disease virus, NDV)、鸡传染性支气管炎病毒(Infectious bronchitis virus, IBV)均由江苏省农业科学院兽医研究所分离并保存。鸭购自江苏丽佳禽业有限公司。
1.2 主要试剂和仪器 RNA/DNA、质粒提取试剂盒和胶回收试剂盒购自康宁公司;Thermal Cycter Dice Real Time System购自TaKaRa公司;T5 Direct PCR Kit (Animal Tissue) 和DH5α感受态细胞购自南京擎科生物公司。
1.3 引物设计与合成 根据GenBank的D-GPV全基因序列,用DNAStar软件进行同源性分析,选出高度保守并且特异的核苷酸区域,用Primer Express软件设计一对克隆引物,其序列为NS1-F:5'-GGTCGAATTCATGGCACTTTCTAGG-3'和NS1-R:5'-TGAACTCGAGTTATTGTTCA TTTTCAGC-3',将NS1基因连接到PMD18-T载体中;同时设计一对检测引物NS1-911F:5'-ACTGTGGCACCGCTTATTTC-3'和NS1-911R:5'-ATTTCAGCACGGGCATTCTC-3',扩增片段为191 bp。
1.4 病毒DNA的提取 按照试剂盒说明书进行提取DNA。
1.5 标准品的制备 将含有病毒的尿囊液旋涡振荡混匀,离心后直接吸取上清液进行PCR,反应体系为:2× T5 Direct PCR Mix(Animal)20 μL,ddH2O 17.4 μL,上、下游引物各0.8 μL,上清液1 μL。反应条件为:98℃预变性8 min;98℃变性10 s,56℃退火30 s,72℃延伸30 s,35个循环;72℃再延伸3 min。扩增产物经核酸电泳鉴定后进行胶回收,连接到PMD18-T中,再转化到DH5α感受态细胞,挑选菌落进行培养,提取质粒,进行PCR鉴定和测序分析,筛选出阳性克隆。将质粒用EcoRⅠ单酶切进行线性化,胶回收后测定产物浓度,以此来计算拷贝数,-70℃冻存。拷贝数公式为:6.02×1023(copies/moL)×质粒的质量浓度(g/μL)/质粒分子量(g/moL)。
1.6 标准曲线的建立 将制备的标准品进行10倍梯度稀释(100~107copies/μL)作为模板进行实时荧光定量PCR扩增,得到标准曲线和溶解曲线。扩增体系为:2× ChanQ SYBR qPCR Master Mix 10 μL,引物各1 μL,ddH2O 7 μL,模板1 μL。扩增程序为:95℃预变性3 min;95℃变性10 s,60℃延伸30 s,共40个循环。
1.7 荧光定量PCR检测方法的评价
1.7.1 敏感性试验 以10倍梯度稀释标准品进行实时荧光定量PCR,检测出的最低拷贝数即为该方法的灵敏度。
1.7.2 特异性试验 用PCR方法,使用上文设计的检测引物分别对MDPV、DVE、DuCV、FAdV-4、H9N2 AIV、DHAV、TMUV、DRV、NDV、AIBV进行检测,以D-GPV作为阳性对照,评价该引物的特异性。
1.7.3 重复性试验 用建立的方法同时对1×102、1×104、1×106copies/μL的标准品进行检测,同一次试验每个样品设置3个重复,分3个时间进行。根据Ct值计算批间和批内的变异系数,检验该方法的重复性。
1.7.4 泄殖腔与咽喉拭子样品的检测 对4只2日龄雏鸭进行口服攻毒,同时设置对照组,攻毒后第1、3、7、14、21、28、35、42 d分别采集泄殖腔和咽拭子,反复冻融3次后提取DNA,用实时荧光定量PCR进行检测。
2 结果
2.1 标准品的制备 用微量核酸浓度测定仪测定质粒的浓度,得出结果为54.900 ng/μL,按照公式计算得出拷贝数为:1.09×1010copies/μL,分装后-70℃冻存。
2.2 标准曲线的绘制 对10倍梯度稀释(100~107copies/μL)的标准品进行检测。结果显示,标准品在浓度为100~107copies/μL时具有良好的线性关系(图1),其中标准曲线的相关系数R2=0.999,扩增效率为99.1%。并且扩增产物的溶解曲线显示无非特异性产物,均为单一峰(图2)。
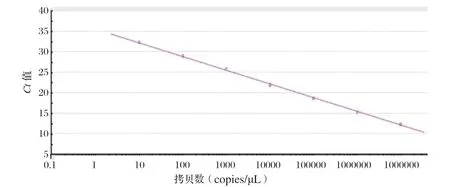
图1 标准曲线Fig.1 Standard Curve
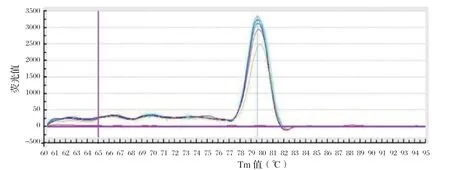
图2 溶解曲线Fig.2 Melt Curve
2.3 敏感性试验结果 标准品(100~107copies/μL)的检测结果显示,在标准品浓度为101copies/μL时仍有稳定的阳性扩增信号,该实时荧光定量PCR的检测最低拷贝数为10拷贝(图3)。说明该方法可以对拷贝数大于等于10的样品进行定量检测。

图3 扩增曲线Fig.3 Amplif ication plot
2.4 特异性试验结果 用本文所设计的荧光定量PCR检测引物对D-GPV和其他10种病毒进行PCR扩增,结果显示D-GPV样品可以扩增出阳性条带,而其他病毒均为阴性,这说明本文所设计的引物具有良好的特异性(图4)。

图4 特异性试验Fig.4 Specif icity Test
2.5 重复性试验结果 对不同标准品的3次批内重复和3次批间重复测定结果显示,各标准品的批内变异系数为0.17%~0.4%,批间变异系数为0.35%~0.88%,表明该方法重复性良好(表1)。

表1 重复性试验Table1 Repeatability test
2.6 D-GPV攻毒样品的检测 由D-GPV攻毒鸭泄殖腔和咽拭子检测结果显示,鸭在攻毒后第1 d即可以通过口腔和泄殖腔向外排毒,排毒量在第3 d达到高峰,并且泄殖腔的排毒量明显高于口腔。另外,鸭在攻毒后42 d仍然可以通过口腔和泄殖腔向外排毒(表2),这说明鸭在感染D-GPV后可以长期带毒、排毒。

表2 D-GPV 在人工感染雏鸭后咽拭子和泄殖腔拭子的qPCR 检测结果Table 2 Detection results of D-GPV in cloacal and oropharyngeal swabs of artif icially infected ducks by qPCR
3 讨论
自2014年我国暴发D-GPV以来,多地养鸭业受到严重的经济损失。虽然该病致死率不高,但是一旦发病,僵鸭淘汰率可高达80%[11],将严重影响经济效益。因此,为准确诊断病原,减少养殖业经济损失,预防该病毒的大面积传播,快速、灵敏且准确的检测方法必不可少。
本研究根据D-GPV的基因保守区,设计了一对特异性的引物,建立了针对D-GPV的实时荧光定量PCR方法。结果显示,本研究建立的qPCR方法敏感性高,最低可检测10个拷贝;特异性很好,溶解曲线均为单一峰,检测MDPV、DPV、DuCV、FAdV-4、H9N2 AIV、DHAV、TMUV、DRV、NDV、IBV等病毒均显示阴性;重复性好,批间和批内的变异系数较小;在对攻毒样品的检测中,该方法的检出阳性率为100%。因此,本研究所建立的qPCR方法具有快速、灵敏、稳定等特点,适合用于临床样品的D-GPV快速检测。此外,该方法的标准曲线线性关系好,相关系数R2=0.999,扩增效率为99.1%,可以用于病毒的定量检测。
用该方法对D-GPV感染鸭的泄殖腔和咽喉拭子样品的检测结果显示,雏鸭感染D-GPV后第1 d即可在咽拭子和泄殖腔拭子中检测到病毒,病毒载量在感染后第3 d达到峰值,随后逐渐减少,但在感染后第42 d仍可检测到病毒;同时通过观察临床症状发现攻毒组中4只鸭均出现体重减轻现象,但仅有2只出现明显短喙症状。表明一旦感染该病毒,宿主可能不表现明显的典型症状但可以长期通过唾液和粪便排毒,在养殖过程中不断水平传播造成大面积感染,从而导致经济损失。根据以上结果,养殖过程中应尽可能减少病毒水平传播的可能,做好水槽、食槽等器材的消毒工作并对排泄物进行无害化处理。
