牛支原体疫苗研究进展
2024-05-09王贵平贾爱卿
东 笑,陶 攀,王贵平,2,贾爱卿,2
(1.广东海大畜牧兽医研究院有限公司 广东省养猪与猪病防控技术研究企业重点实验室,广州 511400;2.广东海大集团股份有限公司,广州 511400)
牛支原体(Mycoplasmabovis,M.bovis)于1961年在美国首次被分离到[1]。感染牛支原体会引起支气管肺炎、中耳炎、乳腺炎、生殖道疾病、关节炎、脑膜炎、角膜结膜炎等。牛支原体已经被认为是养牛生产的主要牛病原体之一[2]。2008年,我国首次从患有肺炎的犊牛肺脏中分离到牛支原体[3]。随后在14个省份的奶牛场中检测到牛支原体存在,这表明牛支原体已经在我国大范围的传播,因此防治牛支原体已经迫在眉睫。由于牛支原体无细胞壁,可用于治疗牛支原体感染的抗生素是有限的;并且大量报告表明,牛支原体对抗生素的耐药性正在逐年上升[4],这使得使用药物防治牛支原体的成本不断提高。因此,急迫需要通过接种疫苗的手段预防、控制,甚至净化牛支原体。牛支原体疫苗的研究已经进行了很多年,从2017年到现在有三家单位研发的牛支原体疫苗进入临床试验阶段,截止目前尚未完成注册上市。本文主要对牛支原体的感染与免疫机制以及疫苗研究进展(表1)进行了综述,以期为进一步了解和研究牛支原体疫苗提供参考。
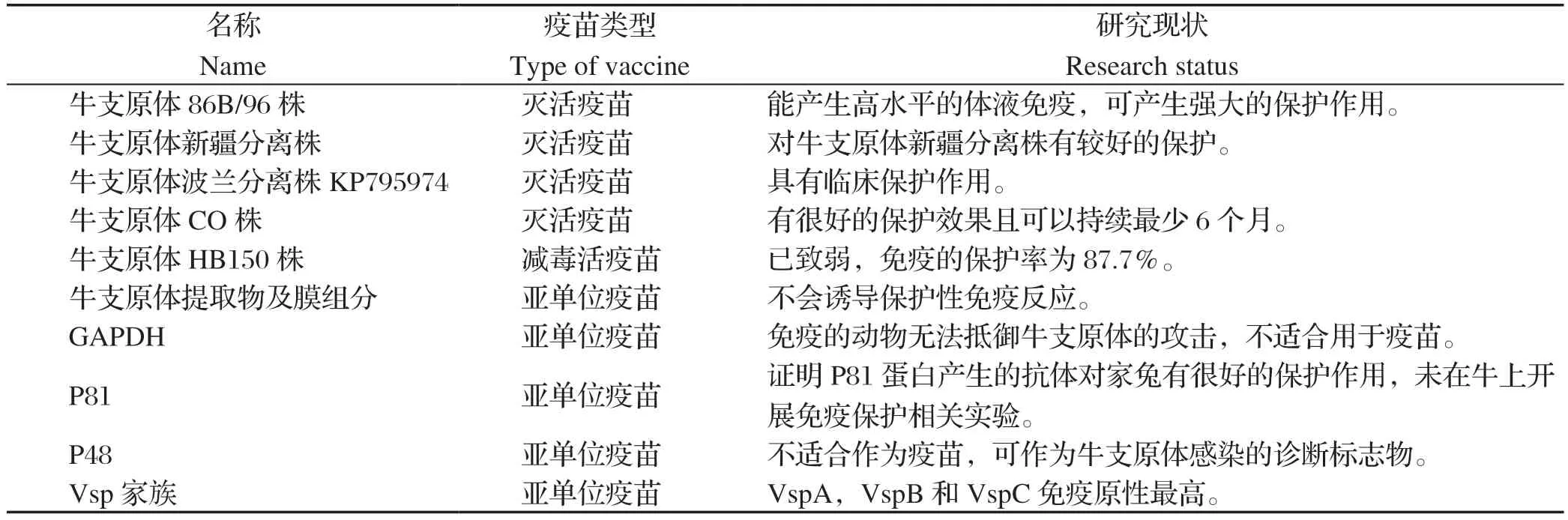
表1 牛支原体疫苗候选抗原Table1 Candidate antigen of Mycoplasma bovis vaccine
1 牛支原体的感染与免疫机制
1.1 牛支原体的感染机 制 黏附是支原体感染的首要步骤[5]。牛支原体能通过黏附素黏附于细胞表面。目前,研究表明P81、P68、P48等黏附相关膜蛋白,可变膜表面脂蛋白(virus-sized particles, Vsps)均与牛支原体黏附有关[6];另外,α-烯醇酶、还原型辅酶Ⅰ氧化酶和亚甲基四氢叶酸RNA-(uracil-5-)-甲基转移酶被鉴定为黏附素,它们可以与纤连蛋白和纤溶酶原结合,作为宿主细胞受体和细菌黏附之间的连接[7-8],可能会促进宿主的侵袭和牛支原体的传播[9]。在牛支原体黏附宿主细胞过程中,会通过产生过氧化氢对宿主的细胞膜造成损伤[10]。对于牛支原体黏附后是否会入侵宿主细胞有相互矛盾的发现。一些研究评估显示,牛支原体只黏附于细胞表面,不会转移到支气管上皮细胞内[11]。与此相反,一些研究显示牛支原体黏附于细胞表面,也可以进入细胞内,并可以通过中性粒细胞和巨噬细胞的吞噬作用迁移到中性粒细胞和巨噬细胞中。V an等[12]研究表明,牛支原体Mb1株可以黏附并侵袭牛外周血单核细胞(peripheral blood mononuclear cell, PBMC),阻止其增殖。牛支原体是具有逃避和调节宿主免疫系统能力的一类病原,在相对较短的时间内,牛支原体可以入侵任何类型的PBMC,导致淋巴细胞分化和扩散到任何宿主组织[12]。牛支原体入侵宿主细胞,并在胞内持续存在,这有助于其逃避宿主的免疫应答和抗生素的治疗。逃避宿主机制包括抗原变异、抑制外周血单核细胞增殖、抗单核细胞和巨噬细胞吞噬作用、入侵红细胞和上皮细胞、调节细胞因子的产生、调节细胞凋亡等[13]。
1.2 牛支原体的免疫机制 牛支原体可以诱导宿主产生辅助性T细胞和细胞毒性T细胞,并以时间依赖的方式影响宿主产生IgM、IgG和IgA抗体。与IgG2相比,牛支原体诱导宿主产生的IgG1更占优势[14]。IgG1抗体具有低调理素效应,会导致体液免疫反应不足和宿主中牛支原体的长期感染。牛支原体可通过直接激活淋巴细胞、巨噬细胞和中性粒细胞的细胞因子分泌,产生多种免疫调节产物。从宿主中消除牛支原体,细胞免疫反应比体液反应更成功[15]。通过接种疫苗可以增强细胞介导的免疫反应和体液免疫反应,以确保在疾病发作之前消除浸润粘膜部位的牛支原体。由于牛支原体可以定植于上呼吸道和扁桃体粘膜,因此牛支原体通常会产生局部粘膜免疫,其特征是高血清IgG和IgA反应[16]。这提示我们通过粘膜免疫防止牛支原体转移到其他组织和关节炎的产生是必要的。总之,为了预防牛支原体感染,全身抗体和局部粘膜部位的抗体都不可或缺。
2 牛支原体疫苗研究进展
2.1 灭活疫苗 灭活疫苗是一种生产工艺简单、免疫原性稳定、使用较为安全的疫苗研发路线。灭活疫苗的研发相对比较简单,其关键环节主要包括病原的获取、扩繁、灭活等工艺的确定以及安全性和有效性评价等。目前,美国有两种注册的用于预防牛支原体感染的疫苗,分别为Mycomune@R和Pulmo-GuardTMMpB。Mycomune@R和Pulmo-GuardTMMpB制造商建议的免疫方式均为4周龄以上犊牛颈部皮下注射,然后在38 d和56 d进行二免和三免。Soehnlena等[17]对这两种疫苗预防牛支原体感染犊牛引起的呼吸系统疾病的效果进行评估,结果表明两种疫苗都不能有效减少上呼吸道中牛支原体定植的数量,也不能减少牛支原体特异性病变的程度,免疫保护率分别为44%和小于1%。由此可见这两种商 品化疫苗均不能很好的预防牛支原体引起的牛呼吸系统疾病。
除了美国的两款商品化的牛支原体疫苗,还有一些处于研发验证阶段的牛支原体灭活疫苗。Nicholas等[18]研究表明牛支原体86B/96株制备的灭活疫苗可产生强大的保护作用。他们从英国一牛场分离得到该菌株,使用皂苷作为佐剂制备成灭活疫苗,通过皮下接种到3~4周龄的犊牛中;3周后,使用喷雾途径两次攻入从匈牙利分离出的牛支原体强毒株5063株;攻毒后3周进行解剖,期间观察小牛的临床症状和血清学反应;结果显示:接种组几乎没有临床症状并且免疫6个月后的犊牛依旧可以检测到高水平的体液免疫,未接种组出现肺部病变、直肠温度显著升高、体重增加显著减少。杨铭伟等[19]研究表明牛支原体新疆分离株制备的灭活疫苗能够产生良好的免疫应答反应,并能抵抗牛支原体感染所致的肺脏病变。他们通过甲醛灭活并加入油佐剂乳化制备牛支原体灭活疫苗,随后通过肌肉注射接种到10~15日龄的犊牛中,二免21 d使用相同菌株攻毒;通过分析抗体水平、临床症状、病理变化等指标表明制备的疫苗对牛支原体新疆分离株有较好的保护。Dudek等[20]证明牛支原体波兰分离株KP795974制备的疫苗具有临床保护作用;他们先将牛支原体皂苷混合成支原体-皂苷混合物,然后添加Emulsigen®佐剂制成双佐剂疫苗,通过颈部皮下注射3~4周龄的犊牛进行接种,3周后攻入同源菌株。通过临床观察、微生物学和免疫学测试表明,该疫苗减少了病理性肺损伤,阻止了病原入侵,产生了较高抗体水平并增强了IgA反应[20]。北京生泰尔科技股份有限公司使用牛支原体CO株和新型603水佐剂制备灭活疫苗,为每头牛经颈部皮下接种疫苗,2.0 mL/头,一免后21 d加强免疫一次。通过比较免疫组与安慰剂组在抗体水平、肺部病变、关节肿胀情况等方面的差异,从而认为该疫苗有很好的保护效果且至少可以持续6个月。
2.2 弱毒活疫苗 弱毒活疫苗是通过自然筛选或人工致弱等手段获得弱毒株后培养制备的疫苗。人工弱毒活疫苗又可以分为传代致弱毒活疫苗与重组致弱毒活疫苗。与灭活苗相比,弱毒活苗具有的优点是进入机体后能呈现所有的相关抗原,无需多次免疫就能保持持久的免疫力,且生产费用低廉。Zhang等[22]通过传代致弱的方式,将牛支原体HB0101株(CCTCC#M2010040)在41℃传代150代和180代使其产生变异而致弱,分别命名为P150和P180。为评估P150和P180菌株免疫后的保护作用,其将20头5~6个月大的雌性牛分为P150组、P180组、阳性对照(PC)和阴性对照(NC)组共4组,每组5只。P150组和P180组分别在鼻腔滴入10 mL 109CFU P150和P180,免疫46 d后,连续3 d使用10 mL 1010CFU的HB0101指数期培养物对P150组、P180组和PC组进行攻毒。根据病理学和肺部病理学评分,P150和P180免疫的保护率分别为87.7%和70.8%,说明P150和P180均具有较好保护作用,且P1 50更突出,更适合作为抗牛支原体感染的活疫苗候选株。
2.3 基因工程疫苗
2.3.1 亚单位疫苗 牛支原体亚单位疫苗的研究主要集中在牛支原体提取物及膜组分制备的传统亚单位疫苗、3-磷酸甘油醛脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase, GAPDH)相关重组疫苗以及表面膜蛋白相关重组疫苗。分离提取细菌的荚膜多糖、类毒素、表面蛋白等成分可以制备传统亚单位疫苗。Mulongo等[23]使用牛支原体总提取物以及膜组分作为抗原和含有未甲基化CpG基序的合成寡脱氧核苷酸(CpG ODN 2007)作为佐剂制备了两种牛支原体传统亚单位疫苗(总蛋白加膜蛋白组及膜蛋白组)。免疫实验表明,膜蛋白组仅IgG1滴度显著增加,而总蛋白加膜蛋白组IgG1和IgG2滴度均显著增加。但攻毒实验表明,总蛋白加膜蛋白组及膜蛋白组均不会诱导保护性免疫反应[23]。同时,该研究也说明CpG ODN 2007不会诱导平衡的Th1/Th2 抗体反应。
作为潜在疫苗靶点受到关注的一种蛋白质是保守的GAPDH蛋白。GAPDH不仅在葡萄糖代谢中起作用,还被证明可以结合细胞基质,也被假定为毒力因子。GAPDH的这些特性表明该蛋白可作为保护性抗原。Prysliak等[24]使用牛支原体的GAPDH和一种宿主防御肽研制出了一种嵌合蛋白Gap-I,该蛋白保留了各个组分的特性,但通过免疫保护实验发现,Gap-I未能保护饲养场的牛,且还有损伤肺部的风险。也许对于牛支原体的GAPDH蛋白,需要评估抗原传递系统。总之,牛支原体GAPDH似乎不适合用于疫苗,因为免疫的动物无法抵御牛支原体的攻击。
牛支原体具有3层膜结构,其内外2层为蛋白质,中间层为糖脂和脂多糖构成的脂质层,这种膜结构是抗原物质的主要存储场所。挑选表面膜蛋白作为疫苗靶标有两种思路:一种是选择保守的蛋白质,例如P81、P48;一种是免疫原性较高但高度可变的蛋白,例如可变表面蛋白(variantspecific surface proteins, Vsps)。张新竹等[25]将P81重组蛋白与弗氏佐剂混合制成疫苗对家兔进行三次免疫,家兔可产生高水平抗体,免疫攻毒组两只家兔在攻毒后体温恒定,肺部病变较未免疫组轻,证明P81蛋白产生的抗体对家兔有较好的保护作用;但作者未在牛上开展免疫保护相关实验,不能证明P81蛋白在牛上也会出现保护[25]。研究显示,直接感染牛支原体的牛比使用重组P48进行免疫的牛的抗体水平更高,说明P48蛋白不能用作疫苗靶标[26]。相对保守的牛支原体蛋白P26、HSP60、MilA、TrmFO、PdhA、PepA、Tuf、OppA、LppA、PepQ、O256、DeoB等都具有免疫反应,但是否能产生有效的免疫保护作用还需进一步验证[27-30]。Vsp家族由13种脂蛋白组成,它们可以通过基因重组产生高度的抗原变异[31]。在鉴定出的13种Vsps中,VspA、VspB和VspC具有最高的免疫原性[31]。表位作图实验显示,VspA、VspB、VspE和VspF蛋白出现在胚胎牛肺细胞黏附有相关的几个区域;但是这些表位是线性的,因此它们可能不是理想的疫苗靶标[31]。虽然高度可变的抗原具有较高的免疫原性,但从长远来看,高度抗原性变异可能会使疫苗无效。
2.3.2 DNA疫苗 DNA疫苗是指编码的蛋白质抗原基因通过克隆重组至真核表达质粒,将纯化的重组质粒直接注射至体内,使其抗原基因在机体细胞中表达出抗原,诱导体内特定的细胞和体液免疫反应,用于疾病预防或治疗。目前还未见牛支原体DNA疫苗的相关报道,但是在其他支原体上已有大量报道。Wium等[32]开发并评估使用OppA蛋白作为抗原的针对鸵鸟支原体感染的DNA疫苗通过免疫实验发现DNA疫苗能够引发鸵鸟的免疫反应。基于热休克蛋白P42的DNA疫苗在小鼠模型中诱导Th1和Th2免疫反应,并且来自免疫小鼠的抗血清能够在体外抑制猪肺炎支原体的生长[33]。LTB-P1C融合DNA疫苗在BALB/c小鼠模型中显示可刺激针对肺炎支原体感染的免疫保护,病理炎症较少[34]。这些研究的结果说明DNA疫苗可以被作为开发针对支原体感染的疫苗选择。当然,DNA疫苗在广泛应用之前,还需要克服靶基因选择、免疫耐受性、注射DNA与动物染色体的潜在整合以及体内不受控制的表达等困难。
3 小结
牛支原体是引起牛呼吸道疾病综合征的主要病原之一,也会引起奶牛的乳腺炎。由于牛支原体耐药问题越来越严重,使得治疗更加困难,饲养成本越来越高。另外,一直使用抗生素无法最终净化牛支原体,也会造成耐药性的公共安全问题。因此,迫切需要开发有效的疫苗来预防牛支原体感染。牛支原体疫苗包括灭活疫苗、减毒活疫苗和基因工程疫苗等多种类型。灭活疫苗存在使用一种分离株生产的疫苗可能无法对暴露于其他分离株的牛提供完全保护的问题。使用在所有牛支原体中都保守的重组蛋白可能是预防牛支原体感染更好的选择。然而,使用传统方法开发的牛支原体重组蛋白疫苗可能无法对牛产生最佳的保护作用。因此可能需要使用更先进的方法,例如反向疫苗学,筛选具有保护性免疫反应的候选抗原。
疫苗研制的一个重要环节就是疫苗评估,疫苗评估必须要做的工作是宿主动物免疫攻毒保护实验。因此为了能够评估牛支 原体候选疫苗(无论是灭活疫苗、减毒活疫苗、亚单位疫苗还是DNA疫苗),呼吸道疾病和乳腺炎都需要可再现的攻毒模型。犊牛牛支原体气溶胶挑战模型对进一步验证将是很有意义的[35]。除了可重复的攻毒模型,牛支原体 疫苗的开发过程中其他呼吸道病原体对牛支原体免疫效果的影响、Th-1和Th-2反应的平衡、牛支原体的免疫逃避等问题也不可避免。另外,牛支原体感染与免疫机制的进一步阐明也可能为更有效的疫苗开发提供便利。
