非洲猪瘟病毒MGF360-13L 蛋白的原核表达及多克隆抗体制备
2024-05-09陈世钰蒋亚君郭晓宇朱鸿飞
陈世钰,蒋亚君,鑫 婷,崔 帅,王 洋,郭晓宇,贾 红,朱鸿飞
(中国农业科学院北京畜牧兽医研究所,北京 100193)
非洲猪瘟(african swine fever, ASF)是由非洲猪瘟病毒(African swine fever virus, ASFV)引起的猪的急性、热性、高度接触性传染病,可感染不同年龄段、不同品种的猪,其中家猪最易感[1-2]。1921年在非洲肯尼亚发现该病疫情,之后传播至欧洲、拉丁美洲和亚洲等60多个国家[3-4]。2018年8月3号,我国首次报道在沈阳沈北新区发生非洲猪瘟疫情,疫点内913头生猪被扑杀和无害化处理[5-6]。
非洲猪瘟病毒属于非洲猪瘟病毒科、非洲猪瘟病毒属成员[7],为类似二十面体对称结构,有包囊。该病毒是目前唯一的DNA虫媒病毒[8]。不同毒株的病毒基因组大小有些许差异,长度为170~193 kb,含有150多个开放阅读框,共编码200多种蛋白质[9-10]。ASFV MGF360-13L属于多基因家族的一员,基因全长为1061 bp,编码353个氨基酸[11]。MGF360、530/505能够抑制Ⅰ型干扰素表达,同时抑制干扰素的抗病毒效应,并通过延长感染细胞的存活时间来提高病毒在宿主细胞中的增殖效率和数量[12-14]。此前,军兽研以我国流行毒株(SY-18)为亲本通过同源重组构建MGF和CD2V双缺疫苗候选株,结果显示,该候选株具有良好的攻毒保护效果[15]。由此可见,MGF基因可能在未来基因缺失苗研发中作为重要靶点。
因此,本研究合成了ASFV MGF360-13L基因,经诱导表达后获得重组蛋白并制备多克隆抗体,以期为阐述13L蛋白质生物学功能和非洲猪瘟新型疫苗研发奠定基础。
1 材料与方法
1.1 质粒及实验动物 pET-32a质粒由中国农业科学院北京畜牧兽医研究所兽医公共卫生安全与管理团队保存;大肠杆菌DH5α和BL21(DE3)感受态细胞均购自南京诺唯赞生物科技股份有限公司;SPF级6~8周龄BALB/c雌鼠购自北京维通利华实验动物技术有限公司;ASFV阳性血清来自中国动物疫病预防与控制中心攻毒猪灭活血清。
1.2 试剂BamHⅠ和XhoⅠ限制性内切酶、T4 DNA连接酶、2× PrimeSTAR HS DNA Polymerase均购自TaKaRa公司;PBS缓冲液购自Gibco公司;异丙基-β-D-硫代半乳糖苷(IPTG)购自天根生化科技(北京)有限公司;SDS-PAGE Gel Kit、超敏ECL化学发光试剂盒及DAB显色试剂盒均购自上海碧云天生物技术有限公司;His Trap FFcrude预装柱购自GE公司;弗氏完全佐剂、弗氏不完全佐剂均购自Sigma公司;HRP标记羊抗鼠二抗购自北京中杉金桥生物技术有限公司;Trans2K Plus DNA Marker、Trans8K DNA Marker均购自北京全式金生物技术有限公司;蛋白质分子量标准(26616)购自Thermo公司;其余试剂均为国产分析纯。
1.3 MGF360-13L多基因家族序列比较与分析 查询并下载NCBI数据库中31株ASFV毒株基因组数据,选择其中的所有MGF360-13L基因序列,利用DNAstar7.1、SnapGene3.2.1和BioEdit等分析软件对所有MGF360-13L基因序列进行多序列比对、构建基因进化树、结构同源性分析等。
1.4 MGF360-13L基因的合成及重组质粒的构建 根据ASFV Georgia 2007/1株MGF360-13L基因序列(GenBank登录号:FR682468.1)进行密码子优化后合成该基因,连接至pUC57质粒,命名为pUC57-13L,由南京金斯瑞生物科技有限公司合成。利用Primer Premier 5.0软件设计相关引物,13L-F:5'-cgcggatccATGTCGTTGCCGCTCT-3';13L-R:5'-ccgctcgagTTATAGTATATTATGAGAA TATTCCC-3'。上、下游引物的划线部分为引入的BamHⅠ、XhoⅠ内切酶位点,并加入保护性碱基,引物由北京擎科新业生物技术有限公司合成。用该对引物进行PCR扩增,反应体系为:Master Mix 25 μL,上、下游引物各1 μL,质粒DNA 2 μL,ddH2O 21 μL。PCR反应程序为:95℃预变性3 min;95℃变性15 s,55℃退火15 s,72℃延伸20 s,共35个循环;72℃延伸5 min。PCR产物进行1%琼脂糖凝胶电泳,切胶回收PCR产物,与pET32a质粒分别经BamHⅠ、XhoⅠ双酶切后,回收酶切产物,采用T4 DNA连接酶连接过夜,连接产物转化至E.coliDH5α感受态细胞。挑取单菌落送至擎科生物进行测序,用质粒提取试剂盒提取重组质粒,采用BamHⅠ、XhoⅠ双酶切,酶切产物进行琼脂糖凝胶电泳,将测序及双酶切鉴定正确的阳性重组质粒命名为pET32a-13L。
1.5 13L蛋白的最佳诱导条件及可溶性分析 将pET32a-13L按以上方法转化BL21(DE3)感受态细胞。挑取单菌落,标记为pET32a-13L/BL21,接种至5 mL氨苄抗性(50 μg/mL)的LB培养基中,置37℃摇床中过夜培养,培养后的菌液再按1∶100比例接种至50 mL氨苄抗性(50 μg/mL)的LB培养基中培养,待OD600值达到0.6~0.8时(约2 h),每管培养基加入终浓度为1 mmol/L的IPTG诱导剂分别在16℃和37℃下诱导15 h,10 000 ×g离心5 min,收集菌体,进行超声破碎,10 000 ×g离心10 min后分别收集上清液与沉淀,进行SDS-PAGE电泳分析表达产物可溶性。
1.6 蛋白纯化及鉴定 取pET32a-13L/BL21按1∶100比例接种至1 L氨苄抗性(50 μg/mL)的LB培养基中,置37℃摇床培养至OD600值达到0.6~0.8后按比例加入终浓度为1 mmol/L的IPTG诱导剂,16℃诱导12 h后收集菌体,进行超声破碎,10 000 ×g离心10 min后收集沉淀。将沉淀先用8 mol/L脲素变性,再进行梯度复性,具体纯化步骤参考文献[16]纯化方法。
取纯化后的蛋白进行SDS-PAGE电泳,300 mA 70 min转NC膜,5%脱脂乳4℃封闭过夜,洗涤后加入1∶100稀释的ASFV阳性灭活血清,37℃孵育1~2 h,PBST洗涤3次后加入1∶5000稀释的羊抗猪二抗,37℃孵育1 h,洗涤后ECL化学发光显色。
1.7 制备重组蛋白多克隆抗体 将纯化后的蛋白与弗氏完全佐剂按1∶1比例混合均匀后超声乳化,按照50 μg/只剂量免疫BALB/c小鼠,对照组注射等体积的PBS。间隔2周后用同剂量蛋白与弗氏不完全佐剂1∶1混匀乳化后进行二免,共免疫3次,于三免后1周采血,离心分离血清,用于抗体特异性及效价检测。采用方阵滴定法测定多克隆抗体效价。具体步骤为:将所纯化的13L蛋白(0.223 mg/mL)进行倍比稀释包被ELISA板,100 μL/孔,4℃包被过夜;洗板后用5%脱脂乳封闭,200 μL/孔,37℃封闭2 h;PBST洗涤3次;将分离血清倍比稀释后加入反应孔,100 μL/孔,37℃反应1 h;洗涤3次,加入1∶5000稀释的辣根酶标记山羊抗小鼠IgG(H+L),100 μL/孔,37℃孵育1 h;PBST洗涤3次,加入TMB显色液显色,100 μL/孔,室温显色20 min,加入1 mol/L HCl终止液,50 μL/孔,待稳定后测定OD450吸光值。
1.8 Western blot检测 取纯化后的蛋白进行SDSPAGE电泳,300 mA 70 min转NC膜,5%脱脂乳4℃封闭过夜;PBST洗涤3次,加入稀释血清37℃孵育1 h;PBST洗涤3次,加入1∶5000稀释的辣根酶标记山羊抗小鼠IgG(H+L),37℃孵育1 h;洗涤后ECL化学发光显色。
2 结果与讨论
2.1 MGF360-13L多基因家族序列比较 利用NCBI在线数据库检索ASFV基因组,共获得31株不同毒株基因组序列,详见表1。其中仅有18株ASFV拥有该基因,长度均约1062 kb。目前,NCBI数据库内中国所提交的毒株均属于基因Ⅱ型,通过DNAStar序列比对,MGF360-13L基因高度保守,且基因Ⅰ型和Ⅱ型ASFV毒株的核苷酸序列具有约97%的同源性,与Ⅰ型和Ⅱ型ASFV毒株遗传进化上的结果接近。而与Ⅲ型和Ⅸ型的两株核苷酸序列相差较大,仅有88%左右的相似性。
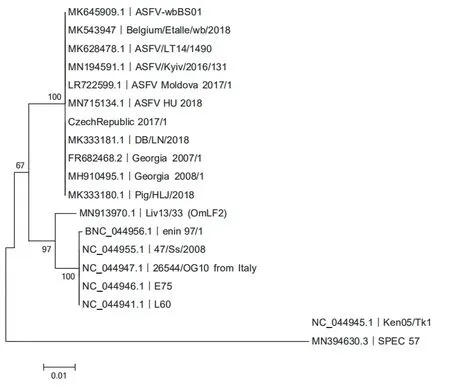
图1 ASFV 毒株MGF360-13L 基因遗传进化树Fig.1 Evolution tree of MGF360-13L gene of ASFV strain

表1 不同ASFV 毒株MGF360-13L 基因存在信息Table1 Information on MGF 360-13L genes diff erent ASFV strains
2.2 MGF360-13L重组质粒的构建及鉴定 将构建的pET32a-13L重组质粒用BamHⅠ、XhoⅠ进行双酶切,结果显示大小分别为6000 bp和1100 bp两条带,与载体5900 bp和目的片段1074 bp的大小相符(图2)。测序结果与ASFV Georgia 2007/1株MGF360-13L基因序列一致,表明pET32a-13L重组质粒构建成功。

图2 pET32a-13L 重组质粒双酶切鉴定Fig.2 Double enzyme digestion of the recombinant plasmid pET32a-13L
2.3 蛋白的最佳诱导条件及可溶性分析 取pET32a-13L/BL21接种50 mL氨苄抗性(50 μg/mL)的LB培养基,加入终浓度1 mmol/L的IPTG诱导剂分别于16℃和37℃条件下诱导表达,每隔3 h取样1次,制备样品进行SDS-PAGE鉴定。结果显示于16℃诱导12 h时蛋白表达量较高(图3A),杂蛋白量较少,且均为包涵体表达(图4)。
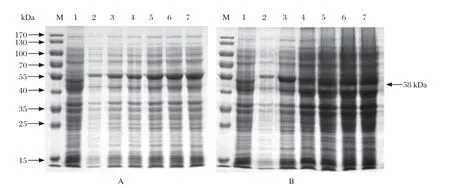
图3 不同温度诱导的不同时间下13L 重组蛋白的表达情况Fig.3 Expression of recombinant protein 13L at diff erent temperatures and diff erent time

图4 13L 重组蛋白的可溶性分析Fig.4 Solubility analysis of the recombinant protein 13L
2.4 13L蛋白的纯化鉴定 将经过包涵体变性和复性纯化后的重组蛋白进行SDS-PAGE和Western blot鉴定。结果显示60 kDa左右处有一特异性条带(图5A),表明重组蛋白正确表达。经Western blot检测,该重组蛋白能够与阳性灭活血清发生特异性反应(图5B)。

图5 纯化后重组蛋白13L 的SDS-PAGE(A)和阳性灭活血清Western blot(B)鉴定Fig.5 SDS-PAGE (A) analysis and positive inactivated serum Western blot (B) identif ication of the purif ied recombinant protein 13L
2.5 重组蛋白多克隆抗体效价检测 13L重组蛋白免疫小鼠,三免1周后采血分离血清,利用间接ELISA检测鼠源多克隆抗体的效价。结果表明,PBS对照组均为阴性,该多克隆抗体的效价高达1∶256 000(图6)。

图6 重组蛋白13L 鼠源多克隆抗体效价检测Fig.6 Titer determination of mouse polyclonal antibody against recombinant protein13L

图7 重组蛋白13L 鼠源多克隆抗体Western blot 鉴定Fig.7 Western blot identif ication of mouse polyclonal antibody against recombinant protein 13L
2.6 Western blot检测 以制备的多克隆抗体为一抗进行Western blot,在约60 kDa处出现特异性条带(图9),表明该多克隆抗体可特异性结合13L重组蛋白,具有良好的反应性和特异性。阴性对照组无反应。
2018年8月,我国首例非洲猪瘟疫情在辽宁沈阳暴发[6],至今还未有商品化疫苗供应,给我国养猪业造成了沉重的打击和巨大的经济损失。因此,建立快速有效的检测方法极为重要[17]。目前常用的检测手段主要分为两大类:免疫学检测方法和分子生物学检测方法,包括免疫印迹法、酶联免疫吸附法、免疫层析试纸条法和血吸附法、常规PCR、荧光定量PCR和数字PCR[18]。基于抗原抗体检测的ELISA法因操作简单、重复性好、特异性强而广泛应用。其中,荣明轩等[19]以不含多聚组氨酸标签的ASFV p30抗原作为包被抗原,建立一种间接ELISA抗体检测方法,消除了带有His标签造成的假阳性反应,具有良好的特异性、灵敏性和可重复性;庚辛等[20]成功表达ASFV p72蛋白并建立间接ELISA检测方法,通过对该方法敏感性、特异性、重复性分析,证明该方法可用于临床样品检测。本实验制备的MGF-13L重组蛋白为新的ELISA方法建立提供了候选可能。
本研究构建了pET32a-13L原核表达载体,经诱导后成功获得包涵体形式表达的13L重组蛋白,大小为58.2 kDa,经Western blot鉴定该蛋白能与阳性灭活血清反应。13L蛋白免疫BALB/c小鼠制备多克隆抗体,ELISA检测效价为1∶256 000,Western blot结果显示其特异性良好。本研究所制备蛋白及多克隆抗体可继续用于蛋白功能及重组活载体疫苗插入基因表达情况的特异性鉴定。
综上,该研究制备的重组蛋白为进一步研究MGF360-13L蛋白功能、相关血清学检测方法等建立奠定基础。
