巯基丙酮酸硫基转移酶介导PI3K/AKT信号对急性胰腺炎细胞模型凋亡和自噬的影响
2024-05-09王小红翁文俊周国雄朱顺星祁小鸣程睿智
王小红,钱 晶,翁文俊,周国雄,朱顺星,祁小鸣,刘 春,程睿智
(南京鼓楼医院集团仪征医院 1.消化内科,2.普通外科,3.心胸外科,江苏 仪征 211900;4.南通大学附属医院 消化内科,江苏 南通226006;5.南通大学 实验动物中心,江苏 南通 226001)
急性胰腺炎(acute pancreatitis,AP)是需要紧急入院的常见消化系统疾病,其中约20%的病人会发展成重症急性胰腺炎(severe acute pancreatitis,SAP)。SAP具有发病急、进展快等特征,病死率高达30%,甚至可出现全身炎症反应综合征,影响预后并可并发多器官功能不全综合征,严重威胁病人生活质量和生命安全[1],明确AP的发病机制并探索治疗靶点具有重要意义。巯基丙酮酸硫基转移酶(mercaptopyruvate sulfurtransferase,MPST)是一种广泛存在于多种组织器官中的硫基转移酶,可催化线粒体内源性硫化氢(hydrogen sulfide,H2S)生成,是调控H2S生成的关键酶,广泛参与炎症、细胞凋亡和血管松弛等病理生理过程[2]。H2S是一种功能相关介质,其异常产生与哺乳动物组织的炎症有关[3]。我们的前期动物实验结果表明,MPST可通过NF-κB信号诱导胰腺组织自噬和炎症反应,进而加重大鼠SAP病情;抑制MPST对SAP大鼠具有保护作用。然而,MPST在AP中的靶向作用细胞仍不明确。本研究将小鼠胰腺腺泡细胞266-6作为研究对象,构建AP体外细胞模型,探讨MPST对AP的具体作用及可能机制,为临床AP治疗提供新方向。
1 材料与方法
1.1 细胞株
小鼠胰腺腺泡细胞株266-6购自ATCC细胞库。
1.2 仪器
正置显微镜(UB203i-POL,重庆澳浦光电技术有限公司,中国);凝胶电泳仪(EPS300,Tanon,中国);流式细胞仪(FACSCelesta,BD,美国);凝胶成像仪(5200/5200R,Tanon,中国);酶标仪(Multiskan FC,ThermoFisher,美国)。
1.3 主要药品及试剂
肠促胰酶肽(cholecystokinin,CCK)(产品货号96827-04-2,上海楚肽生物科技有限公司,中国);细胞计数试剂盒8(cell counting kit-8,CCK-8)(产品货号KTC011001,abbkine,中国);MPST一抗(产品批号A11587,ABclonal,中国)、微管相关蛋白 1 轻链 3(microtubule-associated protein 1 light chain 3,LC3)Ⅱ/Ⅰ一抗(产品批号E-AB-61027,Elabscience,中国)、beclin1一抗(产品批号abx125564,Abbexa,英国)、自噬相关基因5 (autophagy related gene 5,ATG5)一抗(产品批号E-AB-60008,Elabscience,中国)、β-actin一抗(产品批号ab6276,Abcam,美国)、甘油醛-3-磷酸脱氢酶(glyceraldehyde- 3-phosphate dehydrogenase,GAPDH)一抗(产品批号ab181602,Abcam,美国);小鼠淀粉酶酶联免疫吸附试验ELISA试剂盒(产品货号EY-M98729,上海一研生物科技有限公司,中国),小鼠肿瘤坏死因子(tumor necrosis factor,TNF)-α (产品批号SEKM-0034)、白细胞介素(interleukin,IL)-1(产品批号SEKM-0002)和IL-6 (产品批号SEKM-0007)ELISA试剂盒(Solarbio,中国);Annexin V-FITC/PI凋亡检测试剂盒(产品批号CA1020,Solarbio,中国);Lipofectamine 3000转染试剂(产品货号L3000001,Invitrogen,美国);MPST干扰质粒(siMPST)、MPST过表达质粒(oeMPST)和阴性对照(NC)购自于汉恒生物技术有限公司。
1.4 方法
1.4.1 细胞培养 将266-6小鼠胰腺腺泡细胞株复苏于细胞培养瓶中,加入含10% FBS的DMEM培养基5 mL,放入37 ℃ 5%CO2的增湿培养箱中培养,每48 h观察细胞状态并更换培养基。
1.4.2 AP细胞模型建立 将266-6小鼠胰腺腺泡细胞传代至6孔板中,常规培养换液。观察细胞生长融合率至70%~80%后,加入终浓度为10 μmol/L的CCK试剂,对照组加入等量PBS溶液,分别在0、6、12、24 h收集细胞进行细胞或分子生物学后续研究。
1.4.3 细胞上清液淀粉酶活性水平检测 收集0、6、12、24 h细胞上清液1 mL,采用ELISA试剂盒进行淀粉酶活性水平检测,操作严格按说明书进行。
1.4.4 细胞转染和分组 将266-6小鼠胰腺腺泡细胞以1×106个细胞/孔传代至6孔板中,培养24 h至细胞贴壁,更换为无血清培养基。将Lipofectamine 3000和质粒稀释:125 μL无血清培养基+5 μL Lipofectamine 3000;125 μL无血清培养基+2.5 μg DNA+5 μL Lipofectamine 3000溶液。将两管混合,室温放置20 min。将混合后的Lipofectamine 3000+质粒试剂加入孔板中,6 h后更换为含10% FBS的DMEM培养基,继续后续实验或AP造模。根据AP造模和转染质粒载体类型将细胞分为4组,分别为:CON组(无AP造模+对照质粒)、AP组(AP造模+对照质粒)、AP+siMPST组(AP造模+MPST干扰质粒)和AP+oeMPST组(AP造模+MPST过表达质粒)。
1.4.5 CCK-8检测 将266-6小鼠胰腺腺泡细胞以5×104个/孔传代至96孔板中,设置6个平行副孔,孵育24 h使细胞贴壁。根据上述方法进行各组模型建立后,每孔加入10 μL CCK-8工作液,37 ℃孵育1 h,450 nm波长测定吸光度,记录并绘制曲线。
1.4.6 细胞上清液炎症因子检测 收集各组细胞上清液1 mL,采用小鼠TNF-α、IL-1和IL-6 ELISA试剂盒进行炎症因子检测,操作严格按说明书进行。
1.4.7 凋亡检测 收集各组细胞至1.5 mL EP管中,计算细胞浓度,将细胞分装为每管1×106/mL,离心洗涤3 min×2次;将细胞悬液转移至流式管内。各组设置流式双荧光检测分管:空白对照、单阳管和双阳管。室温孵育15 min后,使用流式细胞仪FITC和PI通道进行双荧光检测,即使用空白对照设置电压,使用单阳管调节补偿;每组检测5 000个细胞,使用Flowjo软件进行流式分析。
1.4.8 Western blotting蛋白水平检测 收集各组细胞,通过RIPA/PMSF法提取蛋白,BCA法蛋白定量,与上样缓冲液混合配制蛋白样本。15 μg样品上样,经电泳、转膜、5%脱脂牛奶封闭后,以1∶1 000浓度的LC3 Ⅱ/Ⅰ、beclin1、ATG5、MPST、磷脂酰肌醇3-激酶(PI3K)、磷酸化PI3K(p-PI3K)、丝氨酸-苏氨酸蛋白激酶(AKT)、p-AKT、β-actin或GAPDH一抗4 ℃孵育过夜。洗膜后,以对应1∶2 000二抗室温孵育1 h。洗膜后,应用化学发光法显色,拍照并分析。
1.5 统计学方法
采用单因素方差分析和LSD-t检验。
2 结果
2.1 CCK处理对细胞上清液淀粉酶活性水平、细胞活力和MPST蛋白表达水平的影响
10 μmol/L CCK处理266-6细胞,细胞上清淀粉酶活性水平和MPST蛋白水平均0~12 h呈上升趋势(P<0.01), 12 h达到高峰,24 h时回落(P<0.05和P<0.01);细胞存活率0~12 h呈下降趋势(P<0.01),24 h时保持平稳状态(见图1、表1)。结果表明AP体外细胞模型成功建立,后续AP细胞造模条件为:10 μmol/L CCK处理266-6小鼠胰腺腺泡细胞12 h。
表1 不同时间细胞上清液淀粉酶活性水平、细胞存活率和MPST蛋白表达水平的比较
2.2 调控MPST对AP体外模型细胞活力和凋亡的影响
与CON组相比,AP组、AP+siMPST组和AP+oeMPST组的细胞存活率均显著降低(P<0.01),AP+siMPST组的细胞存活率高于AP组(P<0.01),而AP+oeMPST组的细胞存活率则低于AP组(P<0.01);与CON组相比,AP组、AP+siMPST组和AP+oeMPST组的细胞凋亡率均明显上升(P<0.01),但AP+siMPST组的凋亡率明显低于AP组(P<0.01),AP+ oeMPST组明显高于AP组(P<0.01)(见图2、表2)。
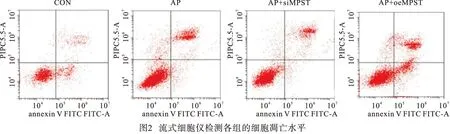
表2 各组细胞存活率和凋亡率的比较
2.3 调控MPST对AP体外模型细胞上清液炎症因子表达水平的影响
AP组、AP+siMPST组和AP+oeMPST组的TNF-α、IL-1和IL-6水平均明显高于CON组(P<0.01);AP+siMPST组TNF-α、IL-1和IL-6水平均明显低于AP组(P<0.01),而AP+oeMPST组则明显高于AP组(P<0.01)(见表3)。
表3 各组细胞上清液TNF-α、IL-1和IL-6表达水平的比较
2.4 调控MPST对AP体外模型细胞自噬相关因子水平及PI3K/AKT信号通路的影响
Western blotting结果显示,AP组、AP+oeMPST组腺泡细胞LC3 Ⅱ/Ⅰ、beclin1、ATG5、MPST、p-PI3K/PI3K、p-AKT/AKT水平均明显高于CON组(P<0.01);AP+siMPST组上述指标水平均明显低于AP组(P<0.01),而AP+oeMPST组上述指标水平则均明显高于AP组(P<0.01)(见图3~4、表4)。
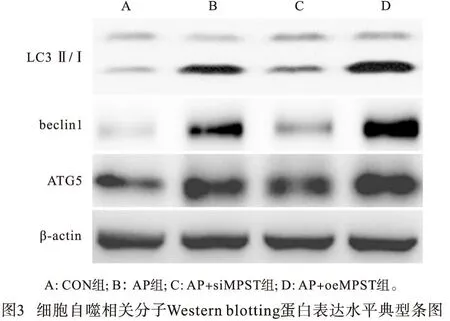
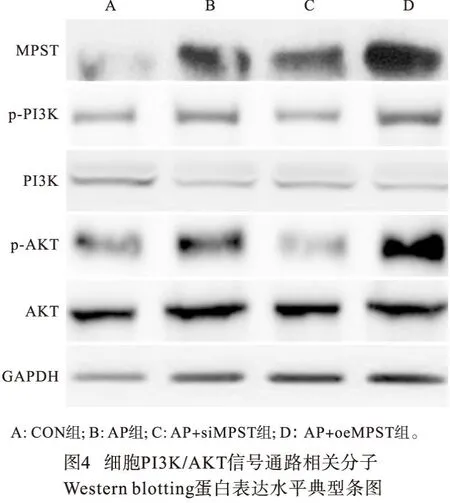
表4 各组细胞LC3 Ⅱ/Ⅰ、beclin1、ATG5、MPST、p-PI3K/ PI3K、p-AKT/AKT Western blotting蛋白表达水平比较
3 讨论
尽管对于AP的疾病预测、严重程度评价、治疗和预后评估在过去十年中迅速发展,但AP仍然是一种复杂的疾病,其发病机制尚不清楚[4]。更重要的是,在目前临床治疗中尚无特异性的AP治疗药物。因此,明确AP的发病机制对寻找AP新治疗靶点具有重要意义。
MSPT是催化内源性H2S生成的关键酶之一,可催化3-巯基丙酮酸转化为丙酮酸,从而形成过硫化物和H2S,可见其与硫代谢相关的重要生理功能密切相关[5]。有研究[6]显示,H2S参与AP的炎症反应过程;LIU等[7]研究也显示,H2S可通过PI3K/Akt/Sp1信号通路促进SAP炎症反应的发生。然而,MSPT作为H2S代谢关键酶,其在AP中作用的研究仍严重不足。本研究成功构建了AP体外细胞模型,结果显示AP细胞模型的MSPT表达和相关炎症因子TNF-α、IL-1、IL-6水平显著升高,提示MSPT可能在AP中发挥促炎作用。BRONOWICKA等[8]研究发现,AP胰腺组织中半胱氨酸水平显著升高可能是由于MPST催化的反应中半胱氨酸消耗率降低所致,提示MPST相关H2S代谢与AP密切相关;另一项研究显示,在经雨蛙素处理AR42J细胞的AP模型中鉴定出了包括MPST在内的5种差异表达的蛋白升高[9],支持本研究结果。
为阐明MPST对AP的确切作用,本研究在AP体外造模基础上,应用质粒载体转染技术。结果显示,过表达MSPT的AP细胞模型的炎症因子、凋亡和自噬水平均较AP组显著升高,提示MSPT水平的上调可加剧AP的病理生理学反应;反之,下调MSPT水平可显著改善AP细胞模型炎症因子、凋亡和自噬水平,起到治疗作用,提示MSPT可能作为一种AP的新治疗靶点。自噬和凋亡紊乱在AP发病过程中发挥重要的作用。有研究显示,在AP中存在损伤性的、不完全的自噬激活,诱导溶酶体功能缺失,酶原累积在自噬溶酶体中,导致胰蛋白酶活化,最终导致AP[10]。AP中的自噬反应与beclin1介导的吞噬作用有关,并涉及ATG5等复合物和LC3的泛素化偶联系统控制[11]。自噬和凋亡的信号通路具有明显的相互作用连接,如beclin1不仅可调控自噬,也作为促凋亡切割受损中的靶点而被广泛研究[12]。本研究也发现特异性调控MPST可通过改变LC3 Ⅱ/Ⅰ、beclin1和ATG5等分子表达影响266-6小鼠胰腺腺泡细胞的自噬和凋亡水平。
在AP中,PI3K/AKT信号通路也发挥重要作用。XU等[13]通过PI3K/AKT的抑制剂麦芽甘素处理AP模型,发现抑制PI3K/AKT可有效降低AP小鼠血清淀粉酶和炎症因子活化,改善胰腺组织学坏死程度;转录组学研究发现,PI3K/AKT信号通路与肥胖相关酒精诱导的AP有关[14]。本研究结果显示,上调MPST可激活PI3K/AKT通路介导AP体外模型的自噬、凋亡和炎症反应;反之,下调MPST可抑制PI3K/AKT通路表达。然而,MPST与PI3K/AKT通路的相关性研究较少。HU等[15]研究显示,MPST可能通过H2S代谢调控胰腺癌的侵袭和迁移,此过程可能与PI3K/AKT通路相关。
综上所述,本研究结果说明MSPT可通过介导PI3K/AKT信号调控AP体外模型细胞的凋亡与自噬反应,降低MSPT水平可能对AP具有一定的治疗作用。然而,鉴于MSPT的复杂机理和与H2S可能协同作用的多样性,本研究仅部分揭示了MSPT对AP作用的潜在机制,仍需要进一步深入研究。
