挤压、发酵对燕麦营养及抗氧化性影响的研究
2024-05-08何静瑞张宜硕马利华徐咏铭刘昇霖
何静瑞, 张宜硕, 马利华, 徐咏铭, 刘昇霖
(徐州工程学院食品与生物工程学院,徐州 221111)
燕麦富含蛋白质、膳食纤维、淀粉、脂质等为人体代谢所必需的基本营养成分[1],还含有诸多对人体具有健康功效的生物活性物质,如β-葡聚糖等[2],此外,还含有一些干扰营养物质消化吸收的抗营养因子。目前国内外通常采用物理法(高温流化、超高压、辐照、超微粉碎等)[3],生物法(萌芽、添加外源酶、生物发酵法等)[4],或者物理和生物结合的方法等[5],对食品原料进行处理,可以提高食品的品质及营养价值。发酵不仅可以改善产品风味、增加色泽、减少刺激性物质,还可以产生黄酮类、有机酸等新的活性成分,从而极大改善产品的营养品质[6]。如叶彦均[7]筛选出最佳固态发酵糙米的菌种,对糙米进行固态发酵,显著改善了糙米的加工、营养及感官品质。曾甄等[8]利用几种益生菌发酵牡蛎制备活性肽,总抗氧化性能显著提升。挤压技术因原料适应性广、对营养成分破坏程度小、破坏抗营养因子等优势被广泛应用于谷物食品的加工生产。在挤压的过程中,高温、高压和高剪切力会引起高分子聚合物在分子水平上发生物理以及化学反应,这些反应可以使食品的性状发生改变,更有利于产品的开发[9,10]。如缪小兰等[11]采用挤压膨化技术,研究利用碎米和胡萝卜制作速溶米糊,为碎米综合利用提供了一条新的途径。Sun等[12]研究表明,在经过双螺杆挤压后,稻米和小麦的体外消化率大大提高,更有益于消化和吸收。邓珂等[13]研究发现挤压膨化处理的豆芋总黄酮质量分数增加了19.68%,是保留总黄酮的最佳加工方法。
研究采用挤压膨化耦合微生物发酵技术,处理燕麦,研究挤压技术复合微生物发酵对燕麦中β-葡聚糖含量、生物利用率、淀粉的消化性及体外抗氧化性的影响,为开发燕麦新产品提供参考。
1 材料与方法
1.1 材料与试剂
燕麦,酵素菌,植物乳杆菌N13、保加利亚乳杆菌、瑞士乳杆菌、肠膜明串珠菌肠膜亚种、嗜热链球菌。
刚果红、葡萄糖、磷酸氢二钾、磷酸二氢钠,过硫酸钾,碘、碘化钾、磷酸、考马斯亮蓝G250:均为分析纯;直链淀粉标准物、支链淀粉标准物;α-淀粉酶(100 U/mg);福林酚、 2,2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、1.1-二苯基-2-苦肼基(DPPH)。
1.2 仪器与设备
723C可见分光光度计,SLG32-Ⅱ双螺杆挤压实验机,RHJ-202-2电热恒温培养箱,DHG-101鼓风干燥箱,TG-16W-I高速离心机,JJ-2高速组织捣碎机,NDJ79旋转表观黏度仪。
1.3 方法
1.3.1 燕麦样品的挤压膨化处理
选取300 g燕麦,干燥,磨粉,添加45 mL水,主轴传送速度为30,调整膨化机前三区温度为70、90、120 ℃,第四区温度分别设置为160 ℃,挤压膨化后,干燥,磨粉,待用。
1.3.2 燕麦发酵处理
取燕麦粉100 g,加入1 000 mL的水,混合均匀后加入1 g发酵菌粉,30 ℃恒温培养箱中进行发酵72 h,发酵结束后过滤,取滤渣,干燥,磨粉,备用。样品1:未做处理的燕麦粉; 样品2:挤压膨化处理的燕麦粉;样品3:发酵处理的燕麦粉 ;样品4:挤压+发酵处理的燕麦粉。
1.3.3 淀粉含量测定
测定方法参考GB 5514—2008《粮油检验 粮食、油料中淀粉含量测定》[14]。
1.3.4 可溶性蛋白质含量测定
参考考马斯亮蓝G-250法[15]。
1.3.5 β-葡聚糖含量测定
取1.2.2处理的样品适量,参考刚果红显色法[16],测样品中β-葡聚糖的含量,得标准曲线:Y=0.003 6X+0.129,R2=0.993 5。
式中:C为标准曲线中β-葡聚糖的质量浓度/mg/mL;N为样品稀释的倍数;V为样品定容总体积/mL;m为样品的质量/g。
1.3.6 燕麦粉溶液表观表观黏度测定
根据黄婧琦等[17]方法取不同处理的燕麦粉,配制质量浓度1 mg/100 mL溶液,煮沸后冷却,过滤,取上清液,采用NDJ79旋转表观黏度仪测定,测试条件:室温,第Ⅱ单元转子,转速30 r/min。
1.3.7 多酚含量的测定
采用福林酚比色法[18]测燕麦酵素中多酚的含量,得标准曲线:Y=0.960 8X+0.012 41,R2=0.994 9。

式中:C为标准曲线中多酚的质量浓度/mg/mL;N为样品稀释的倍数;V为样品定容的总体积/mL;m为样品的质量/g。
1.3.8 黄酮含量的测定
采用硝酸铝显色法[19]测燕麦酵素中黄酮含量,芦丁为标准品得标准曲线:Y=0.198X+0.005,R2=0.991 2。

式中:C为标准曲线中黄酮的质量浓度/mg/mL;N为样品稀释的倍数;V为样品定容的总体积/mL;m为样品的质量/g。
1.3.9 淀粉体外消化能力的测定
淀粉的体外消化率根据参考文献的方法[20]。
Y=0.787X-0.065R2=0.999
式中:Y为吸光度;X为样品的还原糖质量浓度/mg/mL。
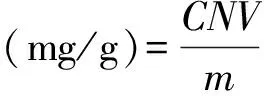
式中:C为标准曲线中β-葡聚糖的质量浓度/mg/mL;N为样品稀释的倍数;V为样品定容的总体积/mL;m为样品的质量/g。
根据实验结果求出RDS、SDS和RS的质量分数,计算公式为:
式中:RDS为快速消化淀粉;SDS为慢速消化淀粉;RS为抗性淀粉;Gp为酶解前游离的葡萄糖质量/mg;G20为水解20 min后的葡萄糖质量/mg;G120为水解120 min后的葡萄糖质量/mg;TS为样品中总淀粉的质量/mg。
1.3.10 直链淀粉与支链淀粉的测定
根据刘襄河等[21]的方法测定。
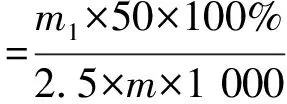

式中:m为样品质量/g ;m1为直链淀粉质量/g;m2为支链淀粉质量/g。
1.3.11 生物可给率测定
参考王军等[22]方法,采用2个阶段体外模拟胃-肠液法[23]测定燕麦酵素粉中β-葡聚糖的生物可给率,收集透析袋中的消化产物测定β-葡聚糖总量:

1.3.12 体外抗氧化性能测定
清除ABTS+·活性的测定:取1 g燕麦粉样品加入10 mL蒸馏水,摇匀后静置1 h,过滤,取上清液备用。用7 mmol/L ABTS(用 5 mmol/L PBS,pH 7.4 ),加入过硫酸钾最终浓度为 2.45 mmol/L,在室温下黑暗放置 12~16 h。使用前把 ABTS溶液用 PBS 稀释。取 8 μL 样品,用磷酸缓冲液(5 mmol/L,pH 7.4)补至 12 μL,加入 200 μL ABTS 溶液, 30 ℃反应1 h。以去离子水为对照,在 734 nm下测定吸光度,计算样品的ABTS+·清除能力[24]。

式中:A0为空白对照液的吸光度;A1为样品测定管的吸光度;A2为样品本底管的吸光度。
DPPH自由基活性的测定:称取0.012 8 g DPPH加水溶解,定容,利用DPPH的溶液特征紫红色团的吸收峰,用分光光度法测定加抗氧化剂提取液后,在波长517 nm处吸收的下降表示其对有自由基清除能力。样品对DPPH自由基的清除能力SA为:
式中:A0为DPPH +体积分数80%乙醇溶液;Ai为DPPH+样品溶液;Aj为样品溶液+ 体积分数80%乙醇溶液。
取DPPH母液5 mL,加入样品及参照液,定容,20 ℃恒温30 min,于517 nm波长下测定吸光度[25]。半数清除率IC50:清除率达到50%时样品质量浓度/mg/mL。
1.3.13 数据分析
依据公式进行计算,用Origin软件处理,并采用SPSS统计分析方法进行单因素方差分析,Excel作图,不同小写字母表示差异显著(P<0.05)。
2 结果与讨论
2.1 几种处理对燕麦中淀粉含量及可溶性蛋白质含量的影响
淀粉和蛋白质是燕麦中主要的干物质,几种处理对燕麦中的淀粉含量无明显影响;挤压膨化的高温高压激活了酶活性,使蛋白质酶水解程度加大,食物中组成、结构各异的蛋白质在受到压力的作用时,蛋白质结构会受到破坏,诱导其展开重新聚集[22],发生十分复杂的化学变化,使蛋白质降解[5],导致蛋白质含量下降;微生物生长繁殖分解蛋白质成为氨基酸,从而导可溶性致蛋白质含量有所降低。实验结果显示(图1):挤压膨化耦合发酵后燕麦中可溶性蛋白质含量比对照显著(P<0.05)降低了20.34%,比单纯挤压处理降低了15.95%,比单纯微生物发酵降低了10.45%。
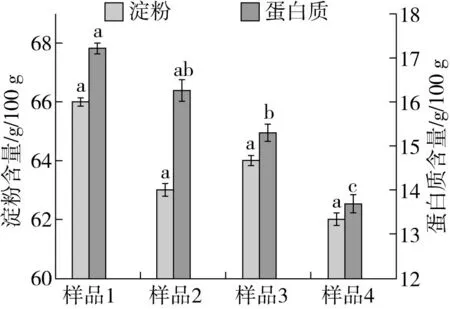
图1 几种处理对淀粉及蛋白质含量的影响
2.2 几种处理对燕麦中β-葡聚糖含量及表观黏度的影响
β-葡聚糖是由葡萄糖单位组成的多聚糖,广泛存在于香菇、灵芝和燕麦等各种真菌与植物中,是它们发挥保健作用主要功效物质[26]。实验结果显示(图2),挤压膨化处理与发酵处理均可以提高燕麦中的β-葡聚糖含量,挤压膨化可以通过高温、高压破坏细胞壁组织,而发酵过程中细胞壁基质被微生物代谢产生的酶所降解[7],分解、破坏燕麦细胞壁组织,从而使可溶性释放组织内的β-葡聚糖,而且微生物在发酵过程中产生多糖,从而提高燕麦β-葡聚糖含量。挤压膨化处理后,燕麦细胞壁组织被大量破坏,更容易微生物进入细胞内发酵,因此挤压膨化耦合发酵后燕麦中β-葡聚糖含量比对照显著(P<0.05)提高了30.86%,比单纯挤压处理提高了11.83%,比单纯微生物发酵提高了15.67%。
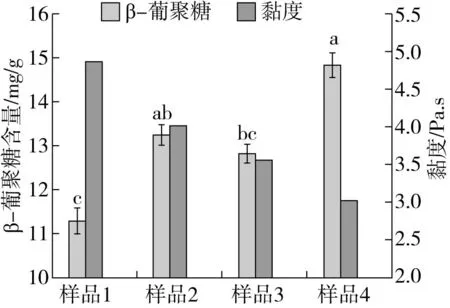
图2 几种处理对β-葡聚糖含量、表观黏度的影响
各种处理对燕麦粉的流变性也有所影响,其中挤压膨化耦合发酵的复合处理的表观表观黏度值最低,比对照显著(P<0.05)降低37.86%,比单纯挤压处理降低了24.68%,比单纯微生物发酵降低了15.16%。可能是与β-葡聚糖分子量有关,流变学行为可能与挤压过程中淀粉聚合物的降解有关,从而导致动态模量发生改变[9]。经过挤压膨化的高温高压,再耦合微生物的分解作用,降低了淀粉的聚合度和β-葡聚糖分子量,从而导致复合处理后的燕麦粉的表观表观黏度的下降,说明了β-葡聚糖分子质量的大小与其溶液的表观黏度呈正相关关系,这与龚玉圆等[27]研究一致。
2.3 几种处理对燕麦中β-葡聚糖的生物可给率的影响
由图3可见,挤压过程包含高温、高压和剪切力的作用,在这些作用条件下,燕麦制品中 β-葡聚糖裂解断裂,造成 β-葡聚糖裂解分子质量减小[22],燕麦粉物料物性发生了变化,由粉状变成糊状,淀粉发生糊化、裂解[28],有利于微生物的利用,燕麦部分组织经发酵过程中微生物的有效降解,从而提高了燕麦营养物质的生物利用率。复合处理后燕麦β-葡聚糖生物可给率比对照显著(P<0.05)提高36.38%,比单纯挤压处理提高了12.15%,比单纯微生物发酵提高了15.94%,提高了燕麦的营养价值。
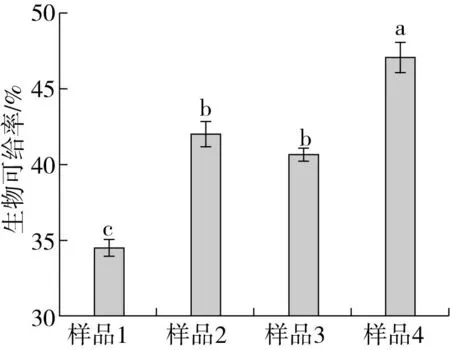
图3 几种处理对β-葡聚糖生物可给率的影响
2.4 几种处理对燕麦淀粉消化性的影响
根据淀粉的消化率,可分为快速消化淀粉(RDS)、慢速消化淀粉(SDS)以及抗性淀粉(RS),其中SDS和RS是低升糖食品,具有缓慢吸收,持续释放能量,维持血糖稳态,预防和治疗各种疾病的作用[29]。图4表明,挤压膨化、微生物发酵对三类淀粉均有所影响,挤压膨化耦合发酵处理是物理处理结合生物处理,处理后的效果明显(P<0.05)好于单纯物理或生物处理,复合处理后燕麦的RDS比对照、单纯挤压处理和单纯微生物发酵分别提高了13.58%、10.82%和12.73%; SDS比对照、单纯挤压处理和单纯微生物发酵分别提高了22.42%、6.56%和10.87%;RS比对照、单纯挤压处理和单纯微生物发酵分别降低了24.23%、17.16%和19.18%,且RS降低幅度大大高于RDS升高幅度,也高于SDS的升高幅度,说明复合处理挤压处理使得燕麦种皮更加破碎,对淀粉颗粒内部的氢键破坏程度较大,糊粉层细胞破裂[22],大幅降低了RS含量,使淀粉更易被酶水解,消化速率加快[30]。

图4 几种处理对淀粉消化性的影响
2.5 几种处理对燕麦中直链淀粉与支链淀粉比例的影响
直链淀粉和支链淀粉的比例及其结构组成对淀粉消化性也有一定的影响。一般来说,直链淀粉含量越高,淀粉的消化性越好[31]。图5显示,复合处理燕麦中直链淀粉含量比对照显著(P<0.05)降低了21.11%,比单纯挤压处理降低了11.07%,比单纯微生物发酵降低了15.58%;支链淀粉含量比对照显著(P<0.05)降低了34.17%,比单纯挤压处理降低了14.89%,比单纯微生物发酵降低了23.37%,支链淀粉:直链淀粉比对照显著(P<0.05)降低了16.67%,比单纯挤压处理降低了5.17%,比单纯微生物发酵降低9.84%,说明通过挤压膨化耦合发酵处理,燕麦中支链淀粉的含量大大降低,淀粉的消化性得到较大提升。

图5 几种处理对直链淀粉、支链淀粉的影响
2.6 几种处理对燕麦中多酚含量、黄酮含量的影响
燕麦含有丰富的抗氧化物质,其中绝大部分为酚类物质,如总酚和黄酮。多酚类化合物的结构中含有羟酚基,而酚羟基是良好的电子供体,具有很好的抗氧化性;同时,在参与抗氧化反应后,多酚会产生游离基,这些游离基中间体性质稳定,相互作用会产生新的仍具有抗氧化性的酚类物质,如此可不断循环下去[32]。全谷物中的多酚有游离态、可溶结合态和不溶结合态3种形式,结合态的多酚主要与细胞壁中的纤维素、果胶和多糖等组分以酯键结合[33],实验结果显示(图6),挤压膨化处理与发酵处理均可以提高燕麦中的多酚及黄酮含量,可能是由于热处理和微生物的生长繁殖能将结合态的多酚被降解为游离态多酚,从而提高了多酚含量。其中以挤压膨化耦合发酵处理有双重作用叠加,效果最佳,比对照分别显著(P<0.05)提高了28.98%和37.83%,比单纯挤压处理分别提高了17.88%、17.69%,比单纯微生物发酵分别提高了17.69%、8.50%。

图6 几种处理对多酚含量、黄酮含量的影响
2.7 几种处理对燕麦体外抗氧化性能的影响
由图7可见,实验采用的几种处理均可以一定程度提高燕麦的体外抗氧化能力,其中挤压膨化耦合发酵的复合处理DPPH自由基和ABTS自由基的IC50值均最低, DPPH自由基和ABTS自由基的IC50值分别比对照显著(P<0.05)降低38.68%、31.67%,比单纯挤压处理降低了19.06%、11.95%,比单纯微生物发酵降低了23.21%、17.07%。说明这种复合处理可以更好地释放燕麦中的抗氧化物,从而提高燕麦的抗氧化能力。
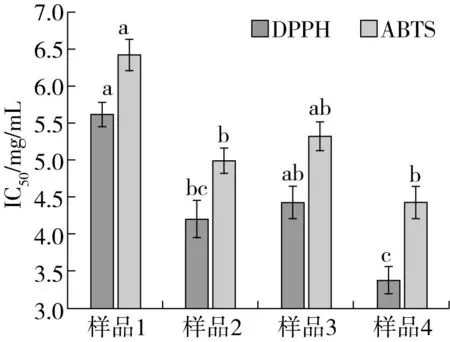
图7 几种处理对抗氧化性能的影响
3 结论
通过挤压膨化耦合发酵的处理,燕麦中淀粉总量没有明显变化,蛋白质由于被分解成氨基酸而降低,β-葡聚糖含量和生物利用率均有显著提升(P<0.05),表观表观黏度降低,显著增强(P<0.05)了淀粉的消化性,显著提高(P<0.05)了燕麦中的多酚及黄酮的含量,有效提升了燕麦的抗氧化能力。
