心脏植入式电子设备感染风险预测模型的系统评价
2024-05-07张晓欣张向毅崔盈佳裴志怡林佳艺岳雯静王子涵康晓凤祝捷
张晓欣 张向毅 崔盈佳 裴志怡 林佳艺 岳雯静 王子涵 康晓凤 祝捷
目的:系统评价心脏植入式电子设备(CIED)植入术后设备感染(DRI)的风险预测模型。
方法:通过计算机检索PubMed、Embase、Web of Science、Cochrane 图书馆、CINAHL、中国生物医学文献数据库、中国知网、维普网、万方数据库中与CIED 植入术后DRI 风险预测模型相关的文献,检索时间为从建库至2023 年12月2 日。由2 名研究者独立筛选文献、提取资料并完成纳入文献的偏倚风险与适用性评价。
结果:共纳入16 项研究,模型总体适用性较好,但偏倚风险较高,ROC 曲线的AUC 为0.67~0.96。11 项研究完成了内部验证,5 项研究进行了外部验证。囊袋和(或)电极重置/装置升级、肾功能不全或肾功能衰竭、年龄、植入埋藏式心脏复律除颤器或心脏再同步化治疗、使用抗凝药是DRI 的预测因子。
结论:目前CIED 植入术后DRI 风险预测模型整体性能较好,适用性较好,但偏倚风险较高。需在数据来源、变量筛选、模型评价等方面提高研究质量,开展前瞻性队列研究,完善现有模型的外部验证,并积极研发适用于我国人群的预测模型。
心脏植入式电子设备(CIED)主要包括永久性起搏器(PPM)、埋藏式心脏复律除颤器(ICD)、心脏再同步化治疗起搏器(CRT-P)和心脏再同步化治疗除颤器(CRT-D)等[1],已经成为各类心律失常及严重心力衰竭的重要治疗手段之一,可有效改善患者预后并提高生存率。目前,全球每年至少有170 万心血管疾病患者植入CIED[2]。伴随CIED植入适应证的拓宽及植入数量的增加,CIED 植入术后设备感染(DRI)的发生率也随之增加,约为0.13%~19.90%[3-4]。若感染无法得到及时、有效地处理,扩散后将导致败血症或感染性心内膜炎,甚至威胁患者生命[5]。国内外已有多位学者基于人口学资料、实验室检测和影像学特征等数据开展了CIED植入术后DRI 危险因素的相关研究,并构建了风险预测模型[6],但现有模型的预测性能、偏倚风险与临床适用性有待进一步验证。本研究系统检索国内外CIED 的DRI 风险预测模型的相关研究并完成评价分析,以期为临床医护人员选择合适的风险预测模型提供参考。研究已于PROSPERO 平台完成注册,注册号为CRD42023486126。
1 资料与方法
1.1 文献检索策略
计算机检索PubMed、Embase、Web of Science、Cochrane 图书馆、CINAHL、中国生物医学文献数据库、中国知网、维普网、万方数据库中的CIED 的DRI 风险预测模型相关研究,采取主题词与自由词相结合的检索方式,英文检索词包括cardiac implantable electronic device、pacemaker、defibrillator、implantable cardioverter defibrillator、cardiac resynchronization therapy、device-related infection、pocket infection、pocket hematoma、risk score、risk assessment、predictive score、predictive model、nomogram 等;中文检索词包括心脏植入式电子设备、起搏器、植入式心律转复除颤器、心脏再同步化治疗、感染、设备感染、囊袋感染、囊袋血肿、风险预测、风险评分等,时限为建库至2023 年12 月2 日,并通过滚雪球法追溯被纳入文献的参考文献和相似文献。
1.2 文献纳入与排除标准
纳入标准:(1)研究对象≥18 岁,且确诊为CIED 感染的患者,诊断标准包括《2019 版欧洲心律协会CIED 感染诊断国际标准》[7]、《2018 版欧洲心律协会CIED 导线移除专家共识声明》[8]、《心律植入装置感染与处理的中国专家共识2013》[9]中CIED 感染诊断标准;(2)研究内容为基于人群开展CIED 的DRI 风险预测模型的开发、更新和(或)验证;(3)研究类型包括队列研究、病例对照研究;(4)模型包含的预测变量≥2 个;(5)文献语种为中英文。
排除标准:(1)CIED 植入前患者已存在感染或合并其他慢性感染疾病;(2)研究仅为危险因素、影响因素的分析,未构建完整模型或未开展结局事件发生概率的评估;(3)研究为模型的本土化探索或预测性能的比较性研究;(4)重复发表或非正式发表文献;(5)学位论文、会议摘要及综述、述评。
1.3 文献筛选与数据提取
由2 名研究人员按照纳入和排除标准独立筛选文献、提取数据并完成交叉核对。根据Moons 等[10]制定的CHARMS 清单(critical appraisal and data extraction for systematic reviews of prediction modelling studies,CHARMS)绘制数据提取表格。提取内容包括第一作者、发表年份、国家或地区、研究设计、研究对象、构建模型与模型验证方法、样本量、ROC 曲线的AUC、模型呈现形式和最终预测因子等。
1.4 纳入文献的偏倚风险与适用性评估
由2 名研究者根据Wolff 等[11]编制的预测模型偏倚风险评估工具(prediction model risk of bias assessment tool,PROBAST)独立进行纳入文献的偏倚风险评估。评估共由20 个条目组成,涵盖研究对象、预测因子、结果和统计分析4 个领域,每个问题按照“是”、“可能是”、“不是”、“可能不是”、“未提供相关信息”来回答。其中,若任一领域所有问题的回答均为“是”或“可能是”则认为该领域偏倚风险低;若任一领域某一问题的回答为“不是”或“可能不是”,则认为该领域偏倚风险高;若未提供相关信息,则认为该领域偏倚风险不清楚;总体偏倚风险评价亦然。评价如遇分歧则与第3 位研究者共同讨论决定。
2 结果
2.1 文献筛选流程与结果
经初检与手工追溯,共获得相关文献4 973 篇,逐层筛选后,最终纳入符合标准的文献16 篇[12-27]。文献筛选流程及结果见图1。

图1 文献筛选流程图
2.2 纳入文献的基本特征(表1)
最终纳入16 篇文献,多为模型开发与验证研究。研究类型包括8 项回顾性队列研究[13-14,18,20-22,24-25]、6 项前瞻性队列研究[12,15,17,19,26-27]和2 项病例对照研究[16,23],其中多中心研究4 项[12,20-21,27]、单中心研究12 项[13-19,22-26]。美洲研究7 项[12-14,20-22,25],欧洲研究6 项[16-19,26-27],亚洲或其他地区研究2 项[23-24],全球多中心研究1 项[15]。研究对象多为CIED 植入患者或仅植入ICD、CRT 患者。
2.3 纳入模型的构建方法与预测效能
纳入研究的建模样本量为322~32 464 例,结果事件数为12~574 例,候选预测变量数为6~46 个,模型构建方法有Logistic 回归、Lasso 回归和Cox比例风险回归分析等。模型ROC 曲线的AUC 为0.67~0.96。除1 项研究[27]显示AUC 为0.67 及5 项研究[12,14,18,23,26]未报道外,其余10 项研究的AUC均>0.70,提示模型预测性能较好。变量选择方面,10 项研究[12-13,15-16,18-20,23,26-27]均开展单因素与多因素分析,仅6 项研究[15-16,19-20,23-24]报道了模型区分度,主要为校准图、Hosmer-Lemeshow 检验与决策曲线分析(DCA)等。模型验证方面,所有研究[12-27]进行了内部验证,5 项[12,14-15,20,27]研究还进行了外部验证。
2.4 纳入模型的预测因子
预测模型呈现形式不一,包含分层风险评分、列线图、机器学习模型与电子监测算法等。常见预测因子为囊袋和(或)电极重置或装置升级、肾功能不全或肾功能衰竭、年龄、ICD 或CRT、使用抗凝药、糖尿病、既往CIED 感染、既往手术次数等,模型基本情况报告见表2。
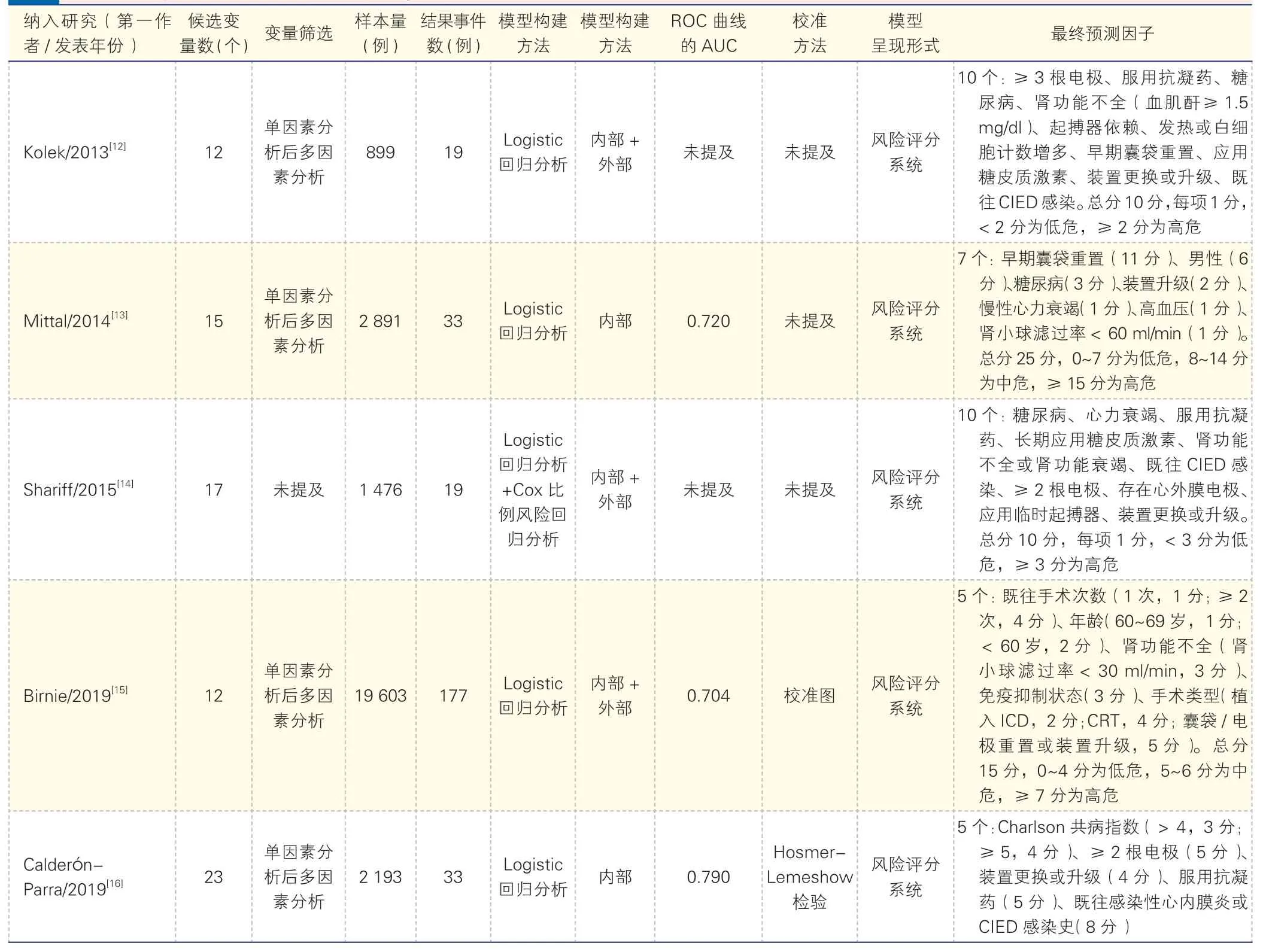
表2 CIED 患者DRI 风险预测模型的基本特征
2.5 偏倚风险与适用性评价(表3)
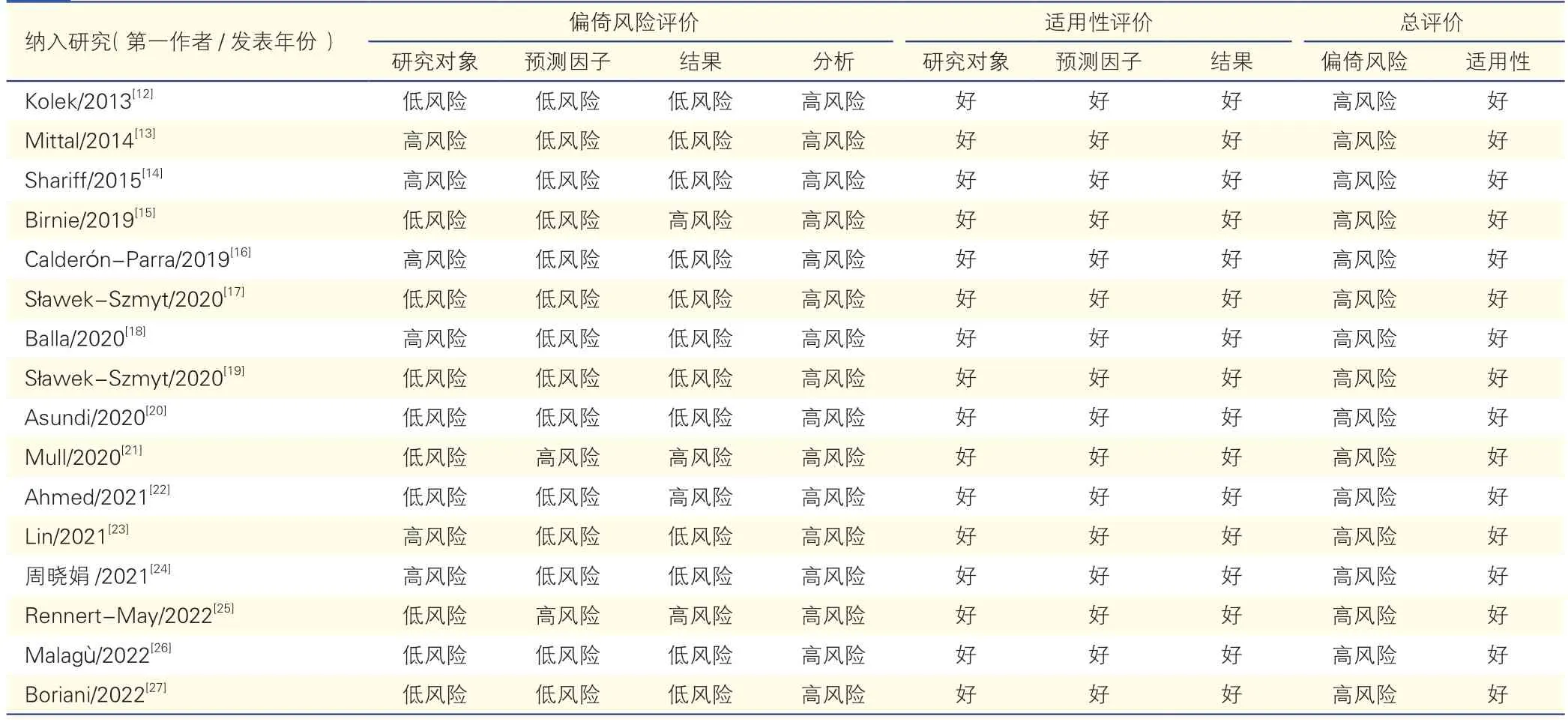
表3 模型的偏倚风险及适用性评价结果
纳入研究的模型整体均存在高偏倚风险。研究对象评价中,有6 项研究[13-14,16,18,23-34]存在高偏倚风险,主要与其数据来源不合适、研究对象的代表性不充分有关。如Mittal 等[13]和Sławek-Szmyt 等[19]的研究均为回顾性研究,且两者数据分别来自美国纽约某医疗中心和波兰某医科大学附属医院,均不是PROBAST推荐的前瞻性队列研究、随机对照试验、注册数据库等低偏倚数据来源。在预测因子评价中,2 项研究[21,25]为高风险偏倚,可能与其研究设计仅为回顾性研究、没有按照统一标准评估有关。在结果评价中,1 项研究[15]的研究对象结局定义和测量方法可能不同;3 项研究[14,21,25]变量的筛选仅基于单因素分析或未报告;2 项研究[16,23]仅使用Hosmer-Lemeshow 拟合优度检验校准度,4 项研究[12,14,18,26]未报告预测模型的区分度或校准度的信息。在分析评价中,纳入研究均存在高偏倚风险,主要表现为模型构建样本量不饱和、未考虑模型的拟合不足与过度拟合、候选变量的处理方法较为局限等问题,如4 项研究[12,14,17,26]的应变量事件数<20 例可能会造成模型的过度拟合。适用性评价方面,所有纳入的模型在各领域和总体的适用性均较好。
3 讨论
预测模型是以疾病预测因子为基础,按照数学模型计算结局事件发生概率的方式[28]。现阶段CIED 植入术后DRI 风险预测模型多采用Logistic 回归分析或Cox 比例风险回归方法开展研究,模型构建便利的同时也存在难以规避的变量之间的相关性问题。模型的预测效果常用AUC 表示,数值越接近l,表示模型的预测效果越好。本研究中,有10 个模型的AUC>0.7,说明此类模型可有效预测DRI。开展内部验证可用于检验模型的可重复性,防止过度拟合的发生,外部验证多关注模型的可移植性及可泛化性[29]。本研究中,所有模型建立后均完成了内部验证,研究设计较为完整和严谨,但仍有11 项模型未进行外部验证,其模型外推应用性有待考量。
尽管CIED 植入术后DRI 的危险因素较多,但本研究发现各模型的预测因子存在一定共性。囊袋和(或)电极重置/装置升级、肾功能不全或肾功能衰竭、年龄、植入ICD 或CRT、使用抗凝药、糖尿病、既往CIED 感染等是DRI 风险预测模型中较为常见的预测因子,高龄、男性与肿瘤患者是DRI 发生的高危人群,可能由于此类患者年龄相对较大,身体功能及抵抗力下降明显,导致感染风险增加。另外值得关注的是,受研究者主观因素的影响,模型前期的资料收集或分析阶段极易出现偏倚。因此,在选择预测因子时,研究者应充分考虑临床重要性、模型可用性以及收集的可行性和成本负担。研究设计时应注意实施盲法,使得出的模型结果更真实可靠。同时,基于单变量关联的预测因子(如P<0.1)开发预测模型,容易导致重要变量的遗漏,研究者更应采用多变量分析构建模型,并严格遵循个体预后或诊断多变量预测模型透明报告(TRIPOD)[30]来开展风险预测模型的研发、更新与验证研究,提升模型在临床实践中的适用性和安全性。
CIED 植入术后DRI 风险预测模型可实现危险因素的早期筛查,为高风险患者提供针对性预防措施的有效工具。早在2013 年,国外学者便开始探索DRI 风险预测模型[12],当下已聚焦于大型队列与电子病历数据库开发的多变量风险预测模型研究。与国外相比,我国仅有2 个模型完成开发[23-24],均发表于2021 年及以后,且多为单中心研究,缺乏外部验证。可能与我国DRI 风险预测模型的研究起步较晚,医护人员对DRI 的认知不足有关。因此,应注重提升医护人员的DRI 风险认知水平,并借助数据挖掘技术探索DRI 的预测因素,不断提高模型的精确性。而从实用性角度出发,构建模型的预测因子应选取绝大多数医疗机构容易获得的人口学资料和实验、影像学变量等,并在实际临床工作中,结合DRI 的高危人群特点,持续优化并及时校准风险预测模型。同时,模型的应用价值既取决于其预测效能,也取决于其外推性,从模型研究人群、研究设计与模型验证领域分析发现,多数风险预测模型报告了可观的AUC 和校准度,在内部验证时均表现出较好的预测效能,提示其具有良好的应用潜能,但多数模型外部验证开展较少,未在植入CIED 患者中进行普遍验证,相关模型的可迁移性与临床适用性有待进一步探讨,且多数模型是基于欧美人群开发,基于我国人群构建的2 个模型也均未在外部人群中进行效果验证,其模型的预测效能尚未可知,提示相关研究者当前预测模型的构建研究对临床应用的支撑度不足,仍需进一步完善模型的迭代更新与开发验证。
本研究所纳入的16 项模型整体预测性能较好,有助于医护人员早期识别CIED 患者中DRI 高风险患者。未来相关研究者应更加侧重在全国范围内开展多中心、大样本、前瞻性研究,积极寻找阻碍模型应用的因素,进一步提升预测模型的临床转化效率,探索出适合我国植入CIED 患者的DRI 风险预测模型。
利益冲突:所有作者均声明不存在利益冲突
