脊髓电刺激治疗带状疱疹后神经痛患者血清β-EP、NT水平变化及对治疗反应性的评估价值
2024-05-07程瑾霞程伟宁谭登云
程瑾霞, 张 锐, 程伟宁, 黄 荣, 谭登云
(武汉市新洲区人民医院神经内科, 武汉 431400)
带状疱疹后神经痛(Postherpetic neuralgia,PHN)是带状疱疹最常见并发症,主要由带状疱疹病毒感染神经节致神经节炎症反应及损伤引起[1]。目前脊髓电刺激(Spinal cord stimulation,SCS)是临床治疗PHN的新兴手段,通过在脊髓硬膜外间隙植入刺激电极释放微弱的电流刺激,可促使人体释放内啡肽等内源性镇痛物质,阻断疼痛信号的传导,继而达到镇痛的目的[2]。但SCS的程控及管理对患者的自护能力要求较高,《脊髓电刺激治疗慢性疼痛专家共识》[3]指出,部分患者试用短期SCS治疗后,即使未植入SCS也可获得较长时间的疼痛缓解,并由此开启了SCS短时程刺激治疗模式。β-内啡肽(β-endorplhin,β-EP)、神经降压素(Neurotensin,NT)均是体内重要的内源性镇痛物质,血清β-EP、NT水平变化与疼痛感知和调控密切相关,NT能通过调控β-EP水平而改变身体的疼痛阈值[4],且带状疱疹患者治疗前后血清β-EP、NT水平有明显变化[5]。基于此,本研究探讨SCS治疗带状疱疹后神经痛患者血清β-EP、NT水平变化及对治疗反应性的评估价值,现报道如下。
1 资料与方法
1.1 研究对象选取2021年7月-2023年3月武汉市新洲区人民医院神经内科收治的PHN患者108例作为研究组,根据随机病例对照研究原则1∶1选取同期常规药物治疗的PHN患者108例作为对照组。患者纳入标准:年龄≥18周岁;根据《皮肤性病学(第9版)》[6]诊断确诊带状疱疹,初期表现病损区灼痛/刺痛;皮损呈神经走向分布,累及邻近皮神经支配区;豆状水疱,分布密集,面积不一,可见脓血疱,渗液;根据《带状疱疹后神经痛诊疗中国专家共识》[7]诊断PHN,明确带状疱疹病史且皮损愈合后疼痛持续1个月以上;经规范止痛药物治疗疼痛未缓解,疼痛程度数字评估量表(Numerical rating scale,NRS)评分≥4分;患者知情本研究内容,签署同意书。排除标准:其他原因所致疼痛;皮损区有神经毁损手术史;接受其他方式治疗者;精神及认知异常者;原发性侧索硬化症等神经肌肉性疾病者。研究组男性64例,女性44例,年龄36~74岁,平均(54.53±7.83)岁;体重指数18.31~29.31 kg/m2,平均(24.67±2.31) kg/m2。对照组男性60例,女性48例,年龄34~74岁,平均(53.97±7.31)岁;体重指数18.26~29.58 kg/m2,平均(23.99±2.82) kg/m2。两组性别、年龄、体质指数基线资料均衡可比(P>0.05)。本研究已获得武汉市新洲区人民医院伦理委员会批准(XZYYLL2024016)。
1.2 方法
1.2.1 检测方法 研究组、对照组治疗前、治疗后14 d,均采用非抗凝真空管采集晨空腹肘静脉血4 mL,离心15 min(半径8 cm,转速3 500 r/min),取上层血清。采用上海研启生物科技有限公司酶联免疫分析试剂盒检测血清β-EP、NT水平,操作均按照试剂盒说明书步骤完成。
1.2.2 治疗方法 对照组给予普瑞巴林、甲钴胺常规治疗,研究组在对照组基础上加用SCS治疗:取俯卧位,消毒,铺巾,常规局麻,穿刺针穿刺至硬膜外,X线辅助下将美国美敦力公司 977A290型8触点经皮穿刺体验电极置于后硬膜外侧后间隙,确保第3~5触点分布在痛感最强烈的区域。术中借助外部刺激器进行测试,初始参数:脉宽180~550 μs,频率40~60 Hz,强度0.5~5.0 mA,以患者对应神经节段所支配区域呈麻舒感,且覆盖全部疼痛部位为宜。退针,固定电缆线,对患者进行14 d的测试性刺激治疗。操作均由相同资深医师规范完成。对照组常规进行抗病毒治疗。
1.2.3 治疗反应性评估及标准[8]治疗完成后6个月根据NRS评分评估治疗反应性,NRS评分下降幅度≥51%为反应良好,归入反应良好患者,否则为反应差,归入反应差患者。
1.3 观察指标(1)研究组、对照组血清β-EP、NT水平,(2)反应差患者与反应良好患者的临床资料,(3)影响PHN治疗反应差的危险因素,(4)PHN治疗反应差的敏感度和特异度。
2 结果
2.1 两组患者血清β-EP、NT水平比较治疗前,两组血清β-EP、NT水平比较,差异无统计学意义(P>0.05);治疗后,两组血清β-EP、NT水平较治疗前均升高,且研究组高于对照组(P<0.05)。见表1。
表1 两组血清β-EP、NT水平比较
2.2 反应差患者与反应良好患者的临床资料比较反应良好患者76例,反应差患者32例。与反应良好患者比较,反应差患者吸烟、皮疹面积≥10%、初治时间>3 d、急性期疼痛程度比率较高,治疗后血清β-EP、 NT水平较低(P<0.05)。见表2。
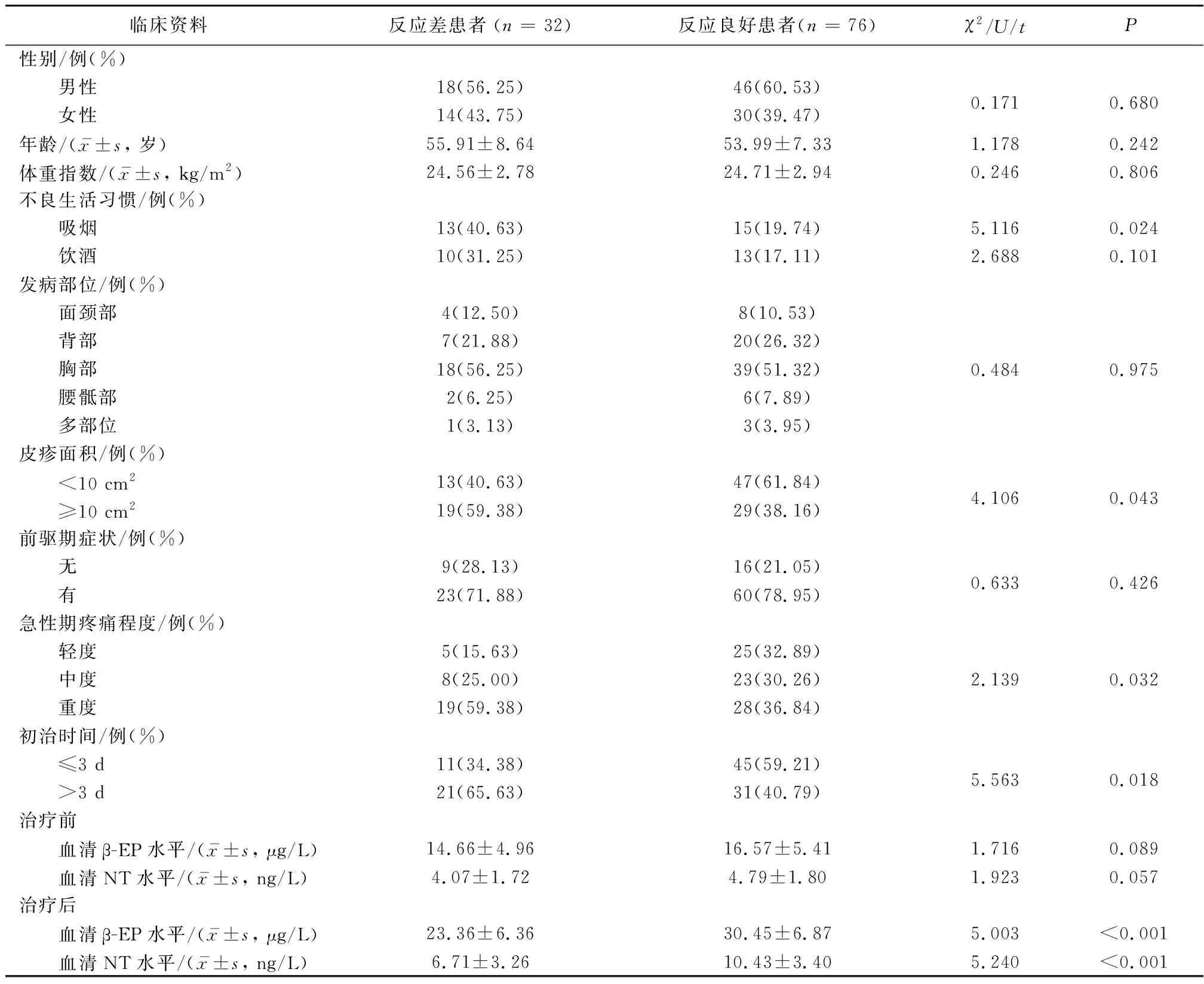
表2 反应差患者与反应良好患者的临床资料比较
2.3 多因素Logistic回归模型分析PHN治疗反应差的危险因素将SCS治疗PHN反应性(反应良好=0,反应差=1)作为因变量,2.2中P<0.05的项目作为自变量,多因素Logistic回归模型分析,结果显示,皮疹面积≥10 cm2、初治时间>3 d是PHN治疗反应差的独立危险因素,血清β-EP、NT水平升高是PHN治疗反应差的独立保护因素(P<0.05)。见表3。

表3 影响PHN治疗反应差的多因素Logistic回归分析结果
2.4ROC曲线评价多因素Logistic回归模型对PHN治疗反应差的预测价值根据表3建立多因素Logistic回归方程,logit(P)=4.208+2.002×皮疹面积+1.573×初治时间-0.301×血清β-EP水平-0.508×血清NT水平。经Hosmer-Lemeshow拟合优度检验显示,χ2=2.431,P=0.954,拟合度较好。ROC分析显示,血清β-EP、NT水平单独预测PHN治疗反应差的曲线下面积(Area under curve,AUC)值分别为0.776、 0.793, 加入多因素Logistic回归模型后可将AUC值提升至0.936,高于血清β-EP(Z=3.490,P=0.001)、NT(Z=3.430,P=0.001)单独预测,95%CI为0.872~0.974,敏感度为96.87%,特异度为77.63%。见图1。

图1 logit(P)预测PHN治疗反应差的ROC曲线图
3 讨论
目前PHN确切发病机制尚未完全阐明,较一致观点认为可能与神经传导异常、皮损区域周围神经炎所致自发疼痛及痛觉超敏有关[9-10]。SCS作为临床治疗PHN的新兴手段,尽管效果显著,但刺激电极及配套装置不仅价格昂贵,且需要维护,限制了其在临床的推广应用。而SCS短时程刺激部分患者带来了曙光,但缺乏远期效果的预测手段。
内源性阿片肽水平变化不仅与神经状态有关,还与镇痛关系密切[11]。β-EP作为主要的内源性阿片肽家族成员,可与阿片受体结合产生强烈的镇痛效应。国内外多项研究显示,血清β-EP水平与疼痛程度呈负相关,PHN患者治疗后血清β-EP水平显著升高,疼痛程度得到有效减轻[12-13]。本研究发现,带状疱疹患者血清β-EP水平普遍降低,且PHN患者降低更显著,与上述研究相符。分析PHN患者血清β-EP水平变化的机制可能是β-EP主要由垂体前叶细胞分泌,并经门脉系统进入体循环,生理状态下,β-EP的释放具有生理节律。多项研究已证实,下丘脑-垂体-肾上腺轴与应激是一个直接作用及反馈互动的复杂集合,情绪、睡眠质量与垂体前叶细胞的分泌功能关系密切[14-15],而烧灼样的疼痛是带状疱疹主要症状之一,疼痛不仅会直接影响患者的睡眠质量,且还会造成患者食欲不振、抑郁等,将会影响垂体前叶细胞的分泌功能,造成β-EP的生成及分泌减少[16]。上述研究说明,血清β-EP水平降低可能与带状疱疹发生及转归有关。但血清β-EP水平降低与带状疱疹转归间的确切关系尚缺乏广泛研究。本研究发现,经SCS治疗后PHN患者血清β-EP水平升高,但治疗反应差患者治疗后血清β-EP水平低于治疗反应良好患者,提示治疗后血清β-EP水平或可为临床评估SCS短时程刺激的远期镇痛效果提供依据。有研究提出,糖尿病病史是PHN预后的危险因素[17-18]。本研究发现,吸烟、皮疹面积等与PHN治疗反应差有关,与上述研究存在一定差异,当控制皮疹面积、初治时间等混杂因素为固定变量时,血清β-EP水平降低,PHN治疗反应差的风险增加。分析原因主要是SCS主要通过电极释放微弱的电流刺激,促使人体内自身内源性镇痛物质如β-EP等的释放,从而达到控制疼痛的目的,但受情绪、身体状态等多种因素影响,垂体前叶细胞分泌β-EP存在个体差异,若SCS治疗后β-EP分泌仍处于较低水平则可能无法有效发挥镇痛作用[19-20],致使SCS的治疗反应性差,这可能也是医生往往会在PHN患者在治疗过程嘱咐要保持心情愉悦、保证睡眠的原因。上述研究提示,治疗后血清β-EP水平较低是PHN治疗反应差的独立危险因素。
NT是一种肠脑肽激素,能系统参与多种与神经精神和代谢相关的生理和病理过程。李玉秋等[21]研究指出,带状疱疹患者及PHN患者血清NT水平明显低于健康群体,NT不足是带状疱疹急性期患者发生神经痛的危险因素。本研究也发现,带状疱疹患者及PHN患者血清NT水平普遍较低,与上述研究一致,说明NT可能同样参与PHN的发生过程。进一步分析发现,PHN治疗反应差的患者治疗后血清NT水平较低,且多因素Logistic回归模型分析显示,血清NT水平升高是PHN治疗反应差的独立保护因素。分析主要是因NT作为一种能影响记忆的情感存储的物质,其主要作用是进入杏仁体后将记忆分为积极记忆或消极记忆,丘脑室旁核投射到杏仁核的神经降压素神经元能通过放大积极和消极信息的编码指导价值分配,当NT水平较高时可使个体保持积极、乐观的态度,并促进个体主动行为策略的选择[22]。个体情绪与人体激素间关系密切[23],NT可使个体保持轻松愉悦的状态,同时个体积极或消极情绪的变化也会影响NT的生成,如PHN患者受疼痛影响,普遍存在消极情绪,这一情绪可能会抑制NT的分泌[24]。本研究也发现,PHN患者普遍存在焦虑、抑郁情绪。而SCS通过刺激β-EP等镇痛物质的释放,可使PHN患者疼痛程度得到有效缓解,随疼痛程度缓解,患者心情趋向愉悦,NT分泌增加,形成正向循环[25]。上述研究提示,血清β-EP、NT水平变化与PHN治疗反应差关系密切。继续ROC分析发现,血清β-EP、NT水平单独预测PHN治疗反应差的AUC值均达0.75以上,具有预测效能,将二者加入多因素Logistic回归模型可将整体预测效能提升至0.936,预测效能较高,提示治疗后血清β-EP、NT水平对疗效具有较高预测能力。但本研究不足在于初步对该项内容进行探讨,样本来源单一,所得结论可能存在一定偏倚,后期仍需进行更深入探讨。
综上可知,PHN患者血清β-EP、NT水平在经SCS治疗前后存在差异,治疗后血清β-EP、NT水平与SCS疗效有关,联合检测可为临床评估SCS疗效提供参考,尤其是皮疹面积≥10%,初治时间>3 d、睡眠质量差及存在焦虑情绪的患者,临床需加强干预。
