ODC1基因对前列腺癌细胞PC-3 LncRNA表达影响的初步观察与分析
2024-05-07宋尖卓
宋尖卓, 马 健, 陈 鹏
(新疆医科大学附属肿瘤医院泌尿科, 乌鲁木齐 830011)
转录因子鸟氨酸脱羧酶1(ODC1)是多胺生物合成中的限速酶,通过将鸟氨酸脱羧转化为腐胺,有助于生产多胺(包括腐胺、亚精胺、精胺等)[1]。多胺是活细胞的关键组成部分,在细胞增殖和凋亡、衰老和生殖的调节中发挥多种作用[2]。ODC1在多种肿瘤的增生性组织中表达上调,在转录因子MYC基因扩增的肿瘤中发生失调,例如神经母细胞瘤、胃癌、前列腺癌和结直肠癌[3-5]。已有研究表明,ODC1基因在前列腺癌中高表达,并与临床前列腺特异性抗原(PSA)表达水平相关,癌腺体周围良性上皮中ODC1的表达水平随着PSA的增加呈对数降低,ODC1抑制剂可选择性阻断睾酮对前列腺肿瘤发展的促进作用[6-8]。对ODC1影响调控前列腺癌的机制仍需进一步探索,本实验拟通过高通量测序等方法和生物信息数据分析,从其对中长链非编码RNA(lncRNA)表达影响的角度进行初步观察和探索,以期为进一步研究其作用及调控机制提供一些实验基础和线索。
1 材料与方法
1.1 材料与试剂人前列腺癌细胞(PC-3)(普诺赛公司)。试剂包括:Ham′s F-12K(Procell公司)、0.25%胰酶(Gibco公司)、lipofectamine max(Invitrogen公司)、DMSO(MP公司)、质粒小提试剂盒(Omega公司)、胎牛血清(Gibco公司)等。
1.2 方法
1.2.1 构建细胞模型 实验组采用三种敲低序列降低实验误差,分别采用siRNA ODC1-homo-1006(编号si-1)5′-GGUUGGUUUCAGCAUGUAUTT-3′(正义链)、5′-ACGUGACACGUUCGGAGAATT-3′(反义链), ODC1-homo-1156(编号si-2)5′-GCCCGGCAGAUACUAUGUUTT-3′(正义链)、5′- AACAUAGUAUCUGCCGGGCTT -3′(反义链),ODC1-homo-1440(编号si-3)5′-GCUGUGACCUGCCUG-AAAUTT-3′(正义链)、5′-AUUUCAGGCAGGUCACAGCTT-3′(反义链)进行细胞转染,得到基因敲低组Si-1、Si-2 和Si-3。对照组NC采用siRNA siNC 5′-UUCUCCGAACGUGUCACGUTT-3′(正义链)、5′-ACGUGACACGUUCGGAGAATT-3′(反义链)进行细胞转染。实验组和对照组细胞样品转染siRNA用量为160 pmol/孔(12孔板)、Lipo 4 μL/孔、无血清培养基(μL/孔)50×2。转染具体如下:(1)取160 pmol转染量siRNA,加入50×2 μL稀释体积的无血清培养基,孵育5 min;(2)同时取4 μL LipofectamineTMmax Transfection Reagent,加入无血清培养基,孵育5 min;(3)将步骤(1)加入到步骤(2)中,孵育20 min;(4)将上述混合物均匀加入细胞培养液中,置于5% CO2,37℃培养箱培养6 h,随后更换对应的新鲜完全培养基,置于5% CO2,37℃培养箱继续培养至48 h,收集样品。NC组和Si组均生物学重复6次,对照组采用无关序列转染筛选出NC-1、NC-2、NC-3,实验组采用上述三种敲低序列转染筛选出Si 1-1、Si 1-2、Si 1-3,Si 2-1、Si 2-2、Si 2-3,Si 3-1、Si 3-2、Si 3-3。
1.2.2 验证细胞模型 Trizol法提取上述转染48 h的样品细胞RNA,利用引物Hum GAPDH 5′-GGTCGGAGTCAACGGATTTG-3′(正义链)、5′-GGAAGATGGTGATGGGATTTC-3′(反义链)和引物ODC1 5′-CCGAAGTAGAGGAACAGGAT-3′(正义链)、5′-TTAATACTAGCCGAAGCACAG-3′(反义链),进行qRT-PCR检测分析不同样本之间的相对表达量,检测ODC1基因在mRNA水平上的表达量。WB检测ODC1蛋白在敲低ODC1基因的PC-3细胞模型中的表达情况。取1 μg检测合格的总RNA进行RNA-seq文库的制备。RNA-seq文库制备后使用Illumina Novaseq 6000(武汉瑞兴生物科技有限公司),采用PE150模式进行高通量测序。在获得原始序列之后,去掉测序中低质量的片段。使用FastQC(版本0.9.5)对fastq格式的质量过滤后片段进行质量检测。然后,用TopHat2软件把经过筛选的序列比对到人GRCH38基因组上面,容许不超过4个碱基错配。删除能够与多个基因组位置匹配的序列,仅保留具有唯一基因组位置的序列,进行后续分析。
1.2.3 统计处理与生信分析 采用SPSS18.0软件处理数据,计量资料两组间比较采用两独立样本t检验,各组之间差异采用单因素方差分析,实验组和对照组中lncRNA表达量变化采用Fisher检验,以P<0.05为差异有统计学意义。
采用目前应用最广泛的编码潜能分析方法(CPC分析、CNCI分析、CPAT分析、LGC分析)对候选lncRNA进行判定筛选,使用DESeq2软件对筛选基因进行差异表达分析,然后估计基因离散度,再拟合负二项分布模型,采用Wald或似然比假设检验。检验标准为表达变化的绝对比值fold change(FC≥2 or ≤1/2)和假设几率(P<0.05),筛选出表达显著上调基因和表达显著下调基因,作图分析软件采用Cluster3.0。对所有差异表达的lncRNA和所有差异表达的基因进行共表达分析,同时计算差异表达的lncRNA表达基因之间的皮尔森相关系数,筛选满足相关系数绝对值>0.6且P<0.01的关系对。得到差异基因后,分析lncRNA顺式作用靶标,再对靶标进行GO分类富集性分析和KEGG分析解析其功能。首先综合GO和KEGG数据库资源向各个通路映射,统计每个通路中的基因数,然后用超几何分布检验,以全基因组的GO和KEGG注释情况为背景,得到待分析基因显著富集的通路。最终展示排名前十的通路。
1.2.4 基因验证 qRT-PCR检测验证上述实验中各样本lncRNA的表达量改变。针对基因序列设计引物LINC00973-F 5′-GGCTTCATCAATAAGGTATTCC-3′、LINC00973-R 5′-GAATAATTGTCCTTGCCTCAGA-3′。TERC-F 5′-CTAGAATGAA-CGGTGGAAGGC-3′、TERC-R 5′-TAACTGAGA-AGGGCGTAGGC-3′。LINC00638-F 5′- GACCC-GTCCCTTTGAGGAT-3′、LINC00638-R 5′-AGCGA-GGATGGTGTCTGAG-3′。具体采用反转录试剂盒(R323-01,诺唯赞,中国),在thermocycle仪器(T100,Bio-Rad,USA)上进行cDNA合成,反转录条件为42℃,5 min,37℃,15 min,85℃,5 s。然后,在ABI QuantStudio 5仪器上进行q-PCR反应,设置的程序为95℃预变性10 min,95℃变性15 s,60℃退火延伸1 min,变性和延伸执行40个循环。每个样品进行3次技术重复。接下来计算每个转录本mRNA的相对表达量,使用GAPDH作为内参基因进行标准化,采用2- ΔΔCT方法进行分析[9]。
2 结果
2.1 细胞模型构建及ODC1基因敲低后lncRNAs差异分析
2.1.1 qRT-PCR结果 NC组mRNA表达量分别为1、0.793、1.03。实验组Si-1组mRNA表达量分别为0.112、0.113、0.123。实验组Si-2组mRNA表达量分别为0.079、0.106、0.124。实验组Si-3组mRNA表达量为0.112、0.112、0.13。各组取平均值后mRNA表达量分别为NC组0.941,Si-1组0.116,Si-2组0.103,Si-3组0.118。与NC组相比,Si组mRNA表达水平显著降低。WB结果显示,ODC1分子量为51 KDa,实际检测分子量为50 KDa,在70 KDa存在很亮的杂带;从WB图条带来看,NC组与Si组相比,NC组有条带,Si组无条带,敲低效率较高,见图1。从mRNA和蛋白水平提示PC3敲低ODC1成功。
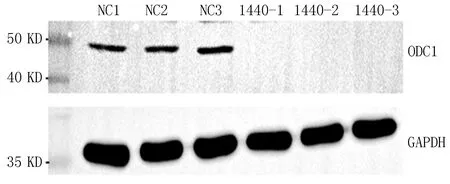
图1 ODC1在实验组和对照组中的表达
2.1.2 lncRNA预测 对RNA-seq数据进行分组,使用StringTie对各组数据进行组装并预测转录本,CPC、CNCI、CPAT、LGC这4种分析方法取交集后筛选的新预测lncRNA有341个,结果见图2。
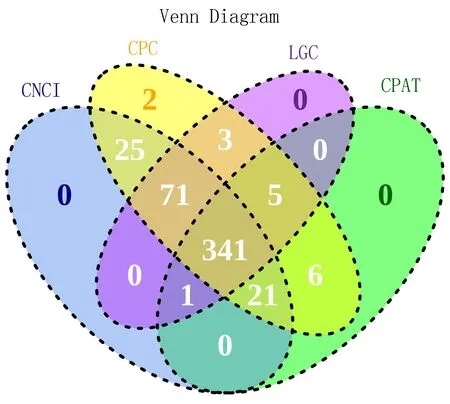
注: 蓝色部分表示采用编码潜能分析方法CNCI筛选出的lncRNA数量;黄色表示采用CPC分析方法筛选出的lncRNA数量;紫色表示采用LGC分析方法筛选出的lncRNA;绿色表示采用CPAT分析方法筛选出的lncRNA。圆圈重叠的部分表示2种及2种以上分析方法筛选出的共有的非编码RNA数量。
2.1.3 实验组与对照组细胞间lncRNA差异分析 采用标准DElncRNA比较不同样本,获得差异表达lncRNA。实验组显著上调表达lncRNA有154个,前10的有LINC00638、LINC00871、LINC02714、LINC00992、LINC01252、LINC00461、LINC01238、LINC01812、LINC01844、LINC00957等。下调表达的lncRNA有128个,前10的有TERC、LINC00973、LINC00592、LINC02454、LINC01444、LINC00997、LINC02085、LINC01089、LINC01285、LINC02029;差异lncRNA聚类分析揭示实验组与对照组对比鲜明,样本一致性好,见图3、4。

图3 lncRNA差异分析火山图
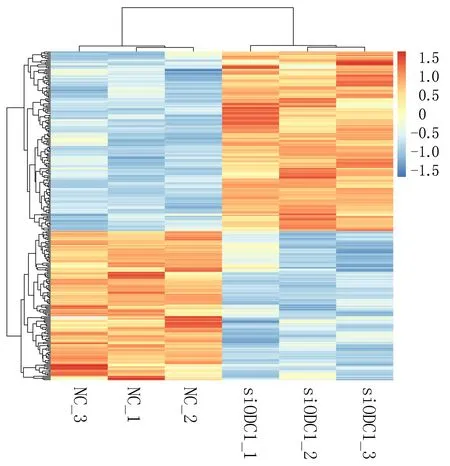
图4 差异表达lncRNA热图
2.1.4 lncRNA顺式调控靶标分析 在反式调控的关系对中将co-location的阈值设定为lncRNA上下游100 kb,后续通过对co-location的lncRNA和mRNA之间计算皮尔森相关系数进行共表达(co-expression)分析,筛选满足相关系数绝对值>0.6且P<0.01的lncRNA-target关系对,再对co-location和co-expression两个数据集取交集,得到lncRNA的顺式作用靶标。lncRNA与所有表达基因的共表达顺式调控靶标数目789个,差异lncRNA与所有表达基因的顺式调控靶标数目为142个,差异lncRNA与差异表达基因共表达的顺式调控靶标数目为38个,结果见表1。

表1 lncRNA的顺式作用靶标数目统计表
2.2 lncRNA靶标GO和KEGG Pathway富集分析通过基因功能富集分析、生物学过程富集分析和KEGG基因通路富集分析,lncRNA顺式调控靶标基因参与磷脂酰肌醇3激酶/蛋白激酶B信号通路(PI3K-Akt信号通路)、Ras等信号通路并与肿瘤血管生成、细胞群增殖和正调控细胞分裂等密切相关。如LINC00638、PRLR、NRAS、PDGFRB等参与PI3K-Akt信号通路及Ras信号通路;TERC、CDKN1A、CASP3、LINC00973等也与肿瘤信号通路相关。这些生物学功能表明lncRNA顺式靶标基因与肿瘤形成进展等联系密切,见图5~7。
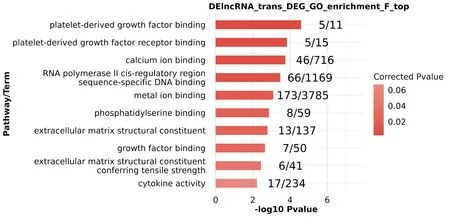
图5 lncRNA靶标GO功能(F)富集分析结果、基因功能及结合受体情况

图6 lncRNA靶标GO生物学过程(P)富集分析结果

图7 lncRNA靶标KEGG Pathway基因通路富集分析
2.3 验证GO和KEGG富集分析得到的功能lncRNA基因进行LncRNA顺式调控靶标GO和KEGG通路富集分析后,得到LncRNA LINC00973、TERC、LINC00638。
补充验证实验,结果显示,与对照组相比,实验组Si-1、Si-2、Si-3中LINC00973和TERC的表达量降低,差异有统计学意义(P<0.000 1);与对照组相比,实验组LINC00638表达量升高,差异有统计学意义,见表2。q-PCR结果显示,LINC00973、TERC表达显著下调、LINC00638表达显著上调,与GO和KEGG富集分析得到的lncRNA差异表达情况一致,见表3。

表2 实验组和对照组中LINC00973、TERC和LINC00638表达的比较
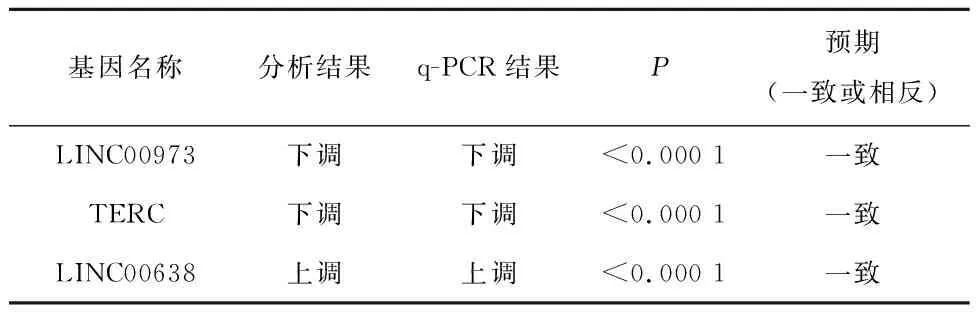
表3 q-PCR结果展示
3 讨论
ODC1基因在前列腺癌细胞中显著高表达,且与患者预后相关[6]。ODC1影响调控前列腺癌的机制可能与雄激素相关通路有关,但详细机制仍需进一步探索,本实验通过高通量测序方法探索ODC1基因对中长链非编码RNA(lncRNA)表达的影响,以期从这一角度为研究其影响调控前列腺癌的机制提供一些可能的依据。我们在体外实验PC-3细胞中敲低ODC1后,观察到众多lncRNAs基因随之差异表达,选择部分文献已有报道与肿瘤相关、特别是和前列腺癌相关的lncRNAs进行了验证,结果显示,与LncRNA顺式调控靶标GO和KEGG通路富集分析预期结果一致,提示从这一角度继续深入研究是可行的。
lncRNAs不同于编码蛋白基因,当受到干扰时,lncRNAs的错误调控会导致基因组应激[10],已有研究表明,lncRNAs与包括前列腺癌在内的多种人类恶性肿瘤的发生和发展有关[11-12]。
本实验中验证的lncRNA TERC、LINC00973、LINC00638,在既往的研究中发现具有促进肿瘤细胞增殖及侵袭的作用[13],本实验富集通路结果显示,这三个lncRNA与多个肿瘤信号通路相关。TERC基因在端粒酶依赖的端粒延伸和维持中起着重要作用[13],文献表明,TERC突变可以激活前列腺癌细胞LAPC4的端粒延长代替机制,并导致癌细胞继续长期增殖[14]。有研究报道,LINC00973在结肠癌、肾透明细胞癌及非小细胞肺癌中高表达[15-17],它通过结合糖酵解关键酶LDHA(乳酸脱氢酶A)并增强酶活性,进而加速肿瘤细胞的有氧糖酵解,最终促进肿瘤细胞增殖,敲低该RNA的表达,能够抑制多种肿瘤细胞的增殖[18],根据本研究结果可以推测,LINC00973的高表达也是通过加速了前列腺肿瘤细胞有氧糖酵解过程,以此促进前列腺癌的进展。还有研究显示,非小细胞肺癌中过表达LINC00638,通过调控IRS1/磷酸肌醇3-激酶(PI3K)/Akt信号通路促进肿瘤增殖、生长、迁移和侵袭,抑制非小细胞肺癌细胞的凋亡,miR-541-3p可能是LINC00638的潜在靶点[19],在肝细胞癌中,LINC00638参与LINC00638/miR-4732-3p/ULBP1轴,通过PD-L1促进肝细胞癌的免疫逃逸,导致肝细胞癌进展[20],在前列腺癌中LINC00638是否也是参与PI3K/Akt信号通路而促进肿瘤进展也需要实验进一步证明。
本实验只挑选了以上三个已知重要的lncRNA进行验证,可能对全面解释调控机制来说不够充分。另外,本实验是采用人前列腺癌PC-3细胞作为研究基础的,后续我们还将通过体内实验来验证ODC1高表达是否足以驱动前列腺癌进展。再者,lncRNA与其他物质结合形成的复合物是否参与调控后续生物学进程,还需要进一步通过诸如RNA pull-down、ChlRP、RIP、CHIP-s等技术对候选lncRNA的作用机制作进一步研究,这也是我们后续深入研究的方向。
本次的研究结果提示了ODC1基因通过调控致癌lncRNAs参与前列腺癌的发生或进展的新线索,及其作为治疗干预靶点的潜在意义,为进一步研究ODC1基因在前列腺癌中的作用及调控机制提供了一定的实验基础。
