突触后密度蛋白-95在三阴型乳腺癌外泌体中的表达情况及与临床病理特征的相关性
2024-05-07王玉洁孜拉兰玉山江李鸿涛
王玉洁, 李 婷, 孜拉兰·玉山江, 李鸿涛
(新疆医科大学附属肿瘤医院乳腺甲状腺外科, 乌鲁木齐 830011)
据2020年WHO报道,乳腺癌在全球恶性肿瘤中发病率最高,超过了肺癌,位居第一位。乳腺癌的新发患者人数约260万,中国约42万,而且逐年呈现上升趋势[1]。由于该疾病的致死率较高,严重威胁到女性患者的身心健康[2]。外泌体是一种细胞内囊泡,它形成于多囊泡体和细胞膜的融合过程,并通过此过程被释放出来[3]。外泌体是细胞内多泡体内形成腔内囊泡,转移到细胞外[4-5]。研究发现外泌体可基于和受体结合或被内化的方式,进入受体细胞,并对靶细胞产生影响[6]。因此,外泌体在向周围或远处细胞传递信号中发挥着重要作用。
Chen等[7]研究发现,突触后密度蛋白95(PSD-95,又称DLG4)在结直肠癌组织中低表达,这与结直肠癌的发生和转移密切相关。本研究旨在通过实验分析突触后密度蛋白95(PSD-95、DLG4)在三阴型乳腺癌患者中的表达情况及临床病理特征的相关性。
1 资料与方法
1.1 一般资料选取2017年1月至2018年1月在新疆医科大学附属肿瘤医院乳腺甲状腺肿瘤研究中心的4例三阴型乳腺癌患者及4例乳腺良性肿瘤患者的样本,通过生物信息学方法测定其相关基因表达情况,且进行对比[8],选择高通量测序方法进行检测[9],以获得两组样品的mRNA-seq数据。同时收集同期36例三阴型乳腺癌患者的术前穿刺或术中病理组织标本和30例乳腺良性肿瘤患者的组织标本,用于对候选mRNA表达水平的分析。本研究已通过新疆医科大学附属肿瘤医院伦理委员会批准(K-2021076),并通过了所有参加研究的患者及其家属的书面知情同意。
1.2 纳入与排除标准参照中国癌症学会《乳腺癌诊疗指南(修订版)》2020年度报告编制的入选和剔除标准。 纳入标准:(1)侵袭性无特异性乳癌的病理学确诊者;(2)经免疫组化检验;(3)首次就诊时未接受化学药物、放射和其他临床疗法者。排除标准:(1)临床病理资料不完整者;(2)失访患者。(3)不符合上述纳入标准的均予以剔除。
1.3 试剂和仪器包埋机(PBM-B)来源于常州普瑞斯星公司;微量移液器和离心机(TDZ5-WS)来源于湖南湘鑫仪器仪表有限公司;免疫组化染色试剂盒、DLG4抗体(#AF5283)购自Affinity抗体公司;外泌体提取试剂盒(76064)购自QIAGEN公司。
1.4 转录组测序和外泌体的分离纯化将样品迅速溶解后加1倍剂量的 XBP,反转混合后向 exoEasy离心机中添加混合液进行3 min的旋转离心,再静置5 min;然后将10 mL的缓冲剂 XWP添加到2 810×g的离心器中7 min,将剩余的缓冲剂去除。将转动的色谱塔移至新的收集管内,在薄膜上添加600 μL的缓冲剂 XE,培养3 min。在500×g的条件下,5 min后,萃取洗脱剂,再回柱,再加入外部易旋柱,温育3 min;对分离出的外泌体测序,据此确定出相应mRNA-seq,然后筛选出品质较好的外泌体。以已知的GRCh38为参照物完成测序。使用HISAT2软件进行比较,使用 StringTie软件将比较得到的读数进行组合,以此为基础建立多变量的剪切图和交通网络;按照最大通信量的计算方法,将读数组合起来,并对它们的表达量进行估计。
1.5 差异表达的mRNA鉴定利用Limma分析技术,以|log FC|>1,Pvalue<0.05为筛选条件,对获得的外泌体进行mRNA分析。差异倍数(Fold Change, FC)是指两个群体之间的表达量之比。P<0.05表明差异具有统计学意义。
1.6 与mRNA差异表达有关的信号途径分析对比以上各基因的 KEGG和GO数据,基于GO富集性研究,深入研究其生物学过程、分子功能,以及其在细胞内的组成。本研究发现相对于全基因组背景,这些mRNA具有显著丰富度的KEGG通路和GO项目。说明这些mRNA在特定的生物学进程和分子功能中发挥重要作用。
1.7 免疫组织化学染色法验证候选mRNA将三阴乳腺癌组织及正常组织取材后用生理盐水冲洗干净后置于10%中性福尔马林溶液中固定,然后根据取材、包埋、切片、烤片、脱蜡、水化、抗原修复等免疫组化标准方法进行实验后,在光学显微镜下观察组织切片,并按照评分标准[10]进行评分。一抗稀释液一般为PBS,抗体名称:PSD-95(DLG4),通过预实验确定准确稀释倍数为:1∶200。根据阳性染色强度分为4个等级:0分为阴性(无色),1分为浅黄色(弱阳性),2分为棕黄色(中等阳性),3分为棕褐色(强阳性)。根据阳性染色的肿瘤细胞比例分为5个等级:0分,阳性细胞<5%;1分,阳性细胞占6%~25%;2分,阳性细胞占26%~50%;3分,阳性细胞占51%~75%;4分,阳性细胞>75%。综合两项评分:总分范围为0~8分,0分评级为不表达,1~2分评级为低表达,3~8分评级为高表达。
2 结果
2.1 外泌体测序分析差异表达的mRNA通过对基因序列的分析,发现90条基因在mRNA水平上的差异,11条在基因水平上显著升高,79条在下降。图1、图2为 DEG的火山图和热流图。

图1 两组患者外泌体中差异表达的mRNA
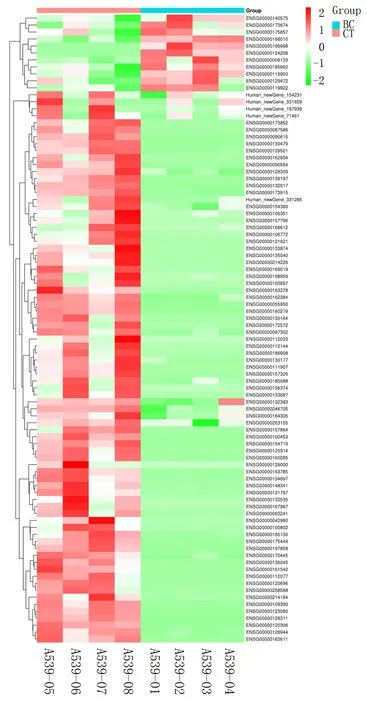
图2 差异性显著mRNA的聚类分析
2.2 mRNA功能性富集分析的差异性表达结果经GO、KEGG-Pathway等方法检测,筛选出差异表达 mRNAs,其主要参与细胞自噬、NIK/NF-κB信号的调节等;在细胞器成分领域中涉及到胞浆、突触部分等,其参与的生物过程包括蛋白磷酸酶结合、GTP酶抑制剂活性的调控等(图3)。同时,在KEGG-Pathway中,这些mRNA涉及到的信号途径有硫酸盐代谢途径、半胱氨酸等(图4)。
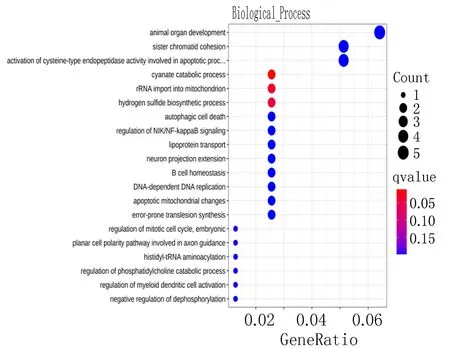
图3 差异表达mRNA 的GO富集分析气泡图
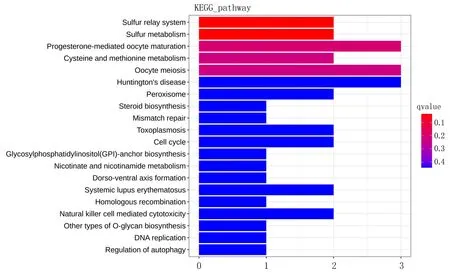
图4 差异表达mRNA的KEGG富集分析柱状图
PSD-95(DLG4)为其中一个具有显著差异性的mRNA。因此将PSD-95(DLG4)确定为候选mRNA,并应用免疫组化技术检测三阴型乳腺癌和乳腺良性肿瘤中该基因的表达。
2.3 PSD-95(DLG4)在三阴型乳腺癌组织和乳腺良性肿瘤组织中的表达水平PSD-95(DLG4)在三阴型乳腺癌组织中的表达水平(4.17±2.13)显著低于乳腺良性肿瘤组织(7.87±0.346)。三阴型乳腺癌组织和乳腺良性肿瘤组织PSD-95(DLG4)免疫组化染色结果见图5。

样本分类40×100×200×400×三阴型乳腺癌组织乳腺良性肿瘤组织
2.4 三阴型乳腺癌中PSD-95(DLG4)蛋白的表达及其与临床病理的相关性与PSD-95(DLG4)低表达的三阴型乳腺癌相比,PSD-95(DLG4)高表达的三阴型乳腺癌淋巴结转移率(N)大幅度下降;PSD-95(DLG4)的差异表达与乳腺癌患者淋巴结转移呈负相关(χ2=9.506,P<0.05),而与患者的年龄、绝经状态、Ki67表达水平、肿瘤大小(T)及组织学分级等无关(P均>0.05),见表1。
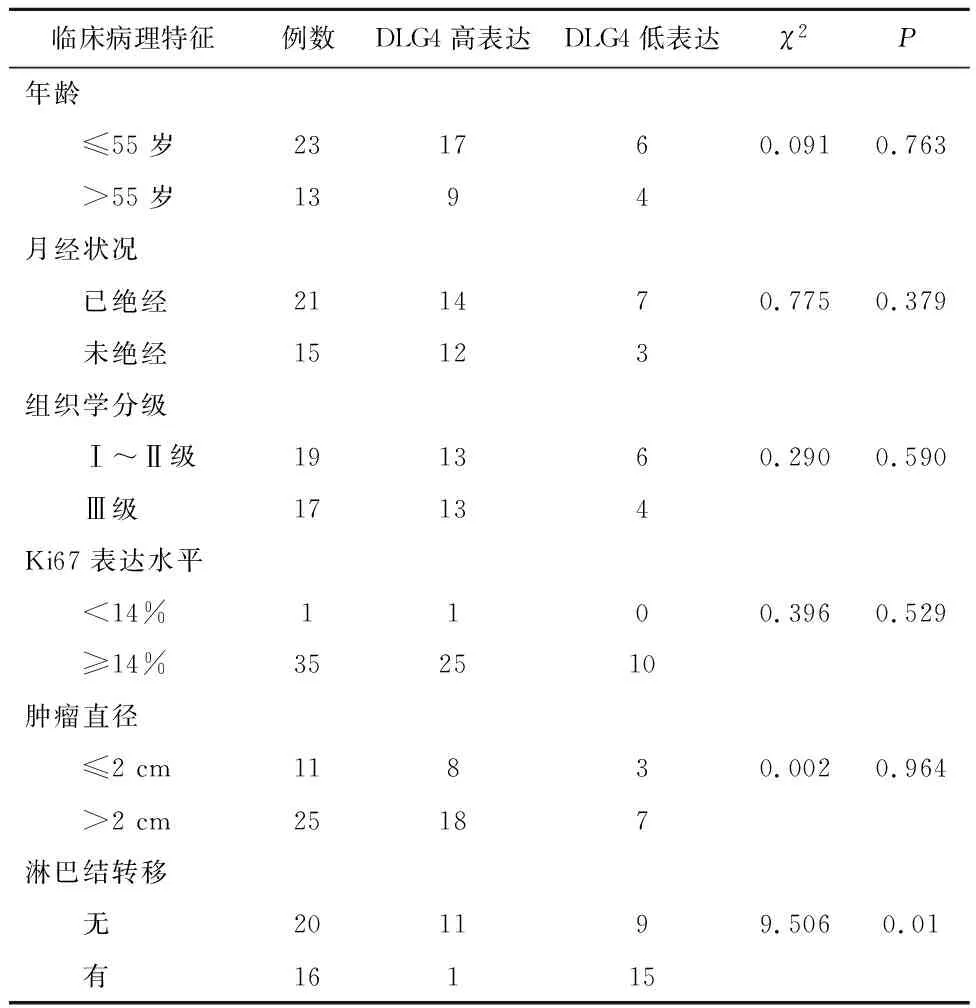
表1 DLG4表达与三阴型乳腺癌患者病理特征相关性
3 讨论
三阴型乳腺癌由于ER/PR、ERBB2基因缺失因此得名,由于它对内分泌治疗和靶向治疗不敏感,所以预后相对较差,并且容易在早期出现复发转移等情况。化疗一直是临床上对三阴型乳腺癌的主要一线治疗选择。寻求三阴型乳腺癌的高效治疗靶标,实现精准靶向治疗,是减少三阴型乳腺癌术后复发和转移的重要途径。
DLG4编码PSD-95蛋白,其是MAGUK家族的一个成员。它与PSD-93一起被招募到相同的N-甲基-D-天氡氨酸(NMDA)受体和钾通道群中。有研究表明,Syntenin是癌细胞转移中的主要蛋白质,已被确定为外泌体生物行为中的关键参与者,该蛋白包括4个功能区:N末端、DLG4、PDZ1、PDZ2和 CTD。相关分子研究结果表明,PDZ结构域位于细胞内或质膜中,并与伴侣蛋白的C端肽结合。在乳腺癌中,syntenin-1过度表达[11-13],导致乳腺癌发生上皮间充质转化(EMT)[14]。通过miRNA上调或下调表达来干预乳腺癌的迁移和侵袭能力,因而在治疗过程中选择相应的基因作为靶点,对其进行针对性的调节可起到更好的治疗效果,这也是在针对肿瘤生物学行为对其进行靶向干预研究领域中的重要方向[15]。
外泌体作为一种新型的胞外囊泡,在乳腺癌发生发展过程中也发挥着重要的作用[16]。本研究在三阴型乳腺癌和乳腺良性肿瘤患者外泌体中筛选差异表达基因,并将PSD-95(DLG4)做为本研究中一个具有显著差异性的mRNA,通过KEGG和GO富集分析发现其可能参与NIK/NF-κB信号通路的调节,而该信号通路对乳腺癌的侵袭、转移会产生一定促进作用[17],由此推测PSD-95(DLG4)可能通过调控或干预该信号通路来影响乳腺癌的发生发展。
本研究结果表明,PSD-95(DLG4)低表达可能影响三阴型乳腺癌的发生发展,并且PSD-95(DLG4)低表达与乳腺癌侵袭转移有关。因此,尽早了解和此类患者淋巴结转移情况有助于制定更加精准的治疗方案。PSD-95(DLG4)作为编码RNA,若能在基因层面对其进行早期干预有望降低患者的淋巴结转移风险。由于本研究的样本例数较少,因此无法对患者进行生存分析。从数据库分析得出PSD-95(DLG4)可能参与NF-κB通路的调节,但其参与的具体机制尚不清楚,本课题组今后将对该机制进行进一步研究和探讨。
