腰椎间盘突出伴坐骨神经痛患者血清HIF-1α、VEGFA水平与痛阈值关系及交互作用
2024-05-07张雪峰王士源袁光海
张雪峰, 李 伟, 王士源, 袁光海
(青岛市第八人民医院1骨科, 2手足外科, 山东 青岛 266100)
腰椎间盘突出(Lumbar disc herniation, LDH)是腰椎间盘髓核突出压迫神经组织而诱发的一系列症状。LDH发病与年龄、腰部过度负荷等因素有关。近年来,LDH发病率显著增加,且有年轻化趋势[1]。数据显示,超过80%的LDH患者出现坐骨神经痛的症状[2]。腰椎间盘突出伴坐骨神经痛(lumbar disc herniation sciatica, LDHS)会影响患者下肢感觉、肌力及神经反射,甚至可出现神经反射消失。手术时可见LDHS患者受累神经根存在明显水肿及炎症,其发生机制可能与突出的髓核压迫或牵张已有炎症的神经根致静脉回流受阻,神经组织缺氧缺血损伤致疼痛敏感性增加有关[3],但具体分子机制尚无定论,而进一步揭示其发病机制对指导制定治疗方案具有重要意义。
缺氧诱导因子-1α(Hypoxia induced factor-1α, HIF-1α)是机体氧代谢重要调节因子之一,能通过调节与细胞能量代谢等因子的生成而提高组织氧缺乏的适应能力,是细胞氧稳态的重要介质[4]。2022年He等[5]发表的一项研究证实,提高HIF-1α能通过减少线粒体功能障碍及痛觉过敏而改善神经病理性疼痛。血管内皮生长因子A(Vascular endothelial growth factor A,VEGFA)是在神经系统内表达最丰富的VEGF家族成员,已有研究证实,其表达水平与神经系统发育及功能发挥的多个环节有关[6]。同时有研究表明,HIF-1α能通过作用于下游基因VEGFA而减轻神经损伤,二者共同参与神经损伤的修复过程[7]。本研究旨在探讨LDHS患者血清HIF-1α、VEGFA水平与痛阈值的关系及交互作用,现报道如下。
1 资料与方法
1.1 研究对象选取2020年5月至2023年2月在本院就诊的126例LDHS患者作为病例组,另选取同期体检健康者126例作为对照组。病例组男性96例,女性30例,年龄26~64岁,平均年龄(43.68±6.43)岁;体重指数(BMI)18~29 kg/m2,平均BMI(23.19±2.11) kg/m2;有吸烟史者41例。对照组男性87例,女性39例,年龄23~67岁,平均年龄(45.85±6.81)岁;BMI 18~29 kg/m2,平均BMI(23.28±2.12) kg/m2;有吸烟史者44例。两组患者性别构成比、年龄、BMI、有吸烟史等基线资料差异无统计学意义,具有可比性(P>0.05)。本研究经本院医学伦理委员会审批通过(批号:20182)。
1.2 纳入与排除标准(1)纳入标准:根据《腰椎间盘突出症诊疗中国疼痛专家共识》[8]诊断确诊LDHS:①下肢放射性疼痛,且疼痛部位符合对应受累神经支配区域;②直腿抬高试验、直腿抬高加强试验阳性;③腰椎CT或磁共振提示椎间盘突出,受压神经与症状、体征受累神经相符,符合上述3项即可诊断为LDHS。(2)排除标准:其他原因所致坐骨神经痛;椎体畸形;脊椎功能障碍、脊柱结核、椎管内肿瘤;精神疾病;认知功能障碍;哺乳及妊娠期女性。
1.3 方法
1.3.1 血清HIF-1α、VEGFA水平检测 病例组入院治疗前,对照组体检当天均采取非抗凝真空管采集晨空腹肘静脉血4 mL, 离心10 min (3 000 r/min, 半径8 cm), 取上清, 用赫澎(上海)生物科技有限公司生物HIF-1α酶联免疫试剂盒、VEGFA酶联免疫试剂盒分别检测HIF-1α、VEGFA水平。由同一资深检验科技师参照对应试剂盒说明书步骤规范操作完成,HIF-1α、VEGFA均用对应试剂盒规范检测3次,取平均值。
1.3.2 痛阈值检测 采用北京金洋万达科技有限公司JY-EP-S601型痛觉与痛阈仪测试臀部痛阈值,仪器测试头面积约0.5 cm2,测量时垂直于臀部肌肉以3 N/s速率施力,嘱患者测试点压力感转变为痛感时,向测试者报告,移除痛觉与痛阈仪记录最大压力值即为痛阈值。均由同一资深医师规范操作完成,每例均检测3次,检测时间间隔30 s,最终取平均值作为检测值,数值越低提示患者越易产生疼痛。
1.4 观察指标(1)对比两组血清HIF-1α、VEGFA水平、痛阈值。(2)分析血清HIF-1α、VEGFA水平与痛阈值的关系。(3)比较病例组不同情况患者痛阈值。(4)病例组进行痛阈值的多元线性回归分析。(5)分析HIF-1α、VEGFA对痛阈值的交互作用。
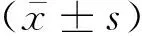
2 结果
2.1 两组血清HIF-1α、VEGFA水平、痛阈值比较病例组血清HIF-1α、VEGFA水平高于对照组,痛阈值低于对照组(P<0.05)。见表1。
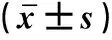
表1 两组血清HIF-1α、VEGFA水平、痛阈值比较
2.2 血清HIF-1α、VEGFA水平与痛阈值的关系经Pearson相关系数分析,病例组血清HIF-1α(r=0.777,P<0.001)、VEGFA(r=0.822,P<0.001)水平与痛阈值呈正相关,对照组血清HIF-1α(r=0.383,P<0.001)、 VEGFA(r=0.453,P<0.001)水平与痛阈值无明显相关性。见图1、2。
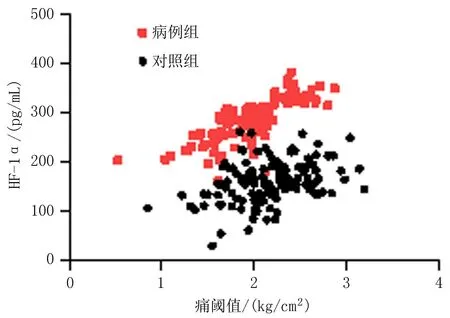
图1 血清HIF-1α水平与痛阈值关系
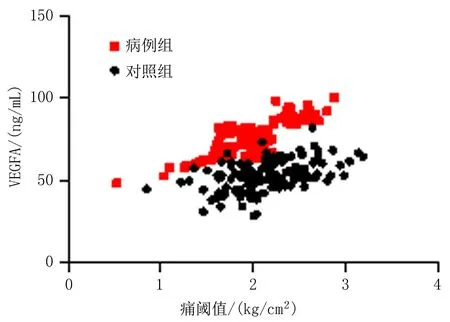
图2 血清VEGFA水平与痛阈值关系
2.3 病例组不同情况患者痛阈值比较不同性别、年龄、LDH病变部位、CT分型、是否饮酒、合并高血压、合并高脂血症患者痛阈值比较,差异无统计学意义(P>0.05)。BMI≥24 kg/m2、吸烟、LDH病程≥5年、伴发坐骨神经痛病程≥24个月、合并糖尿病、血清HIF-1α水平<286 pg/mL、血清VEGFA水平<76 ng/mL的患者痛阈值相对较低(P<0.05)。见表2。
表2 病例组不同情况患者痛阈值比较
2.4 病例组痛阈值的多元线性回归分析将BMI、吸烟、合并糖尿病、LDH病程、伴发坐骨神经痛病程、血清HIF-1α及VEGFA水平纳入多元线性回归分析,结果显示,BMI、吸烟、LDH病程、伴发坐骨神经痛病程、合并糖尿病对痛阈值无显著影响(P>0.05),血清HIF-1α、VEGFA水平与痛阈值存在线性相关(P<0.05),拟合方程为Y=-0.409+0.004×HIF-1α+0.019×VEGFA,所有预测变量可解释因变量的74.3%的方差。见表3。

表3 病例组痛阈值不考虑交互作用的多元线性回归分析
2.5 HIF-1α、VEGFA对痛阈值的交互作用考虑交互作用,痛阈值的拟合方程为Y=19.276+0.062×HIF-1α+0.047×VEGFA-0×HIF-1α×VEGFA,所有预测变量可解释因变量的74.7%的方差。VEGFA的均值为76.35 ng/mL,此时痛阈值=19.276+0.062×HIF-1α+0.047×76.35-0.001×HIF-1α×76.35=0.975+0.062×HIF-1α;当VEGFA的均值为65.77 ng/mL(少于均值的1个标准差值),此时痛阈值=19.276+0.062×HIF-1α+0.047×65.77=0.476+0.062×HIF-1α;当VEGFA的均值为86.93 ng/mL(多于均值的1个标准差值),此时痛阈值=19.276+0.062×HIF-1α+0.047×86.93=1.471+0.062×HIF-1α,由图3知,HIF-1α、VEGFA对痛阈值的影响存在相乘交互作用。见图3、表4。
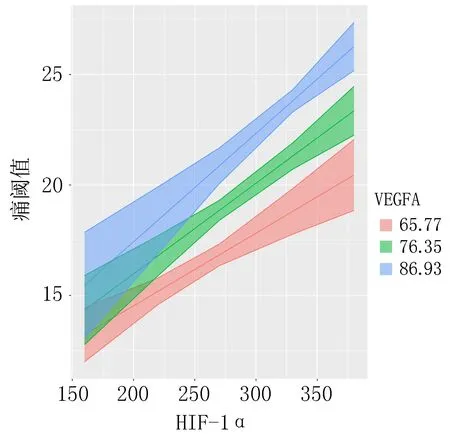
图3 HIF-1α、VEGFA对痛阈值的交互作用
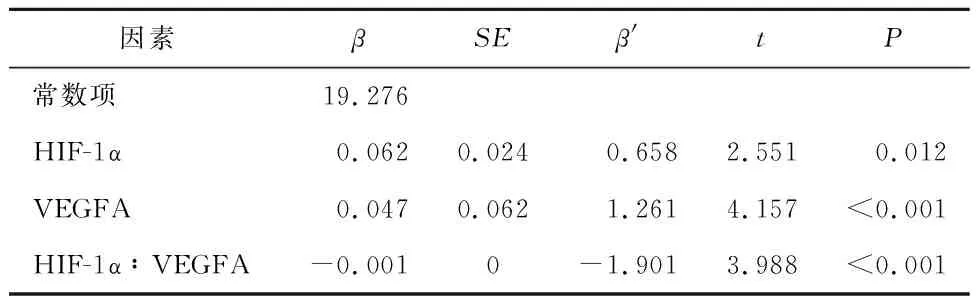
表4 病例组痛阈值交互作用的多元线性回归分析
3 讨论
LDHS是由腰椎间盘退行性病变所致,轻者影响患者日常生活,重者可致下肢肌肉萎缩、运动功能障碍。有研究显示,个体的体感特征存在异质性,而LDHS患者的机械痛阈值普遍较低[9]。本研究也发现,病例组痛阈值低于对照组(P<0.05)。LDHS是一种神经病理性疼痛,伤害性刺激会在损伤部位及附近组织或远端产生敏感性增强的疼痛或疼痛过敏区域造成更强的疼痛反应[10],但该过程的具体分子机制尚未明确。
HIF-1α是细胞内感知机体组织缺氧状态并反应性调节相关信号通路适应低氧的一种调控分子。近年随着人们对HIF-1α研究认识的深入,其在神经元保护及修复中的作用也愈发受到广大学者重视。贺俭[11]研究指出,HIF-1α能通过上调线粒体自噬而改善糖尿病神经病理性疼痛小鼠的脊髓线粒体功能障碍,继而减轻神经病理性疼痛。本研究结果显示,LDHS患者血清HIF-1α水平普遍升高,提示血清HIF-1α水平变化可能与LDHS发生有关。进一步Pearson相关系数分析发现,血清HIF-1α水平与痛阈值呈正相关。结合现有研究分析相关机制,可能是LDHS的本质是坐骨神经受到髓核突出刺激或压迫损伤后,脊髓背角感觉神经元内突触效能增加以致中枢致敏,对痛觉敏感性升高,而此过程的发生发展涉及氧化应激及炎症反应等多个病理生理反应,众多反应不仅会诱发神经细胞线粒体功能障碍,还会形成瀑布样级联反应,加剧神经系统结构及功能的损伤,加重LDHS[12-13]。正常情况下,HIF-1α生成后被脯氨酰羟化后与肿瘤抑制蛋白结合而发生泛素化并经泛素2蛋白酶小体途径降解,缺氧时,脯氨酰羟化酶活性被抑制,HIF-1α无法降解[14],而LDHS患者血清HIF-1α水平升高或可解释为:当LDHS发生时,局部神经组织细胞受炎性及氧化应激影响发生线粒体功能障碍,氧气利用率降低,受缺氧刺激,HIF-1α降解途径被抑制的同时启动HIF-1α生成机制以适应低氧状态,保护神经细胞免受缺氧损伤[15]。因此,血清HIF-1α高水平患者对痛觉敏感性低,表现LDHS症状较轻。上述研究说明,HIF-1α可能与LDHS的发生存在密切关系。
此外,腰部神经根的机械性及炎性损伤在LDHS的发病过程中发挥着重要作用[16]。VEGFA是在神经组织内广泛分布的一种高度特异性促血管内皮细胞生长因子,其表达水平不仅与血管形成、细胞外基质变性等有关,还参与神经系统发育及功能发挥等多个环节。有研究表明,VEGFA能增加C纤维机械刺激感受器的敏感性,使疼痛信号传递增加[17]。但也有研究指出,当归四逆汤治疗糖尿病大鼠坐骨神经痛可通过上调神经组织VEGF表达,升高痛阈值[18]。本研究显示,病例组血VEGFA水平高于对照组(P<0.05),其升高程度与痛阈值呈正相关,与上述研究存在一定差异。分析相关机制可能是由于疼痛是人体的一种保护机制,是机体组织出现疾病的警告,疾病去除则疼痛消失,而在不同疾病及同种疾病的不同阶段,如疾病发生的早期阶段,VEGFA可能会通过增加机体疼痛敏感性,随治疗的进行VEGFA又参与血管新生及神经细胞修复等过程,通过促进组织血供恢复而改善局部组织缺氧状态,抑制组织损伤[19-20]。本研究选取的患者病程较长,造成差异的原因可能与多数患者已进行各种治疗有关。进一步多元线性回归分析发现,血清HIF-1α、VEGFA表达与痛阈值存在线性相关,尤其是VEGFA低表达时,随HIF-1α表达升高,患者痛阈值增加显著,模型可解释因变量74.7%的方差,提示该模型在对患者的病情评估中具有可靠价值。考虑交互作用发现,HIF-1α、VEGFA对痛阈值的影响存在相乘交互作用。分析可能是在脊柱过度负荷、吸烟等因素刺激下,坐骨神经细胞发生氧利用障碍时,HIF-1α能刺激VEGFA等因子表达以提升神经细胞对缺血缺氧状态的耐受性并建立血氧微循环,促进神经功能恢复。由此说明LDHS患者的痛阈值可能是由HIF-1α、VEGFA共同决定的。
综上可知,HIF-1α、VEGFA与LDHS患者痛阈值关系密切,在对痛阈值影响中具有交互作用。
