基于网络药理学和动物实验探究桑寄生对牙周炎的防治作用
2024-05-07张文杰吴泽钰姬晓炜
冯 凯, 张文杰, 吴泽钰,3, 姬晓炜, 赵 今,3
(1新疆医科大学第一附属医院(附属口腔医院)牙体牙髓病科, 2口腔修复种植科; 3新疆维吾尔自治区口腔医学研究所, 乌鲁木齐 830054)
牙周炎(Periodontitis)又称为破坏性牙周病,是由菌斑微生物侵犯牙周组织引起的慢性炎症,可导致牙周支持组织破坏和牙槽骨吸收[1]。研究表明组织破坏是宿主对细菌毒力因子的免疫炎症反应激活的结果[2]。使用安全有效的药物控制菌斑微生物,调节过度的宿主免疫反应,限制牙周支持组织的破坏,是牙周炎药物治疗成功的关键。近年来中草药因药理活性好、副作用少等优点备受关注[3-4]。研究发现多种天然药物具有抑制牙周病致病菌的生长、控制炎症、促进组织再生的作用,在治疗牙周病方面卓有成效[5-6]。桑寄生为桑寄生科植物桑寄生[Taxilluschinensis(DC.)Danser]干燥带叶的茎枝,具有祛风湿、补肝肾、强筋骨、安胎等功效[7]。近年来对桑寄生药理作用的相关研究显示其在抗炎、抗骨质疏松等方面具有良好的功效,临床上主要用于骨关节炎及骨质疏松症的治疗[8],其中主要成分槲皮素已被研究证实对实验性大鼠牙周炎具有一定的治疗效果[9]。本研究基于网络药理学分析探究桑寄生治疗牙周炎的有效成分、作用靶点和信号通路,通过抑菌及动物实验探究桑寄生乙醇提取物对牙周炎的防治作用,现报道如下。
1 材料与方法
1.1 试药桑寄生(广东汇群中药饮片股份有限公司,批号:20230101);组织RNA保存液(北京索莱宝科技有限公司,批号:SR0020);DAB显色试剂盒(北京索莱宝科技有限公司,批号:DA1010);4%多聚甲醛组织固定液(北京兰杰柯科技有限公司,批号:BL539A);EDTA脱钙液(北京兰杰柯科技有限公司,批号:BL616B);Trizol试剂(美国Ambion公司,批号:15596026CN);cDNA逆转录试剂盒(美国TaKaRa公司,批号:RR047A);PCR试剂盒(美国TaKaRa公司,批号:RR820A);IL-6、TNF-α、MMP-9ELISA试剂盒(美国Elabscience公司,批号:E-EL-R0015、E-EL-R2856、E-EL-R3021);OCN、RUNX2 Antibody(英国BOSTER公司,批号:PB9920、M00442);Goat Anti Rabbit IgG HRP二抗(美国Affinity Biosciences公司,批号:S0001)。
1.2 仪器组织研磨仪(上海净信实业发展有限公司); PCR扩增仪(美国Bio-Rad公司);Multiskan GO酶标仪、NaNo-DROP1000核酸蛋白测定仪、荧光定量PCR扩增仪(美国Thermo Fisher公司)。
1.3 菌株P.g国际标准菌株 ATCC 33277(北京生物保藏中心)。
1.4 实验动物42只雄性SPF-SD大鼠,6~8周龄,购自新疆医科大学医学动物实验中心,实验动物生产许可证号:SCXK(新)2020-0002。本研究通过新疆医科大学实验动物伦理委员会审批(批号:IACUC-20230627-12)。
1.5 桑寄生治疗牙周炎的网络药理学分析及分子对接验证
1.5.1 桑寄生有效成分及靶点的筛选与预测以及牙周炎靶点的获取 通过TCMSP数据库中检索得到桑寄生的有效化学成分及相关靶点(OB≥20%、DL≥0.18),经Swiss Target Prediction数据库预测桑寄生有效成分的治疗作用靶点。在Gene Cards、Dis Ge NET和OMIM数据库中检索得到牙周炎相关靶点,经 Venny分析获得共同靶点。
1.5.2 构建PPI网络并筛选关键靶点 将桑寄生治疗牙周炎的共同靶点导入STRING数据库(物种为“Homo sapiens”,置信度得分>0.4)构建PPI网络。利用Cytoscape 3.10.0软件将PPI网络可视化分析,采用Cytohubb插件选取MCC评分前10的基因建立核心靶点网络。
1.5.3 GO功能和KEGG通路富集分析 采用DAVID数据库对共同靶点进行GO的生物过程(Biological process, BP)、细胞成分(Cellular component, CC)、分子功能(Molecular function, MF)富集分析及KEGG通路富集分析,设置FDR<0.001,以P<0.001为筛选条件,绘制气泡图。
1.5.4 桑寄生“药物-成分-靶点-通路”网络的构建与分析 将筛选得到的药物有效成分、作用靶点、信号通路导入Cytoscape 3.10.0软件中,绘制桑寄生“药物-成分-靶点-通路”网络。
1.5.5 桑寄生有效成分与关键靶点的分子对接验证 PDB数据库中下载关键靶点的3D结构文件,应用PyMOL软件进行结构预处理。Pub Chem数据库中下载桑寄生有效成分的mol2结构文件。将处理好的结构文件导入 Auto Dock Tools软件转换为pdbqt格式,应用Auto Dock Vina软件进行分子对接,对分析结果进行可视化处理[10]。
1.6 桑寄生乙醇提取物对P.g的生长抑制作用
1.6.1 桑寄生乙醇提取物及药液制备 将200 g桑寄生药材用80%乙醇依次以料液比1∶10、1∶8、1∶6回流提取3次,每次1.5 h,合并3次滤液,将滤液旋转蒸发浓缩并冷冻干燥(-80℃),获得桑寄生乙醇提取物粉末。将桑寄生乙醇提取物粉末溶于含1% DMSO 的BHI液体培养基中,配制成浓度为8 g/L的母液。
1.6.2P.g菌液的制备 将P.g菌株接种于BHI琼脂血平板上,37℃恒温厌氧培养5~7 d,待表面长出褐色菌落后,挑取直径约1 mm的单个菌落接种于BHI液体培养基中,培养至对数期,调整菌液浓度至2×107cfu/mL备用。
1.6.3 桑寄生乙醇提取物对P.g的MIC和MBC的测定 实验组采用二倍稀释法将8.000、4.000、2.000、1.000、0.500、0.250、0.125、0.062 5 g/L的桑寄生药液与“1.6.2”项下P.g菌液各1 mL混合均匀,使细菌终浓度为1×107cfu/mL,每个浓度设置相同药物浓度不含菌液的BHI培养基为对照组,37℃恒温培养48 h。分别取各浓度实验组及对照组培养物200 μL加入96孔板中,用酶标仪测定600 nm处吸光度(Optical density, OD)值,当实验组与对照组OD值差别≤0.05时的最低药物浓度即为桑寄生对P.g的MIC。从大于MIC浓度的实验组中蘸取培养物,涂布于BHI琼脂血平板上培养48 h,观察菌落数少于5个的最低药物浓度为桑寄生对P.g的MBC。
1.7 桑寄生乙醇提取物对实验性大鼠牙周炎的治疗作用
1.7.1 实验性大鼠牙周炎模型的建立 取36只雄性SD大鼠,禁食水8 h后,全身麻醉下用浸有P.g菌液的4-0丝线结扎左上颌第一磨牙建立牙周炎模型。14 d后随机拍摄空白组和模型组大鼠左上颌第一磨牙X线片。当模型组PD和SBI均大于空白组,X线片上模型组与空白组相比出现明显的牙槽骨的吸收,表明建模成功。
1.7.2 实验性牙周炎大鼠分组及药物干预 取“1.7.1”项下建模成功的牙周炎大鼠36只,随机分为溶剂组(甘油)、模型组、盐酸米诺环素组(盐酸米诺环素软膏)、桑寄生高剂量组(2倍MIC浓度的桑寄生乙醇提取物甘油溶液)、桑寄生中剂量组(1倍MIC浓度的桑寄生乙醇提取物甘油溶液)、桑寄生低剂量组(1/2倍MIC浓度的桑寄生乙醇提取物甘油溶液),另取6只未建模大鼠为空白组。除空白组和模型组外,从造模第1天开始每天给予20 μL对应药物局部涂抹结扎处,上药后禁食水1 h,连续给药14 d。
1.7.3 指标的记录 将造模当天定为第0天,从第0天开始每日测量各组大鼠体重,从第1天开始每日测量各组大鼠的左上颌第一磨牙的牙周PD和SBI。记录各组大鼠的体重、PD、SBI 。
1.7.4 样本的采集 对各组大鼠全身麻醉腹主动脉采血5 mL,室温静置2 h,3 000 r/min,离心10 min收集血清。取血后,立即收集大鼠左侧上颌骨,置于组织固定液中固定。将各组部分大鼠左上颌第一磨牙牙龈组织剥离,置于RNA保存液中。
1.7.5 RT-PCR检测 取各组大鼠牙龈组织分别提取总RNA,按照逆转录试剂盒说明书操作合成cDNA,按照PCR试剂盒说明书操作进行RT-PCR检测。以GADPH作为内参基因,PCR产物应用相对Ct法(2-△△Ct)对IL-6、TNF-α、MMP-9、RUNX2、OCN、OPG、RANKL基因表达进行相对定量分析,引物信息见表1。

表1 引物信息
1.7.6 ELISA检测 取各组冻存的血清按照ELISA试剂盒说明书操作步骤测定血清中IL-6、TNF-α、MMP-9的含量。
1.7.7 HE染色 将固定好的颌骨标本制作石蜡切片,按标准步骤HE染色、封片后,观察牙周组织炎症细胞浸润情况。
1.7.8 免疫组织化学染色 将制作好的颌骨石蜡切片按标准步骤进行免疫组化染色、封片后,显微镜下观察RUNX2、OCN蛋白表达情况。
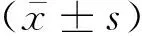
2 结果
2.1 桑寄生治疗牙周炎的网络药理学分析及分子对接验证结果
2.1.1 桑寄生活性成分的筛选结果 将检索得到桑寄生的46个化学成分根据筛选条件筛选后获得4种活性成分,见表2。
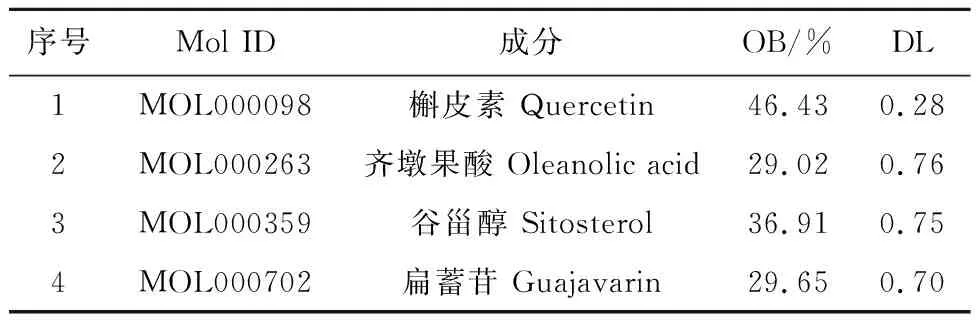
表2 桑寄生4种主要活性成分及药理参数
2.1.2 桑寄生治疗牙周炎的潜在靶点 对桑寄生的4个活性成分进行检索后得到545个相关药物靶点,与检索得到的4 151个牙周炎疾病相关靶点进行Venny分析后,获得186个桑寄生治疗牙周炎的潜在靶点,见图1。
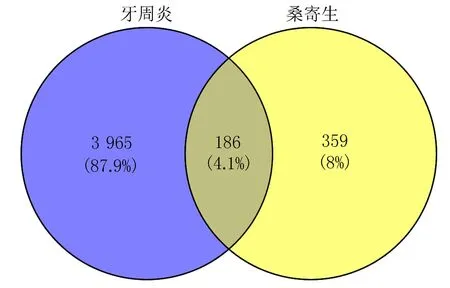
图1 桑寄生-牙周炎共同靶点Venny图
2.1.3 PPI网络的构建并获取 桑寄生治疗牙周炎的关键靶点将共同靶点导入STRING数据库构建PPI网络图(图2A),以度值为筛选标准筛选出关键靶点30个(图2B),通过MCC评分得到得分前10的核心靶点为:IL6、TNF、MMP9、丝氨酸/苏氨酸蛋白激酶1(AKT1)、低氧诱导因子1α(HIF1A)、胱天蛋白酶3(CASP3)、B淋巴细胞瘤2(BCL2)、肿瘤蛋白p53(TP53)、表皮生长因子受体(EGFR)、白细胞介素1β(IL1B),建立核心靶点网络(图2C)。

注: A. 桑寄生治疗牙周炎靶点的PPI网络图; B. 桑寄生治疗牙周炎的关键靶点; C. 桑寄生治疗牙周炎的核心靶点。
2.1.4 GO功能和KEGG通路富集分析结果 利用DAVID数据库对186个共同靶点进行GO及KEGG富集分析并绘制气泡图(图3)。GO富集分析中BP相关条目涉及RNA聚合酶II启动子转录的正调控、炎症反应、DNA模板转录的正调控等,CC相关条目涉及质膜、胞质溶胶、细胞质等,MF相关条目涉及蛋白质结合、相同蛋白质结合、酶结合等。KEGG富集得到的主要通路包括癌症的发病途径、人巨细胞病毒感染、PI3K-Akt信号通路等。
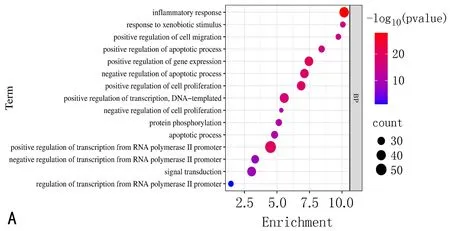
注: A. GO富集分析-BP; B. GO富集分析-CC; C. GO富集分析-MF; D. KEGG富集分析。
2.1.5 桑寄生“药物-成分-靶点-通路” 网络分析通过Cytoscape 3.10.0构建桑寄生“药物-成分-靶点-通路”网络图(图4),表明桑寄生中的多种有效成分可通过多条信号通路调节作用于多个靶点来达到潜在治疗牙周炎的作用。

图4 桑寄生“药物-成分-靶点-通路”网络图
2.1.6 分子对接验证结果 将部分桑寄生有效成分与筛选得到的10个关键靶点进行分子对接,结果见表3。对分子对接结果进行可视化处理后,部分分子对接模式图如图5所示。分析结果表明,桑寄生有效成分与部分关键靶点之间展现出良好的结合活性(结合键能<-5 kcal/mol)。
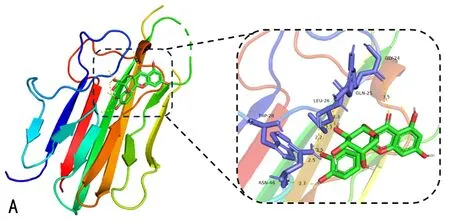
注: A. TNF与扁蓄苷分子对接模式; B. IL6与齐墩果酸分子对接模式; C. MMP9与槲皮素分子对接模式

表3 桑寄生有效成分与关键靶点结合能预测/(kcal/mol)
2.2 桑寄生乙醇提取物对P.g的MIC和MBC测定结果桑寄生乙醇提取物对P.g的生长具有一定的抑制和杀灭作用,实验测得桑寄生乙醇提取物对P.g的MIC为0.5 g/L,MBC为2 g/L。
2.3 桑寄生乙醇提取物对实验性大鼠牙周炎的治疗作用效果
2.3.1 成功构建实验性大鼠牙周炎模型 建模14 d后,随机拍摄空白组和模型组大鼠左上颌第一磨牙X线片(图6)。观察发现模型组大鼠的牙槽骨与空白组相比出现明显的吸收暗影,表明实验性大鼠牙周炎模型构建成功。

空白组 模型组
2.3.2 各组大鼠的体重、PD、SBI的比较 在整个实验周期内各组大鼠体重总体平稳增长。在14 d实验干预结束后,与空白组比较,模型组和溶剂组大鼠PD和SBI升高,差异有统计学意义(P<0.05),模型组与溶剂组间无明显差异(P>0.05),表明实验所用溶剂甘油对大鼠牙周炎无明显影响。与模型组比较,桑寄生高、中、低剂量组大鼠PD和SBI均降低,差异有统计学意义(P<0.05)。桑寄生高剂量组大鼠PD和SBI与盐酸米诺环素组相比无明显差异(P>0.05),见图7。
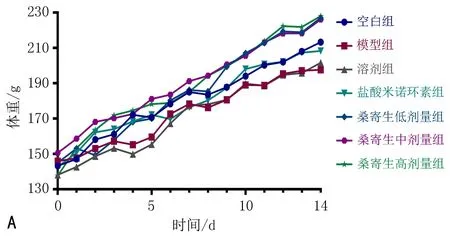
注:A.体重变化曲线;B. PD变化曲线;C. SBI变化曲线。
2.3.3 各组大鼠牙龈组织中IL-6、TNF-α、MMP-9、RUNX2、OCN、OPG、RANKL mRNA的相对表达水平 与模型组比较,桑寄生高、中、低剂量组大鼠牙龈组织中IL-6、TNF-α、MMP-9、RANKL mRNA的表达降低,RUNX2、OCN、OPG mRNA的表达升高,差异有统计学意义(P<0.05)。与盐酸米诺环素组比较,桑寄生高剂量组大鼠牙龈组织中RANKL mRNA的表达无统计学差异(P>0.05),桑寄生中剂量组大鼠牙龈组织中MMP-9、RUNX2、OCN、OPG、RANKL mRNA的表达无统计学差异(P>0.05),见图8。

注:与空白组比较, aP<0.05; 与溶剂组比较, bP<0.05; 与模型组比较, cP<0.05; 与盐酸米诺环素组比较, dP<0.05; 与桑寄生高剂量组比较, eP<0.05; 与桑寄生中剂量组比较, fP<0.05; 与桑寄生低剂量组比较, gP<0.05。
2.3.4 各组大鼠血清中IL-6、TNF-α、MMP-9的表达情况 与模型组相比,桑寄生高、中、低剂量组大鼠血清中IL-6、TNF-α、MMP-9的表达降低,差异有统计学意义(P<0.05)。与盐酸米诺环素组相比,桑寄生高、中剂量组大鼠血清中TNF-α、MMP-9的表达无统计学差异(P>0.05),见图9。
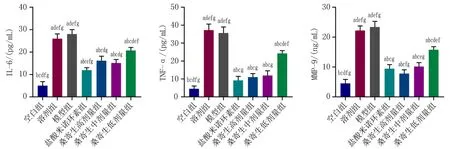
注:与空白组比较, aP<0.05; 与溶剂组比较, bP<0.05; 与模型组比较, cP<0.05; 与盐酸米诺环素组比较, dP<0.05; 与桑寄生高剂量组比较, eP<0.05; 与桑寄生中剂量比较, fP<0.05; 与桑寄生低剂量组比较, gP<0.05。
2.3.5 各组大鼠牙周组织HE染色结果 空白组龈沟上皮组织结构完整,未见明显角化,纤维排列整齐,无炎症细胞浸润,牙槽骨嵴无吸收。而溶剂组与模型组可以观察到明显的牙周组织破坏,可见异常角化上皮及大量炎性细胞浸润,牙龈纤维结构紊乱并出现断裂,牙槽骨嵴吸收明显。与模型组相比,各浓度桑寄生药物组能够呈药物浓度依赖性的缓解牙周炎症细胞浸润与组织破坏情况。各组大鼠牙周组织HE染色结果如图10所示。
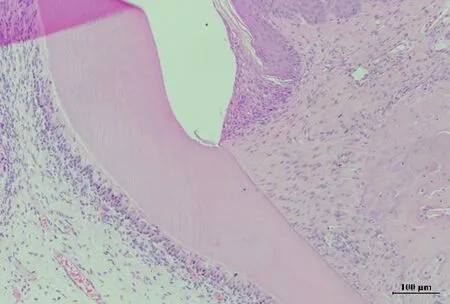
空白组
2.3.6 各组大鼠牙周组织RUNX2、OCN免疫组化染色结果 免疫组化染色阳性表现为胞浆内的黄褐色颗粒,各组大鼠牙周组织RUNX2、OCN免疫组化染色结果如图11、12所示。与空白组比较,溶剂组与模型组牙周组织中RUNX2和OCN的表达量明显降低。与模型组比较,各浓度桑寄生药物组能够呈浓度依赖性促进RUNX2、OCN的表达,桑寄生高剂量组促进效果最佳。

空白组
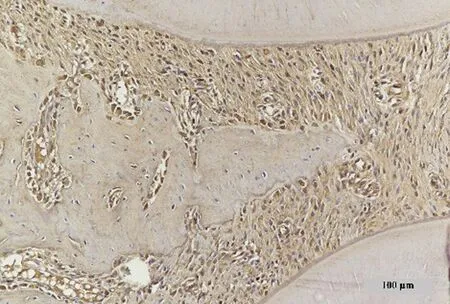
空白组
3 讨论
本研究通过网络药理学方法构建桑寄生治疗牙周炎的成分靶点通路网络,筛选出桑寄生治疗牙周炎的主要成分、核心靶点以及相关通路。有研究表明桑寄生提取物表现出良好的抗炎活性,在治疗骨关节炎和骨质疏松症中还可发挥良好的骨保护作用[11]。桑寄生提取物还具有抑菌的药理作用,黄思璐[12]在研究中发现桑寄生提取物对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、黑曲霉及青霉菌5种实验菌株均展现出良好的抑菌活性。本研究结果证明桑寄生乙醇提取物对P.g有良好的抑菌活性。
通过PPI网络分析发现桑寄生有效成分治疗牙周炎的核心靶点包括IL6、TNF、MMP9等10个核心靶点,分子对接结果表明以上靶点与桑寄生的有效成分具有良好的结合能力。TNF-α和IL-6作为重要的炎症因子,能够介导炎症反应,导致牙周组织的破坏并抑制其修复[13]。IL-6和TNF-α可以参与并介导多种信号通路诱导,多种类型的细胞表达以及破骨细胞分化因子,促使破骨细胞的形成,同时抑制成骨细胞的分化,导致骨吸收[14]。有研究发现TNF-α可诱导IL-6的表达,激发炎症级联反应,而 IL-6又可与TNF-α协同诱导增加破骨细胞前体的数量,促进破骨细胞前体分化为成熟的破骨细胞发挥作用[15]。MMP-9是一种蛋白水解酶,研究表明其表达与牙周炎活动期牙周组织损伤有关[16],可通过降解牙周组织细胞外基质,激活破骨细胞引起骨吸收,从而破坏牙周支持组织[17]。本研究发现桑寄生乙醇提取物能够明显降低牙周炎大鼠牙龈组织以及血清中IL-6、TNF-α、MMP-9的表达,HE染色结果也证明桑寄生乙醇提取物可明显缓解牙周炎大鼠牙周支持组织炎症浸润以及组织破坏情况。Shen等[18]在研究中发现桑寄生主要成分槲皮素可降低关节炎小鼠IL-6、TNF-α的分泌,洪丽萍等[19]也在研究中发现桑寄生总黄酮可降低IL-6、TNF-α水平,冯海洋等[20]研究发现桑寄生提取物能够下调MMP-9的表达,本研究结果与相关研究结果一致。
KEGG通路富集分析结果表明PI3K-Akt等信号通路是桑寄生治疗牙周炎发挥作用的关键通路。PI3K-Akt信号通路在细胞的增殖、分化、凋亡过程中发挥重要作用。多项研究表明PI3K-Akt信号通路及其下游靶蛋白与骨组织代谢之间存在密切关系[21]。RUNX2和OCN是参与成骨细胞分化成熟的重要基因,RUNX2是早期参与诱导成骨细胞分化成熟的激活剂,OCN主要参与基质矿化的过程,可作为成骨细胞成熟的标志[22]。OPG和RANKL与破骨细胞的激活与分化密切相关,RANKL是破骨细胞生成的重要因素,而OPG可与RANKL竞争性结合,阻断破骨细胞分化与激活,从而减轻骨吸收,因此RANKL/OPG比值对于评价骨吸收程度具有重要意义[23-24]。已有研究表明桑寄生提取物及其主要成分槲皮素均可通过调节OPG、RANKL的表达治疗骨质疏松症[11, 25]。本研究证明桑寄生乙醇提取物能够促进牙周炎大鼠牙龈组织中RUNX2、OCN、OPG mRNA的表达,并且能够抑制RANKL mRNA的表达,免疫组化染色结果显示桑寄生提取物能够促进牙周炎大鼠牙龈组织中RUNX2、OCN蛋白的表达,这表明桑寄生乙醇提取物可通过调节牙周炎大鼠局部骨稳态,从而缓解牙周骨组织破坏。
综上所述,本研究证明桑寄生可通过多组分、多靶点、多通路的协同作用治疗牙周炎,桑寄生乙醇提取物对P.g具有一定的抑制和杀灭作用,并可通过减轻炎症反应、调节骨稳态对实验性大鼠牙周炎产生一定的治疗作用。
