鸽腺病毒通用型实时荧光PCR检测方法的建立与应用
2024-05-07朱明慧亓丽红房立春蒋文明王静静刘华雷李建亮于晓慧
陈 璐,朱明慧,丁 雨,李 阳,亓丽红,房立春,蒋文明,6,王静静,6,刘华雷,李建亮,于晓慧,6
(1. 山东农业大学,山东泰安 271018;2. 中国动物卫生与流行病学中心,山东青岛 266032;3. 青岛农业大学,山东青岛 266109;4. 宁夏大学,宁夏银川 750021;5. 山东省农业科学院畜牧兽医研究所,山东济南 250199;6. 农业农村部动物生物安全风险预警及防控重点实验室(南方),山东青岛 266032)
禽腺病毒(fowl adenovirus,FAdV)为双股线性DNA 病毒,无囊膜,病毒直径为70~90 nm,病毒粒子呈二十面体对称,主要的衣壳蛋白是六邻体蛋白(Hexon)、五邻体蛋白(Penton)和纤维蛋白(Fiber)[1-2]。国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICTV)将禽腺病毒属(Aviadenovirus)分为14 个种:禽腺病毒A—E种、鸭腺病毒B种、鸽腺病毒A种(PiAdV-A)、鸽腺病毒B 种(PiAdV-B)[4]、鹅腺病毒A 种、火鸡腺病毒B—D 种、鹦鹉腺病毒B 种和猎鹰腺病毒B 种[3]。
鸽腺病毒(pigeon adenovirus,PiAdV)是鸽群中最常见的一种病原体。PiAdV 分为PiAdV-A和PiAdV-B 两个种。PiAdV-A 种病毒主要引起鸽肝组织弥漫性坏死或突然死亡,病鸽死亡率为10%~13%。该病毒多感染5~6 月龄信鸽,使其采食量下降,比赛成绩受影响[5-7];但其在肉鸽场扩散速度较慢,持续时间长,患病肉鸽常体质量减轻,病程长达3 个月,可突然出现死亡,累积病死率约15%。PiAdV-B 种病毒主要对1 岁龄以下的雏鸽影响较为严重,导致雏鸽生长停滞,出现呕吐、腹泻、厌食等,偶尔死亡[8]。PiAdV 给我国信鸽和肉鸽养殖业造成了严重经济损失[9]。
对于PiAdV 的诊断主要依靠实验室检测。目前,关于PiAdV 检测方法的研究较少,且并无适用于PiAdV-A 种和PiAdV-B 种病毒的通用型检测方法。因此,亟需建立能够同时检测两种PiAdV的通用型高通量检测方法以用于临床快速诊断。本研究建立了一种特异性强、敏感性高的PiAdV 通用型实时荧光PCR 检测方法,以期为PiAdV 感染的临床快速诊断提供技术支撑。
1 材料与方法
1.1 病毒核酸和临床样品
1.1.1 病毒核酸 禽流感病毒(avian influenza virus,AIV)、 新城疫病毒(Newcastle disease virus,NDV)、鸽冠状病毒(pigeon coronavirus,PiCoV)、鸽轮状病毒(pigeon rotavirus,RVA)、PiAdV、鸽圆环病毒(pigeon circovirus,PiCV)和鸽疱疹病毒(pigeon herpesvirus,PiHV)核酸,均由中国动物卫生与流行病学中心禽病监测室保存。
1.1.2 临床样品 20 份鸽临床样品来自于山东省某鸽棚,由中国动物卫生与流行病学中心禽病监测室保存。
1.2 主要试剂
Fine pure 病毒DNA/RNA 柱式提取试剂盒(离心柱型),购自GENFINE 公司;PrimerTaqTM(TaKaRaTaqTMVersion 2.0 plus dye)、TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver 4.0,购自TaKaRa 公司;ProTaqHS 预混型探针法qPCR 试剂盒Ⅲ,购自艾科瑞公司;pEASY-T5 Zero Cloning Kit, 购自TRAN 公司;TIANprep Mini Plasmid Kit,购自TIANGEN 公司。
1.3 样品处理
剖检病死鸽,取适量肝脏、脾脏等组织于洁净的2.0 mL 离心管内;按体积比1:3 加入PBS 及灭菌小钢珠,置于组织研磨机内充分研磨;反复冻融3 次后,10 000 r/min 离心5 min,收取上清,于-80 ℃冰箱保存备用。
1.4 核酸提取
按照Fine pure 病毒DNA/RNA 柱式提取试剂盒(离心柱型)说明书,进行病毒核酸提取,将提取的核酸立即用于PCR 扩增或者于-20 ℃保存。
1.5 引物、探针设计与合成
参考GenBank 中已公布的PiAdV-A 种(GenBank 登录号NC024474.1、MW286325.1)和PiAdV-B 种(GenBank 登录号KX673408.1、NC031503.1)病毒pVIII基因序列的共同保守区域,利用Primer express 分析软件,设计通用型特异性引物和TaqMan 探针(表1),引物与探针均由生工生物工程(上海)股份有限公司合成。
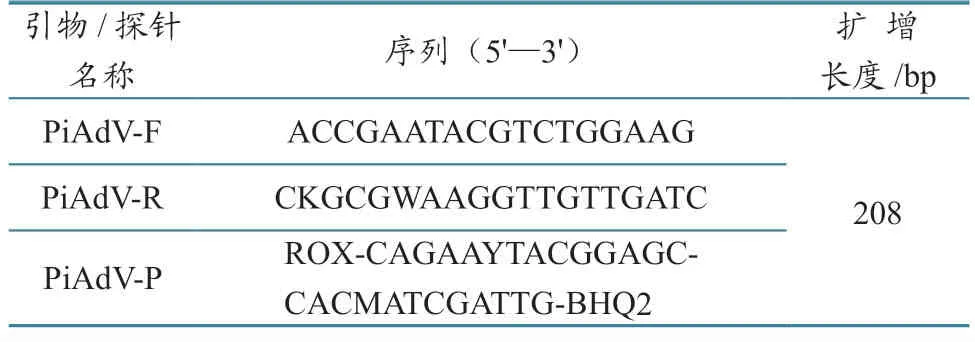
表1 实时荧光PCR 引物和探针信息
1.6 阳性质粒标准品制备
以PiAdV 核酸为模板,利用表1 中PiAdV-F和PiAdV-R 引物进行PCR 扩增,将扩增产物进行1%琼脂糖凝胶电泳鉴定;利用TaKaRa 胶回收试剂盒对PCR 产物进行纯化回收,并克隆至pEASY-T5 载体,转化到Trans-109 感受态细胞中,构建重组质粒,测序鉴定无误后提取细菌质粒。
1.7 标准品质量浓度测定与拷贝数计算
1.7.1 浓度测定 对重组质粒标准品分别进行10、100 倍稀释后,利用Nano Drop 核酸定量仪分别测量其质量浓度,若质量浓度呈10 倍梯度则测量准确。
1.7.2 拷贝数计算 拷贝数(copies/µL) =(6.02×1023)×(ng/µL×10-9)/(DNA length×660)。
1.8 实时荧光PCR 反应体系优化
以重组质粒标准品为模板,按照艾科瑞荧光PCR 试剂盒的说明书配置反应体系,并在此基础上完成反应体系和退火温度优化。
1.8.1 探针浓度优化 固定反应体系中引物终浓度不变,分别加入终浓度为0.15、0.20、0.25、0.30 µmol/L 的探针进行试验,根据实时荧光PCR检测的Ct 值确定最优探针浓度。
1.8.2 退火温度优化 将退火温度分别设置为57、58、59、60 ℃进行试验,每个温度做3 个重复,通过比较不同退火温度下的Ct 值结果确定最佳退火温度。
1.9 标准曲线建立
将阳性质粒标准品进行10 倍倍比稀释,选取5 个梯度,进行实时荧光PCR 试验。以获得的Ct值为Y 轴,重组质粒标准品拷贝数浓度为X 轴,绘制标准曲线。
1.10 特异性试验
以鸽群常见的AIV、NDV、PiCoV、RVA、PiCV、PiHV 等病毒DNA 或cDNA 为模板,进行实时荧光PCR 扩增,评价该方法的特异性。
1.11 敏感性试验
将PiAdV 标准品进行10 倍倍比稀释,取选不同的稀释度进行实时荧光PCR 扩增,每个稀释度做3 份重复。同时利用常规PCR 检测引物[10-11],对上述模板进行常规PCR 扩增及琼脂糖凝胶电泳鉴定。
1.12 重复性试验
选取5 个浓度梯度的阳性质粒标准品,用同批次配置的实时荧光PCR 反应体系进行检测,重复3 次,计算组内重复变异系数(CV);再用不同批次配置的实时荧光PCR 反应体系进行检测,重复3 次,计算组间重复CV 值。Ct 值以平均数±方差(X±SD)的形式表示。
1.13 临床样品检测
利用本研究建立的PiAdV 实时荧光PCR 检测方法,对20 份鸽临床样品进行检测,并与临床上常用的常规PCR方法检测结果及测序结果比较分析。
2 结果
2.1 阳性质粒标准品制备
以PiAdV 核酸为模板,对目的片段进行PCR 扩增(图1),扩增产物经纯化回收后克隆至pEASY-T5 载体,构建了阳性质粒标准品p-PiAdV,经PCR 鉴定结果正确。利用公式计算dsDNA 标准品的拷贝数浓度为5.69×1011copies/µL。

M. DL 2 000 DNA Marker;1. 目的片段;N. 阴性对照。图1 PiAdV 目的片段扩增结果
2.2 实时荧光PCR 反应体系优化与建立
2.2.1 探针浓度优化 保持其他反应体系不变,以阳性质粒标准品p-PiAdV 为模板,通过使用不同终浓度的探针进行荧光PCR。结果(图2)显示,0.15 µmol/L 探针的检测下限为5.69×102copies/µL,0.20~0.30 µmol/L 探针的检测下限均为5.69×101copies/µL,故探针浓度选择0.20 µmol/L。

A—D. 探针浓度依次为0.15、0.20、0.25、0.30 µmol/L。图2 不同探针浓度最低检测限的比较结果
2.2.2 退火温度优化 以5.69×106copies/µL 的阳性质粒标准品p-PiAdV 为模板,在其他条件不变的情况下,将退火温度分别设置为57、58、59、60 ℃进行实时荧光PCR,每次做3 个重复。结果(表2)显示,59 ℃时平均Ct 值最小,因此最终选择最佳退火温度为59 ℃。

表2 荧光PCR 退火温度优化结果
2.2.3 反应体系确定 最终确定的一步法实时荧光PCR 反应体系如表3 所示。最佳反应条件:95 ℃30 s;95 ℃ 5 s,59 ℃ 35 s,40 个循环。

表3 一步法实时荧光PCR 反应体系
2.3 标准曲线建立
将阳性质粒标准品p-PiAdV 进行10 倍倍比稀释,取5.69×107~5.69×103copies/µL 的质粒标准品为模板,进行实时荧光PCR 反应,绘制标准曲线(图3)。标准曲线中Ct 值和重组质粒标准品拷贝数之间呈现良好的线性关系,获得的曲线方程为Y= -3.571X+ 41.815,相关系数R2= 0.996。

重组质粒标准品拷贝数图3 PiAdV 实时荧光PCR 标准曲线
2.4 特异性试验
以鸽群7 种常见的病毒DNA 或cDNA 为模版进行特异性试验。结果(图4)显示,只有PiAdV-A 种和PiAdV-B 种病毒核酸出现特异性扩增曲线,而其他病毒核酸均无特异性扩增曲线。结果表明,建立的荧光PCR 反应特异性良好。

1. PiAdV-A 种病毒核酸;2. PiAdV-B 种病毒核酸;3~8. 依次为AIV、NDV、PiCoV、RVA、PiCV、PiHV 核酸。图4 PiAdV 实时荧光PCR 特异性试验结果
2.5 敏感性试验
以不同稀释倍数的阳性质粒标准品p-PiAdV为模板,分别用荧光PCR 和普通PCR 方法进行敏感性试验。结果(图5~6)显示,本研究建立的荧光PCR 方法的PiAdV 最低检测限为5.69×101copies/µL,而常规PCR 为5.69×103copies/µL。结果表明,PiAdV 荧光PCR 检测方法的敏感性比常规PCR 高100 倍。

1~8. 阳性质粒标准品拷贝数浓度依次为5.69×107~5.69×100 copies/µL。图5 PiAdV 实时荧光PCR 敏感性试验结果
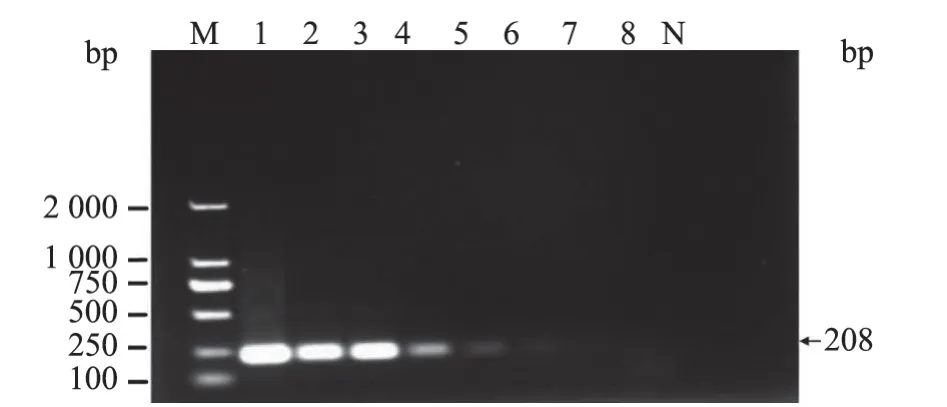
M. DL 2 000 DNA Marker;1~8. 阳性质粒标准品拷贝数浓度依次为5.69×107~5.69×100 copies/µL;N. 阴性对照。图6 PiAdV 常规PCR 灵敏度试验结果
2.6 重复性试验
结果(表4)显示,组内重复各稀释度标准品间的CV 值为0.11%~1.72%,组间重复各稀释度标准品间的CV 值为0.08%~0.53%,均小于1.8%。结果表明,该检测方法具有良好的可重复性。

表4 PiAdV 实时荧光PCR 重复性试验结果
2.7 临床样品检测
利用本研究建立的PiAdV 通用型实时荧光PCR 方法对20 份临床疑似PiAdV 感染样品进行检测,结果检出8 份阳性样品。随后对8 份阳性PCR 产物进行序列测定,序列比对结果显示,8 份阳性序列均为PiAdV 基因片段。用常规PCR 方法从上述样品中检出3 份阳性样品,两种方法的符合率为75.00%,Kappa 值为0.722(表5)。

表5 PiAdV 荧光PCR 与常规PCR 检测法检测结果比对结果 单位:份
3 讨论
近年来,我国养鸽业逐渐向产业化、规模化发展,鸽子饲养数量逐年增加,人们对鸽群中的疫病也越来越重视[12]。PiAdV 是鸽群中常见的一种病原体,当鸽感染PiAdV 时,主要表现出呕吐、消化停滞[13],继而出现脱水、体温上升、体质量减轻、排绿色水便或血便等症状,严重的在2~3 d内急性死亡[14-15]。PiAdV 单独感染时,死亡率较低,但与其他病原混合感染时,则会导致鸽群死亡率明显升高,给养鸽业造成了严重的经济损失。
病原的早期诊断是PiAdV 感染防控的关键因素[16]。目前,临床上已有针对PiAdV 的检测方法,其中病毒分离鉴定法是最可靠的检测方式,但该方法对样品的检测周期较长,不利于大规模检测[17];血清中和抗体技术和普通PCR 检测技术是实验室诊断较常用的方法,但均要求检测样本中的病毒载量较高,且血清中和抗体技术操作环节复杂[18]。此外,国内外仅有基于PiAdV-A 种和PiAdV-B 种病毒单独的核酸检测方法,还未有适用于PiAdV 通用的核酸检测方法。因此,亟需建立针对鸽群PiAdV-A 种和PiAdV-B 种病毒的通用型灵敏特异的高通量快速检测方法,为开展PiAdV感染的早期诊断提供技术储备[19]。
本研究基于鸽群PiAdV-A 种和PiAdV-B 种病毒pVIII基因保守序列设计特异性引物及探针,并对其反应体系及反应条件进行优化,建立了PiAdV通用型实时荧光PCR 检测方法。该方法特异性强、敏感性高、可重复性好。仅对PiAdV 核酸出现特异性扩增曲线;最低检测限为56.9 copies/µL,比常规PCR 检测方法的灵敏度高出100 倍;具有良好的重复性,组内重复CV 值为0.11%~1.72%,组间重复CV 值为0.08%~0.53%。
利用本研究建立的PiAdV 通用型实时荧光PCR 检测方法与常规PCR 方法,同时对20 份临床疑似PiAdV 感染的样品进行病原学检测,荧光PCR 方法检出8 份阳性样品,而常规PCR 方法仅检出3 份阳性样品。结果提示,本研究所建立的PiAdV 荧光PCR 检测方法比临床上常用的常规PCR 检测方法具有更高的灵敏度,进而具有良好的临床诊断性能。综上所述,本研究建立了一种快速、敏感、特异、准确的PiAdV 通用型实时荧光PCR 检测方法,为PiAdV 感染的早期诊断及综合防控提供了必要的技术支持。
