全自动固相萃取—高效液相色谱法测定现制饮料中7种合成着色剂
2024-05-06姚誉阳
姚誉阳
徐 曼2
潘春燕1
缪 雄3,4
薛 强1
(1. 无锡市疾病预防控制中心〔南京医科大学附属无锡疾病预防控制中心〕,江苏 无锡 214023;2. 新疆克拉玛依市疾病预防控制中心,新疆 克拉玛依 834000;3. 无锡市食品安全检验检测中心,江苏 无锡 214142;4. 国家市场监管技术创新中心〔特殊食品〕,江苏 无锡 214142)
合成着色剂是一类人工合成色素,具有色泽鲜亮、着色力好、价格便宜、化学性质稳定等显著优势,在食品加工过程中被广泛使用,达到改善食品颜色的目的[1-3]。合成着色剂主要是由苯和甲苯为原料合成,对人体存在潜在危害,长期过量摄入,可能会导致生育力降低,幼儿行为过激乃至智力发育异常等[4-7]。虽然中国对合成着色剂使用有严格的限量规定,但是在实际生产过程中,往往存在一定的使用主观性,如鲜榨果蔬汁、奶茶、奶昔和咖啡等现场制作饮料,易造成合成着色剂过量使用的情况[8-10]。
目前,中国针对食品中常用合成着色剂的测定标准有GB 5009.141—2016、GB 5009.35—2016、SN/T 1743—2006等,这些标准采用聚酰胺吸附法或液—液分配法提取,并不具备良好的普适性。其中,赤藓红仅能采用液—液分配法提取。同时,上述标准中的测定方法氨水等有机溶剂使用量大;还需采用抽滤、液—液萃取、水浴蒸发等操作,前处理繁琐,难以应用于批量样品操作。针对以上问题,研究拟采用新型固相萃取柱同时提取现制饮料中7种合成着色剂,同时结合全自动固相萃取仪,优化样品前处理方法和色谱分析条件,以期提高检验检测效率,支撑现制饮料中合成着色剂的快速检测。
1 材料与方法
1.1 材料与试剂
7种合成着色剂标准物质(信息见表1):中国计量科学研究院;

表1 7种合成着色剂信息
乙酸铵、甲酸:色谱级,上海麦克林生化科技股份有限公司;
乙腈、甲醇:色谱纯,赛默飞世尔科技有限公司;
柠檬酸、氨水:分析纯,南京化学试剂股份有限公司;
食品中合成着色剂专用SPE小柱CNW Poly-sery(500 mg/6 mL):上海安谱实验科技有限公司;
Eclipse XDB-C18柱(250 mm×4.6 mm×5 μm):美国安捷伦公司;
试验用水:自制超纯水,电阻率18.2 MΩ·cm;
现制饮料样品:市售。
1.2 主要仪器与设备
高效液相色谱仪—二极管阵列检测器:1200型,美国安捷伦公司;
涡旋振荡器:DMT-2500型,常州白塔新宝仪器厂;
全自动固相萃取仪:Extrahera型,瑞典拜态齐公司;
超纯水仪:Milli-Q型,美国密理博公司。
1.3 标准溶液配制
移取7种合成着色剂标准溶液各1 mL,置于10 mL容量瓶中,用纯水稀释至刻度,配制成100 μg/mL的混合标准储备液,置于4 ℃冰箱保存(保存期为1个月)。将上述储备液用纯水逐级稀释成0.5,1.0,5.0,10,20,50 μg/mL的系列标准工作液。
1.4 样品前处理
于15 mL聚丙离心管中称取样品约1 g(精确至0.001 g),加入6 mL纯水,涡旋30 s,超声提取5 min,4 000 r/min离心5 min,上清液转移至另一15 mL离心管中。残渣再加入6 mL纯水,重复操作一次。合并两次上清液。用20%的柠檬酸水溶液调节提取液至pH为3~4。
运用全自动固相萃取仪,在0.12 MPa下,分别用5 mL 甲醇和5 mL纯水对Poly-sery色素专用进行活化,处理时间为150 s,立即在0.05 MPa压力下,将上述全部提取液过柱,并用5 mL甲醇—甲酸—水混合溶液(V甲醇∶V甲酸∶V水=4∶2∶4)清洗小柱并干燥。在0.08 MPa下用3 mL 10%氨水甲醇溶液洗脱两次。收集洗脱液于15 mL离心管中,50 ℃水浴下氮吹浓缩至200 μL左右,用50%的流动相A+50%的流动相B定容至1.0 mL,涡旋混匀。过0.45 μm亲水PTFE针式过滤器,滤液置于进样小瓶中,待测。
1.5 色谱条件
色谱柱:C18柱(250 mm×4.6 mm×5 μm);流动相:20 mmol/L乙酸铵—甲醇;洗脱方式:梯度洗脱;柱温:35 ℃;流速:1 mL/min;进样量:10 μL;检测器:二极管阵列;波长:254,628 nm。梯度洗脱程序见表2,其中A相为甲醇,B相为20 mmol/L乙酸铵溶液。

表2 梯度洗脱程序
1.6 数据处理
采用仪器工作站进行标准曲线拟合及含量计算,Excel 2016进行数据统计,Origin 8.1绘制图谱。
2 结果与讨论
2.1 前处理条件优化
为探究最佳萃取条件,采用单因素法对前处理过程中的影响参数进行优化。取不含7种合成着色剂的现制饮料样品(柠檬汁)进行5 mg/kg加标,所有试验在此加标水平下完成,每个试验平行3次。
2.1.1 提取方式优化 已报道的食品中合成着色剂的提取溶剂有氨水—甲醇[1]、乙醇—氨水—水[11-13]、三正辛胺—正丁醇[11]、甲醇—水[14]、纯水[15]等。研究的基质为现制饮料,合成着色剂在制作过程中绝大部分已溶于水中。因此,优先采用纯水提取。当取样量为1 g时,采用6 mL以上水提取,提取效率已无明显变化。如果部分饮料含有果蔬纤维、蛋白质、脂肪等,一次提取无法完全,这可能是由于离心后残渣较多,部分合成着色剂吸附在残渣上。进一步二次提取后,各合成着色剂回收率均达到90%以上,采用3次提取,回收率无明显变化。试验表明,现制饮料,经过纯水提取两次后,7种合成着色剂均取得满意的提取效果,无须使用任何有机溶剂。故采用6 mL纯水提取两次,每次超声5 min,4 000 r/min离心5 min,合并两次上清液待净化。
2.1.2 提取液pH值优化 现制饮料的pH值大多为5与7,用20%的柠檬酸水溶液或氨水(1+1)调节pH值为2~6,考察了pH值对回收率的影响,结果如图1所示。
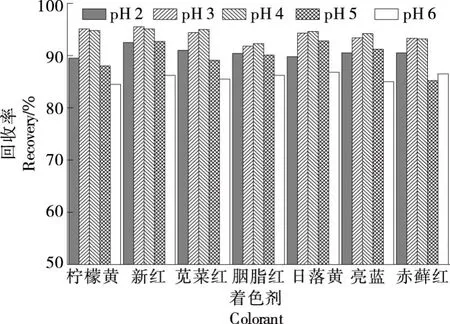
图1 提取液pH对回收率的影响
由图1可知,pH值在3~4时,7种物质的回收率均达到最大,可能是由于合成着色剂在此pH值范围内以单分子的形式存在,保持良好的稳定性,提取过程中损失较小。故后续试验调节提取液pH值为3~4。
2.1.3 淋洗液优化 采用1.4中甲醇—甲酸—水混合溶液淋洗,赤藓红回收率仅为(79.8±3.85)%,其余6种物质回收率均在90%以上,推测可能是除赤藓红外,6种合成着色剂均含有较多的磺酸钠基团,在酸性条件下生成磺酸根,与SPE填料结合很紧密,甲醇/甲酸/水溶液并不能使其分离,故淋洗液可以洗去一些杂质;而赤藓红在酸性条件下生成酚羟基,与填料相互作用不强,在甲醇等有机溶剂的淋洗下,容易溶解在甲醇中随淋洗液流出,故赤藓红回收率低。尝试仅用纯水淋洗,有效降低淋洗液的洗脱强度,赤藓红的回收率提高至(93.4±0.60)%,提取效果满意。因此,当样品中存在赤藓红时,可用纯水淋洗。
2.1.4 洗脱液优化 欲将合成着色剂从固相萃取小柱中洗脱出来,需调节体系为碱性,常用的洗脱液为氨水甲醇溶液。考察了氨水比例对回收率的影响,结果如图2所示。
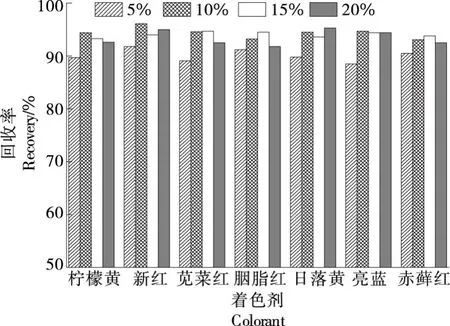
图2 氨水比例对回收率的影响
由图2可知,当氨水比例为10%时,各物质的回收率达到最大,继续提高氨水比例,各物质回收率基本不变,推测可能是10%的氨水甲醇作为洗脱液,使合成着色剂分子与填料作用力减弱从而被有机溶剂洗脱。同时,相对于更高比例的氨水,有效减少了氮吹浓缩时间。故选择10%的氨水甲醇作为洗脱液,用量为3 mL洗脱2次。
2.1.5 复溶试剂优化 尝试采用纯水作为复溶剂,观察到管壁上有很多红色物质残留,反复涡旋后仍难以溶解,上机测定,发现赤藓红回收率低于20%,其他6种合成着
色剂回收率超过90%,推测是赤藓红水溶性差所致。加入一定比例甲醇后,有望明显提升赤藓红回收率。研究表明,用甲醇—水(V甲醇∶V水=1∶1)或甲醇—20 mmol/L乙酸铵(V甲醇∶V乙酸铵=1∶1)溶解,赤藓红回收率在90%以上。因流动相也为甲醇—20 mmol/L乙酸铵溶液,为减小溶剂效应,复溶试剂也采用甲醇—20 mmol/L乙酸铵(V甲醇∶V乙酸铵=1∶1)。
2.1.6 滤膜选择 研究过程中发现,部分滤膜对合成着色剂有吸附作用。为评估滤膜的适用情况,采用20 μg/mL的混合标准溶液直接过滤膜测定,共考察了7种常见的滤膜,结果如表3所示。
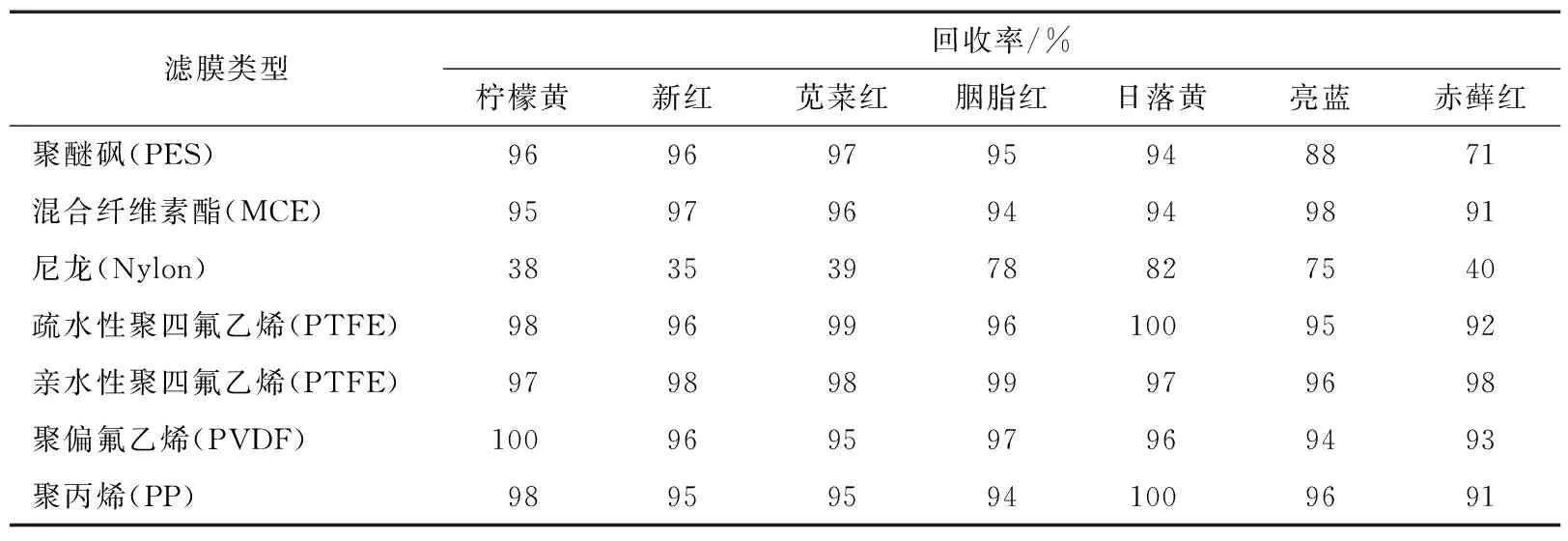
表3 不同滤膜对合成着色剂的吸附作用
由表3可知,尼龙滤膜对各物质均有吸附作用,可能是因为尼龙滤膜由聚酰胺制成,与各种合成着色剂作用明显,应避免使用。此外,除亲水性PTFE滤膜,其他类型的滤膜对赤藓红有不同程度的吸附。综合考虑,采用亲水性PTFE滤膜过滤。
2.2 色谱条件优化
2.2.1 流动相优化 考察了乙酸铵水溶液—甲醇体系和乙酸铵水溶液—乙腈体系对分离效果的影响,结果在两种流动相体系下,各物质均能达到良好的分离效果,且基线均平稳。考虑到甲醇毒性小且价格低廉,故采用乙酸铵水溶液—甲醇体系作为流动相。比较了乙酸铵水溶液含量(0,5,10,20,30,40,50 mmol/L)对分离效果的影响,结果表明,不添加乙酸铵时,某些物质无法被洗脱,且峰形较差,随着乙酸铵含量的提高,待测物的峰型明显改善,峰面积随之升高,当乙酸铵含量超过20 mmol/L时,各物质分离效果均无明显变化,且高浓度的乙酸铵与甲醇混合后易析出,造成色谱柱损坏。故流动相采用甲醇20 mmol/L乙酸铵体系。
由于7种物质极性相差大,故采用梯度洗脱方式。其中柠檬黄与新红结构相似,较难分离,需小心调节流动相比例,最终形成1.5中的色谱条件。标准物质色谱图见图3。
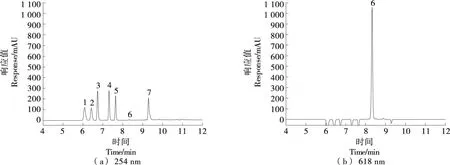
1. 柠檬黄 2. 新红 3. 苋菜红 4. 胭脂红 5. 日落黄 6. 亮蓝 7. 赤藓红
由图3可知,在优化后的条件下,7种合成着色剂在10 min内可完全分离,由于流动相比例变化大,从10 min后恢复初始流动相比例,维持至18 min,各物质保留时间重复性良好。
2.2.2 波长的优化 目前国家标准和文献方法多采用254 nm检测,但是在试验过程中发现254 nm下亮蓝响应值极小[见图3(a)],难以满足检测要求。利用二极管阵列检测器对亮蓝在200~800 nm进行波长扫描,紫外光谱图见图4。

图4 亮蓝的紫外光谱图
由图4可知,亮蓝的特征吸收波长有307,408,628 nm,其中628 nm处响应值远大于254 nm处。图3(b)为628 nm下标准物质色谱图,亮蓝的峰面积由24.8(254 nm)提升至5 596.4(628 nm),增幅超过220倍,同时在628 nm下基线更稳定,杂质干扰更少,这可能是亮蓝在628 nm下发生带边跃迁导致的。故利用二极管阵列检测器同时采集254,628 nm处信号。
2.3 方法学考察
2.3.1 稳定性 取同一5 mg/kg加标样品提取液,于0,2,4,6,8,12,24 h进样,计算柠檬黄、新红、苋菜红、胭脂红、日落黄、亮蓝、赤藓红峰面积的相对标准偏差(RSD),分别为0.64%,0.85%,0.97%,0.83%,1.03%,0.41%,0.47%。可见7种合成着色剂在24 h内非常稳定。
2.3.2 线性参数和检出限、定量限 按1.3的方法配制0.5,1.0,5.0,10,20,50 μg/mL的混合标准溶液系列,按1.5的色谱条件进行测定,得到各物质的线性参数。
测定实际加标样品的噪音值和各物质的信号值,并结合取样量,提取分离过程,将检出限和定量限换算成样品中的质量浓度。其中检出限以3倍信噪比计算,定量限以10倍信噪比计算。如表4所示,7种合成着色剂在0.5~50.0 μg/mL范围内相关系数均大于0.999 9。检出限为0.023~0.179 mg/kg,定量限为0.078~0.598 mg/kg,均低于GB 5009.35—2016中检出限和定量限。
2.3.3 回收率及重复性 结合各物质的测定低限、限量指标以及实际样品中的含量,对现制饮料空白样品进行4个浓度的加标试验,每个浓度平行6次试验。如表5所示,7种合成着色剂回收率为92.4%~96.8%,相对标准偏差(RSD)为1.2%~4.2%。该方法回收率和重复性均较好,适合于现制饮料中7种合成着色剂的测定。

表5 回收率及重复性结果
2.4 实际样品测定
在江苏无锡校园周边的奶茶店、饮料铺等采集现制饮料54件,其中29件检出上述合成着色剂,阳性样品测定结果见表6。由表6可见检出的合成着色剂有柠檬黄、新红、胭脂红和日落黄,含量为0.33~56.93 mg/kg,均未超过GB 2760—2014《食品安全国家标准 食品添加剂使用标准》所规定的限量。其中日落黄的检出率最高(50.0%),其次为胭脂红(9.3%)。从实际检测结果来看,不同产品中合成着色剂的种类和含量均存在显著差异。这可能是现制饮料中的合成着色剂引入方式不明,可能由制作者人为添加或原料引入,且制作过程中主观性强,疏于质量控制。因此,加强现制饮料的安全监管是必要的。
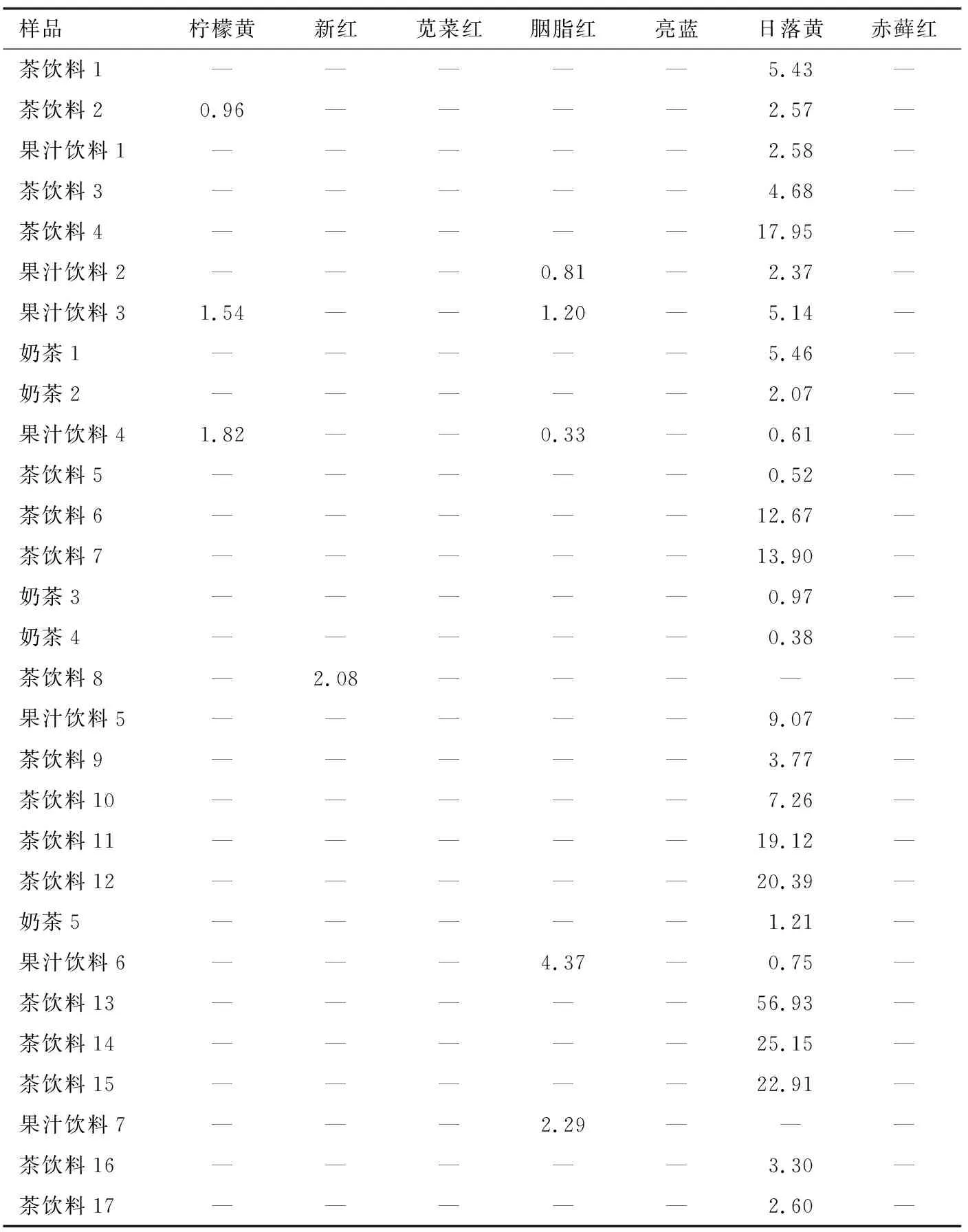
表6 阳性样品测定结果†
图5为阳性样品色谱图,可见该方法净化效果较好,合成着色剂色谱峰未受到杂质干扰。

1. 柠檬黄 2. 胭脂红 3. 日落黄
3 结论
研究建立了全自动固相萃取结合高效液相色谱双波长法测定现制饮料中7种常见合成着色剂的分析方法。该方法结合自动固相萃取仪,优化样品前处理方法,操作简单快速,可实现批量化检测,显著提高检验检测效率;进一步采用双波长法,显著提高了亮蓝的检测灵敏度和抗干扰性,应用于实际样品的测定中,回收率和重复性结果均达到满意。在江苏无锡校园周边采集的54份现制饮料中,有29件检出上述合成着色剂,不同样品中合成着色剂的种类和含量均存在显著差异,可能是现制饮料中合成着色剂的引入方式不明,且制作过程主观性强。因此,加强现制饮料的安全监管是非常必要的。
