NRG-1通过SIRT1-NOX2通路减轻血管紧张素Ⅱ诱导的心肌肥大
2024-05-06王有恒王学惠
王有恒 王学惠
高血压是心血管疾病的诱因之一,且高血压发生率逐年升高[1]。多项研究表明,长期高血压可通过心肌细胞氧化应激、心肌纤维化引起心肌肥大,最终导致心力衰竭[2]。血管紧张素Ⅱ (angiotensin-Ⅱ, Ang-Ⅱ) 是哺乳动物体内重要的血压及体液调节激素,是肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone,RAAS)的关键效应分子[3]。长期的Ang-Ⅱ水平升高导致心肌肥大、氧化应激、纤维化等,促进心力衰竭发生,并激活多种参与心肌肥大的信号分子,包括沉默信息调节因子(silent information regulator,SIRT1)通路、丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK) 信号通路等[2,4,5]。过量的Ang-Ⅱ可导致心肌细胞中活性氧(reactive oxygen species,ROS)的产生同时增加心肌细胞氧化应激水平,抑制SIRT1通路[6]。
神经调节蛋白1(neuregulin 1,NRG-1)是一种从内皮细胞释放的心脏活性因子,对心脏发育、结构和心脏功能完整性是不可或缺的[7]。研究表明,NRG-1通过促进扩张型心肌病心肌血管生成来缓解糖尿病或冠状动脉疾病血管生成反应受损[8]。但是,目前NRG-1对Ang-Ⅱ所诱导的心肌肥大研究较少,且具体机制尚未完全阐明。基于以上背景,本研究通过Ang-Ⅱ诱导H9C2细胞肥大模型,观察NRG-1处理后对心肌肥大的影响,并探索其作用机制,为NRG-1的临床应用提供实验依据。
材料与方法
1.药物、试剂与仪器:NRG-1购自以色列ProSpec-Tany TechnoGene公司(货号:CYT-407),用高压灭菌后的纯水稀释成浓度为10μmol/L的母液,分装至EP管中,-80℃冰箱冻存备用。Ang-Ⅱ购自郑州远东生物科技有限公司,使用纯水稀释成10mmol/L母液,分装至EP管中,-80℃冰箱冻存备用。GAPDH蛋白抗体购自美国Proteintech 公司;心房钠尿肽(atrial natriuretic peptide,ANP)、脑钠肽(brain natriuretic peptide,BNP)、超氧化物歧化酶1(superoxide dismutase 1,SOD1)、SIRT1、NADPH氧化酶2(NADPH oxidase isoform,NOX2)蛋白抗体购自万类生物公司;线粒体膜电位试剂盒、鬼笔环肽染色试剂盒、活性氧检测试剂盒、BCA蛋白定量试剂盒均购自上海碧云天生物有限公司;1%青霉素/链霉素、10%胎牛血清、DMEM培养基购自美国Science Cell公司。CO2培养箱购自美国 Thermo 公司;低速离心机购自美国Thermo 公司;酶标仪购自美谷分子仪器有限公司;光学相差显微镜购自日本Nikon 公司;恒温孵育箱购自中国常州国华有限公司、电子天平、-80℃冰箱购自美国Thermo Forma公司;电泳系统(BIO-RAD)、摇床购自中国其林贝尔仪器制造公司;超净工作台购自中国苏州净化公司;化学发光荧光成像系统 Amersham Imager 600购自美国 GE 公司。
2.细胞系和细胞培养:大鼠心肌细胞系H9C2购自中国科学院细胞库(上海)(ATCC编号: CRL-1446)。细胞用10%胎牛血清及1%青霉素/链霉素的DMEM培养基培养。培养条件,37℃、5%的CO2。使用胰蛋白酶进行消化传代,细胞传代3次后进行实验,接种于细胞培养板中,当细胞密度长至70%左右加入1μmol/L Ang-Ⅱ继续培养24h来诱导细胞肥大。
3.CCK-8 试剂盒检测 H9C2 细胞活力:将H9C2细胞接种于96孔板中,每孔接种7000个细胞,孵育24h,加入不同浓度的Ang-Ⅱ(0、0.25、0.5、0.75、1、1.25μmol/L)及NRG-1(0、5、10、15、20、25nmol/L)进行处理,每个浓度设置6个复孔,继续培养24h,随后加入100μl培养基洗涤2~3遍,加入10μl的CCK-8试剂,继续孵育4h,用酶标仪检测450nm处的吸光度并进行统计学分析,实验重复3次。
4.H9C2 细胞骨架染色:将细胞接种于6孔板中,待使用不用药物处理后,使用PBS配制3.7%甲醛(避免使用含有甲醇的甲醛)溶液室温固定细胞约10~20min。使用1% Triton X-100的PBS洗涤2~4次,每次5min。然后使用含有5%BSA和0.1% Triton X-100的PBS按照1∶100的比例稀释鬼笔环肽母液即为工作液,每孔中加入1ml工作液,室温避光孵育30~60min,使用0.1% Triton X-100的PBS洗涤2~4次,每次5min,随后荧光显微镜进行观察并拍照。使用Image-J软件进行分析并计算细胞表面积。每组测量30个细胞进行测量取平均值。
5.检测ROS含量:使用无血清培养基稀释DCFH-DA母液(10mmol/L)至终浓度(10μmol/L)作为工作液。PBS洗涤分别使用不同药物处理过的细胞,加入DCFH-DA工作液1ml,放入培养箱中继续孵育20min,然后使用无血清养基洗涤细胞3遍,使用荧光显微镜观察并拍照,使用Image-J软件进行荧光强度测定。
6.JC-1检测细胞线粒体膜电位:将细胞接种于6孔板中,配置JC-1工作液:将母液(×200)加入JC-1缓冲液中稀释200倍配置成为工作液待用。PBS洗涤分别使用不同药物处理过的细胞,加入JC-1工作液1ml,放入培养箱中继续孵育20min,然后使用无血清养基进行洗涤,用荧光显微镜观察并拍照,使用Image-J软件进行荧光强度测定。
7.Western blot法检测细胞中ANP、BNP、SOD1、SIRT1、NOX2蛋白表达:将接种于6孔板中给予相应处理后的细胞,使用PBS冲洗2遍,加入裂解液,使用超声裂解仪裂解4次,100℃煮蛋白10min使蛋白变性后,冷却至室温,离心2min,置于-80℃冰箱中备用。BCA 法测定蛋白浓度。根据蛋白浓度调整上样量后进行电泳。电泳结束后行湿法转膜,按照1∶1000比例配置相应抗体后,一抗孵育过夜后,使用TBST洗膜3遍,孵育二抗1.0~1.5h,再次用 TBST 洗涤 3 次,配置显色液曝光。Image-J 软件分析其灰度值,以目标蛋白条带灰度值/内参(GAPDH)灰度值表示相应目的蛋白。

结 果
1.Ang-Ⅱ及NRG-1对H9C2细胞活力的影响:将H9C2细胞接种于96孔板中,加入不同浓度的Ang-Ⅱ进行处理24h,检测H9C2细胞活性。结果显示,与空白组比较,随着Ang-Ⅱ浓度升高,细胞活力先升高后降低。在1μmol/L Ang-Ⅱ处理细胞时活力接近正常水平,选取1μmol/L为实验浓度,并验证其对细胞表面积的影响。同时测定不同浓度NRG-1对细胞活力的影响,发现25nmol/L NRG-1对细胞具有损伤作用,选取20nmol/L为实验浓度进行后续实验(图1)。
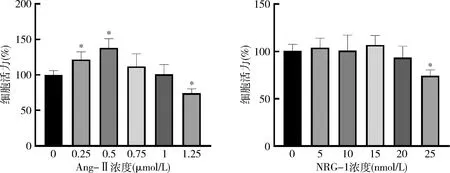
图1 Ang-Ⅱ与NRG-1处理H9C2细胞后检测其细胞活力
2.NRG-1对H9C2细胞表面积的影响:经Ang-Ⅱ(1μmol/L)处理24h后,检测H9C2细胞面积。与空白组比较,模型组细胞表面积明显增加(P<0.05),使用浓度为20nmol/L的NRG-1预处理后,可改善Ang-Ⅱ引起的心肌细胞表面积增加, 经过NRG-1处理的Ang-Ⅱ+NRG-1组vs模型组细胞面积为(860.0±101.4μm2vs 1335.6±165.5μm2,图2)。
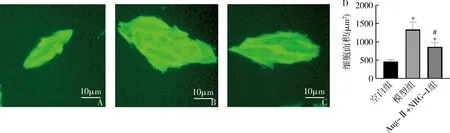
图2 NRG-1对Ang-Ⅱ处理后的H9C2细胞表面积的影响(×400)
3.NRG-1对Ang-Ⅱ诱导的H9C2细胞肥大标志物的影响:经Ang-Ⅱ(1μmol/L)处理24h后,检测ANP、BNP肥大相关蛋白表达。与空白组比较,模型组ANP、BNP表达增加(P<0.05)。NRG-1(20nmol/L)可以抑制Ang-Ⅱ诱导的ANP、BNP蛋白表达(P<0.05),NRG-1能够有效地抑制Ang-Ⅱ诱发的心肌肥大(图3)。
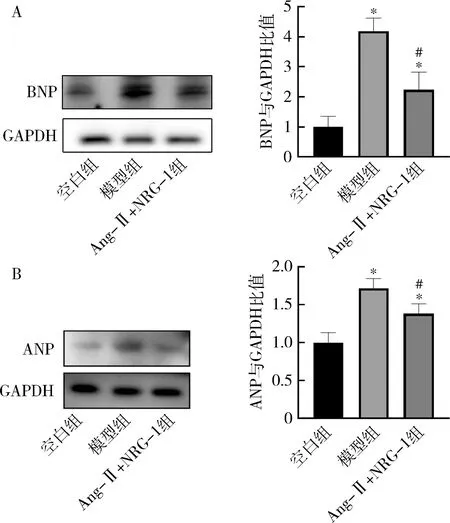
图3 NRG-1对Ang-Ⅱ诱导的H9C2细胞肥大标志物表达的影响
4.NRG-1对Ang-Ⅱ诱导的H9C2细胞线粒体膜电位的影响:经Ang-Ⅱ(1μmol/L)处理24h后,检测H9C2细胞线粒体膜电位水平。与空白组比较,
模型组可检测到线粒体膜电位的下降(P<0.05),而使用NRG-1(20nmol/L)处理后,Ang-Ⅱ所诱导的线粒体膜电位下降明显逆转(P<0.05,图4)。

图4 NRG-1对Ang-Ⅱ诱导的H9C2细胞线粒体膜电位的影响(×40)
5.NRG-1对Ang-Ⅱ诱导的H9C2细胞ROS的影响:经Ang-Ⅱ(1μmol/L)处理24h后,检测H9C2细胞内ROS水平。模型组较空白组ROS含量增加(P<0.05),与模型组比较,NRG-1(20nmol/L)组ROS含量较Ang-Ⅱ组明显下降(P<0.05,图5)。

图5 NRG-1对Ang-Ⅱ诱导的心肌细胞内ROS表达的影响(×10)
6.NRG-1对Ang-Ⅱ诱导的H9C2细胞氧化应激的影响:经Ang-Ⅱ(1μmol/L)处理24h后,检测NOX2和SOD1氧化应激相关蛋白的表达水平。NOX2是常见的产生ROS的蛋白,而SOD1是常见的抗氧化蛋白。与对照组比较,模型组NOX2明显增加,SOD1显著降低,而使用NRG-1预处理后可显著抑制NOX2的表达,同时促进抗氧化蛋白SOD1的表达(图6)。
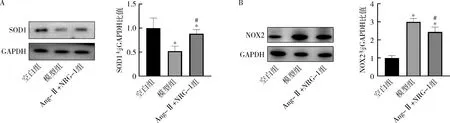
图6 NRG-1对Ang-Ⅱ诱导的H9C2细胞氧化应激水平的影响
7.NRG-1对H9C2细胞SIRT1蛋白表达的影响:经Ang-Ⅱ不同浓度(1μmol/L和2μmol/L)处理后,SIRT1表达显著下降(P<0.05),但不同浓度Ang-Ⅱ之间处理后SIRT1水平比较,差异无统计学意义(P>0.05)。同时经Ang-Ⅱ(1μmol/L)处理24h后,检测SIRT1蛋白表达水平,显示在Ang-Ⅱ处理后,SIRT1蛋白表达下降(P<0.05),然而NRG-1(20nmol/L)预处理后, SIRT1蛋白表达较模型组增加(P<0.05,图7)。
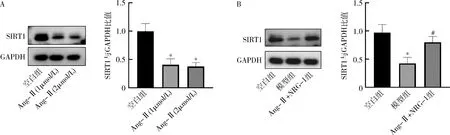
图7 NRG-1对Ang-Ⅱ诱导的H9C2细胞SIRT1蛋白水平的影响
8.SIRT1抑制剂对H9C2细胞NOX2蛋白表达的影响:为进一步验证NRG-1的保护机制,使用SIRT1抑制剂(EX527)处理H9C2细胞24h,监测H9C2细胞中SIRT1表达显著下调(P<0.05)。同时验证了通路相关蛋白NOX2表达,在EX527存在的情况下,NOX2蛋白表达显著增加(P<0.05,图8)。

图8 SIRT1抑制剂EX527对SIRT1及NOX2蛋白表达的影响
讨 论
多种心脏疾病如高血压、冠心病、心脏瓣膜病等都可引起心肌肥大,最终导致心力衰竭。病理性心肌肥大是心力衰竭的机制之一[2]。因此,研究心肌肥大的潜在机制对预防心力衰竭具有重要意义。Ang-Ⅱ属于RAAS系统,是心脏重塑和心血管疾病的关键介质。生理浓度的Ang-Ⅱ对心血管系统是有益的,但是Ang-Ⅱ过度分泌引起的心肌纤维化和肥大是导致心脏重构的主要因素[9]。Ang-Ⅱ可以作用于心肌细胞,导致ANP、BNP水平增加。该指标已被认为可以反映心肌肥大程度及心室收缩和舒张功能情况。本研究使用Ang-Ⅱ处理H9C2细胞,构建心肌细胞肥大模型,探究NRG-1是否改善心肌肥大并探讨其潜在机制。
研究表明,氧化应激是心肌肥大病理过程中的关键环节[10]。氧化应激是氧化与抗氧化系统之间失衡的结果[11]。心血管系统中,ROS主要来源于线粒体,线粒体功能下降会导致ROS 产生过多,增加氧化应激水平[12]。NADPH氧化酶与ROS生成密切相关[13]。NOX2在ROS的生成中起到电子供体的作用[14]。Ang-Ⅱ可以增加NOX2表达,损伤线粒体功能[15]。研究表明,NOX2可加重高脂饮食诱导的小鼠心肌肥厚,其机制是通过增加ROS的产生,降低氧化应激水平,然而在NOX2基因敲除小鼠中,高脂饮食诱导的小鼠心肌肥厚显著减轻[16]。
SOD1可以与锌和铜离子结合,是体内负责破坏自由基的三种超氧化物歧化酶之一。作为体内一种重要的抗氧化物质,其可以清除体内的ROS[17]。研究表明,在Ang-Ⅱ所诱导的心肌肥大过程中,SOD1被逐渐消耗,导致ROS 水平增加,引起心肌细胞损伤[18]。炎症在心肌肥大中同样起着至关重要的作用。NLRP3是炎症通路中的关键介质之一。ROS在整个NLRP3炎性小体激活过程中是不可或缺的。ROS可以调节NLRP3的启动环节,进而减少白细胞介素(interleukin,IL)-1β和IL-18的产生,减少炎性反应[4]。因此,抑制ROS水平,可以从多方面抑制心肌肥大。
sirtuins是Ⅲ类组蛋白去乙酰基酶,已在人类中发现了7种Sirtuins亚型,即SIRT1、SIRT2、SIRT3、SIRT4、SIRT5、SIRT6和SIRT7。其中SIRT1研究得最多,它也被称为核蛋白[19]。SIRT1参与ROS的产生与消耗,其机制是通过调节NOX2、SOD1在内产生和消耗ROS有关的酶[20,21]。因此,调节SIRT1的水平可能成为治疗心肌肥大的新靶点[22]。
NRG-1是一种内皮细胞释放的心脏活性因子,对心脏发育、结构和功能是不可或缺的[23],但其改善心肌重构的具体分子机制尚未完全阐明。本实验中应用Ang-Ⅱ诱导心肌细胞肥大,设置空白组、模型组、治疗组测定心肌细胞表面积、线粒体膜电位水平、ROS水平及ANP、BNP、SIRT1、SOD1、NOX2蛋白表达,进而探讨NRG-1抑制心肌肥大的作用机制。Ang-Ⅱ诱导的心肌肥大模型中,可以观察到细胞表面积增加,线粒体膜电位下降,ANP、BNP、NOX2表达增加,SIRT1、SOD1表达下降,而NRG-1能够有效缓解Ang-Ⅱ引起的变化,表明NRG-1对Ang-Ⅱ诱导的心肌肥大具有明显的保护作用。而使用EX527处理后,NRG-1改善氧化应激的能力下降,因此,NRG-1抑制Ang-Ⅱ所致的心肌肥大可能部分是通过SIRT1-NOX2通路所实现的。
综上所述,本实验验证了NRG-1抗心肌细胞肥大的作用,同时了发现了SIRT1-NOX2通路可能是NRG-1抗心肌肥大潜在机制之一,但是不能排除NRG-1通过其他非特异性机制改善心肌重构,需要开展进一步研究。
利益冲突声明:所有作者均声明不存在利益冲突。
