lncRNA MEG3调控mTOR介导的自噬在糖尿病心肌病中的作用
2024-05-06郑萤萤朱悦红
章 睿 郑萤萤 朱悦红
糖尿病心肌病(diabetic cardiomyopathy,DCM)一般是指无其他明显病因的糖尿病相关心肌功能障碍[1]。DCM是糖尿病最常见的心血管并发症之一[2]。自噬功能异常是导致DCM心功能异常和心肌重构的重要机制之一[3]。研究表明,自噬与DCM的发生及进展密切相关[4]。长链非编码RNA(long non-coding RNAs,lncRNAs)是一类转录本长度超过200nt的不具备蛋白质编码功能的RNA分子,它在表观遗传调控、转录调控以及转录后调控等层面调控基因的表达及功能[5]。lncRNA MEG3其定位于人类染色体14q32.3,由10个外显子组成,通过可变剪切形成多种lncRNA亚型[6]。研究表明,MEG3可能是抑制自噬水平的重要因素。MEG3可以抑制成神经细胞瘤细胞的增殖、迁移、侵袭和自噬[7]。在肺癌细胞中,MEG3上调显著抑制肺癌细胞的自噬水平,并与化疗抵抗密切相关[8]。但是,MEG3与心肌细胞自噬的关系目前仍不明确。因此,本研究将探讨 lncRNA MEG3调控自噬在DCM中发挥的作用。
材料与方法
1.实验材料:链脲佐菌素(STZ)购自美国Sigma公司;RT-qPCR试剂盒购自日本TaKaRa公司;ECL试剂盒购自美国Protech公司;PVDF 膜购自美国Millipore公司;RIPA裂解液、BCA 蛋白质定量试剂盒、Western blot法一抗、二抗购自英国Abcam公司;ROS试剂盒购自上海碧云天生物技术股份有限公司;CCK-8试剂盒购自上海信裕生物科技有限公司;乳酸脱氢酶试剂盒购自美国Beckman公司;谷胱甘肽-过氧化物酶试剂盒购自南京建成生物工程研究所;DMEM培养基、葡萄糖购自美国Gibco公司;甘露醇购自上海源叶生物科技有限公司。
2.实验动物:6周龄鼠,18~22g的雄性C57BL/6 小鼠由杭州医学院实验动物中心提供,实验动物许可证号:SYXK(浙)2019-0011,饲养于温度约25℃,湿度 55% 的环境下,自由进食、进水。本动物实验方案经过笔者医院实验动物福利伦理委员会审核,符合动物保护、动物福利和伦理原则(伦理学审批号:ZJCLA-IACUC-20120014),符合国家实验动物福利伦理的相关规定。

图2 lncRNA MEG3在DCM小鼠心肌细胞表达上调,抑制细胞自噬,激活mTOR信号通路

图3 lncRNA MEG3在高糖诱导的心肌细胞中上调,抑制细胞自噬

图4 下调lncRNA MEG3恢复高糖诱导的心肌细胞自噬,进而缓解心肌细胞损伤
3.DCM小鼠造模与分组:选取40只C57BL/6小鼠,使用普通饲料适应性喂养1周后,随机分为正常组(10只)和DCM组(30只)。正常组小鼠喂食普通饲料,DCM组喂食高脂饲料,喂食4周后禁食12h,DCM组小鼠采用 100mg/kg剂量的STZ腹腔注射,正常组小鼠腹腔注射等体积柠檬酸-柠檬酸钠缓冲液。5天后尾静脉取血,血糖≥16.7mmol/L则2型糖尿病小鼠造模成功。
4.细胞转染与分组:分离C57BL/6小鼠乳鼠心肌细胞,分为正常组、高糖组、渗透压对照组。正常组和高糖组细胞分别加入低糖(5.5mmol/L)和高糖(33.3mmol/L)DMEM培养基培养48h。为排除渗透压影响,设置渗透压对照组,加入27.5mmol/L甘露醇的5.5mmol/L葡萄糖的DMEM培养基。此外,在心肌细胞生长至对数生长期时, 按Lipofectamine 2000 转染试剂说明书,将浓度为100nmol/L的 si-NC、si-MEG3分别转染至细胞,转染培养48h后,收集心肌细胞进行高糖处理,分别为高糖+si-NC组和高糖+si-MEG3组。
5.心脏超声检测:用超声仪探头在小鼠乳头肌水平位置用 M 型取样线检测,记录并分析小鼠左心室射血分数(left ventricular ejection fraction,LVEF)、左心室短轴缩短率(fractional shortening,FS)、左心室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、左心室收缩末期容积(left ventricular end-systolic volume,LVESV)、左心室舒张期前壁厚度(left ventricular anterior wall thickness at diastole,LVAWd)数据值。
6.Masson染色:取小鼠心脏组织,4%多聚甲醛溶液固定,固定后制做石蜡病理切片,进行Masson染色,显微镜下观察组织纤维化程度。
7.Western blot法检测蛋白表达:RIPA 裂解液提取心肌细胞总蛋白,每孔加入40μg 蛋白样品后进行 SDS-PAGE。采用常规湿转法转膜,PVDF膜用5% 的脱脂牛奶4℃ 封闭过夜。将PVDF膜置于稀释的一抗p62、LC3-Ⅱ、Beclin 1、p-mTOR、mTOR溶液(1∶500)室温孵育 2h,GAPDH蛋白为内参。PBST 洗膜;再将PVDF膜置于稀释的二抗溶液(1∶1000)室温孵育1.5h,PBST 洗膜,ECL化学发光显色剂显色并曝光成像。
8.RT-qPCR检测lncRNA MEG3相对表达量:TRIzol法提取心肌细胞总RNA,反转录为cDNA进行RT-qPCR检测。以β-actin为内参,使用2-ΔΔCt法计算lncRNA MEG3相对表达水平。反应参数: 95℃ 5min,96℃ 变性30s,55℃ 退火30s,72℃ 延伸20s,35个循环。lncRNA MEG3 上游引物:5′-AGGGAAGCAGAGGTCGCCAAG-3′,下游引物:5′-AGCACAGTGGAGCCAGGAGTC-3′。β-actin上游引物:5′-TATGCTCTCCCTCACGCCATCC-3′,下游引物:5′-GTCACGCACGATTTCCCTCTCAG-3′。
9.CCK-8检测细胞活力:1× 104个/毫升的细胞悬液,按每孔100μl接种于96 孔板中测定细胞活力并设置5个复孔。每孔加入10μl CCK-8试剂,37℃孵育1.5h。在450nm处酶标仪测定吸光度。
10.ELISA检测细胞LDH、ROS及GSH-Px 活性:1×104个/毫升的细胞悬液,按每孔 2ml 接种于 6 孔板中,收集细胞,离心后取上清液,按LDH、ROS、GSH-Px试剂盒说明书进行操作。

结 果
1.DCM小鼠心功能异常:正常组和DCM组小鼠进行心脏超声检测。与正常组比较,DCM 组小鼠左心室功能明显减退,心脏收缩和舒张功能显著下降,LVEF、FS、LVEDV、LVESV 显著降低,LVAWd 显著升高(P均<0.05,图1A和表1)。Masson 染色结果表明,DCM组小鼠左心室胶原沉积增多,心肌纤维化程度增加(图1B)。
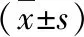
表1 小鼠超声测量结果
2.DCM小鼠心肌细胞中lncRNA MEG3上调,细胞自噬减弱,mTOR信号通路被激活:与正常组比较,lncRNA MEG3在DCM组小鼠心肌组织中表达水平显著上调(图2A)。与正常组比较, DCM组小鼠心肌细胞自噬相关蛋白p62表达量显著升高,LC3-Ⅱ,Beclin 1蛋白表达量显著降低,DCM组小鼠心肌细胞自噬受到抑制(图2B)。同时,p-mTOR蛋白表达水平升高,表明mTOR通路被激活(图2C)。
3.lncRNA MEG3在高糖诱导的心肌细胞中上调,抑制细胞自噬:相较正常组,高糖诱导的心肌细胞活力降低,渗透压对照组无显著变化(图3A)。与正常组比较,高糖组LDH、ROS活性显著升高,渗透压对照组无显著变化;与正常组比较,高糖组GSH-Px活性显著降低,渗透压对照组无显著变化(表2)。与正常组比较,高糖组lncRNA MEG3表达水平显著上调,渗透压对照组lncRNA MEG3表达水平无显著变化(图3B)。与正常组比较,高糖诱导的心肌细胞自噬相关蛋白p62表达量显著升高,LC3-Ⅱ、Beclin 1蛋白表达量显著降低,渗透压对照组无显著变化(图3C),表明高糖诱导的心肌细胞自噬减弱。后续实验采用正常组作为对照。
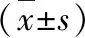
表2 各组细胞LDH、ROS、GSH-Px 活性比较
4.下调lncRNA MEG3恢复高糖诱导的心肌细胞自噬,进而缓解心肌细胞损伤:敲低lncRNA MEG3表达,其表达水平显著降低(图4A)。与正常组比较,高糖诱导的心肌细胞p62表达量显著升高,LC3-Ⅱ降低,Beclin 1蛋白表达量也显著降低;与高糖+si-NC组比较,高糖+si-MEG3组p62表达量显著降低,LC3-Ⅱ和Beclin 1蛋白表达量显著升高(图4B)。与正常组比较,高糖诱导的心肌细胞活力显著降低;与高糖+si-NC组比较,高糖+si-MEG3组细胞活力显著上调(图4C)。与正常组比较,高糖诱导的心肌细胞LDH,ROS活性显著升高;与高糖+si-NC组比较,高糖+si-MEG3组LDH,ROS活性显著降低。与正常组比较,高糖组GSH-Px活性显著降低;与高糖+si-NC组比较,高糖+si-MEG3组GSH-Px活性显著升高(表3)。表明下调lncRNA MEG3后,高糖诱导的心肌细胞自噬得以恢复,心肌细胞损伤被缓解。
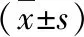
表3 各组细胞LDH、ROS、GSH-Px 活性比较
5.下调lncRNA MEG3通过抑制ERK/mTOR信号通路的激活,恢复高糖诱导的心肌细胞自噬:ERK/mTOR信号通路是调节细胞自噬的通路之一[9]。与正常组比较,高糖诱导的心肌细胞p-mTOR和p-ERK表达量显著升高;与高糖+si-NC组比较,高糖+si-MEG3组p-mTOR和p-ERK表达量显著降低,表明下调lncRNA MEG3,抑制ERK/mTOR信号通路的激活(图5)。
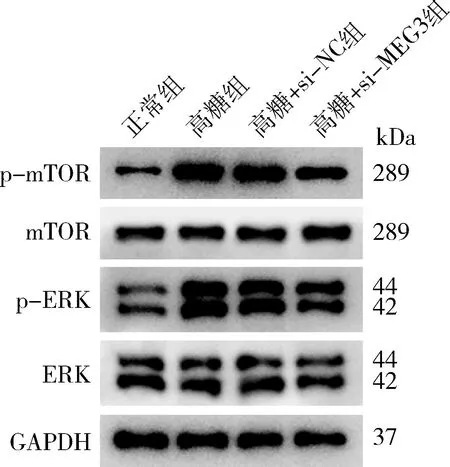
图5 Western blot法检测p-mTOR、mTOR、p-ERK、ERK、GAPDH表达量
讨 论
近年来,lncRNA在DCM中起到重要的调控作用。在STZ诱导的糖尿病小鼠动物模型中,上调lncRNA AK081284通过TGF-β信号通路促进糖尿病心脏组织纤维化[10]。特异性过表达lncRNA H19显著抑制糖尿病小鼠心脏组织氧化应激、炎症及凋亡,改善心脏功能[11]。lncRNA DCFR则通过抑制心肌细胞自噬加剧了DCM的进展[12]。本研究探讨了lncRNA MEG3 对DCM细胞自噬的影响。与之前的研究结果一致,DCM组小鼠心脏舒张收缩功能减弱,胶原沉积增加,心肌细胞自噬减弱[3,13]。同时lncRNA MEG3 在DCM组小鼠心肌组织和高糖诱导的心肌细胞中表达上调,表明lncRNA MEG3可能参与糖尿病心肌细胞自噬调控。
有研究报道,高脂喂食通过激活mTOR1抑制糖尿病小鼠心脏自噬,表现为LC3-Ⅱ表达下调和p62表达上调。心脏组织自噬抑制,加剧了糖尿病小鼠心肌梗死后缺血性损伤[14]。高脂喂食小鼠心脏功能受损,心脏组织中 LC3-Ⅱ和p62表达增高,自噬体数量增加及降解受阻。自噬在2型糖尿病心脏损伤中扮演了重要的角色[15]。Beclin 1调节自噬过程,是自噬体形成增加的重要指标[16, 17]。mTOR信号通路可以调控LC3-Ⅱ/Ⅰ及p62表达变化,抑制自噬[18]。本研究发现在高糖诱导的心肌细胞中下调lncRNA MEG3表达后,p62表达降低,LC3-Ⅱ和Beclin 1表达升高,mTOR激活受到抑制,细胞自噬增强。mTOR是很多上游信号的关键靶基因,可抑制自噬过程。Cao等报道MEG3可直接靶向miR-7-5p调控下游mTOR信号激活,从而调控心脏自噬[19]。
但在已有研究中,lncRNA MEG3对自噬的调控主要为正调控,这种作用已在多种疾病和多种途径中得到验证。下调MEG3可导致高糖诱导的INS-1细胞自噬减少[20]。肺纤维化过程中,下调MEG3激活Hedgehog信号通路,抑制A549细胞的自噬活性[21]。
lncRNA MEG3在心血管疾病中发挥重要作用。Wu等[22]报道在缺氧的心肌细胞中,p53通过直接结合MEG3上游基因来影响其表达。此外,p53可上调MEG3表达促进心肌细胞凋亡。lncRNA MEG3在心肌成纤维细胞中明显富集。MEG3沉默抑制转化生长因子表达,抑制MMP-2的活性,从而降低纤维化标志物的表达[23]。lncRNA MEG3还可正向调节心肌肥厚[24]。
综上所述,本研究发现下调lncRNA MEG3可能通过抑制ERK/mTOR信号通路的激活促进了心肌细胞自噬的发生,进而缓解了高糖诱导的心肌细胞损伤。本研究将为DCM的防治提供重要的理论基础。
利益冲突声明:所有作者均声明不存在利益冲突。
