不同炎症因子对肝硬化腹水并发腹腔感染的预测效能研究*
2024-05-06赵勇娜谢颖
赵勇娜,谢颖
(郑州大学第一附属医院 感染性疾病科二病区,河南 郑州 450000)
肝硬化为一种因肝细胞广泛坏死导致纤维组织发生弥漫性增生而形成的结节、假小叶病变,肝硬化病变会严重损伤患者肝脏正常结构及内部血功能,是多种肝脏疾病病情迁延后的终末阶段[1]。研究指出,肝炎病毒感染所致不同类型慢性病毒性肝炎为导致我国居民发生肝硬化的主要原因,除此之外,其发病还考虑与个人家族遗传或多种代谢性、免疫性疾病密切相关[2]。腹水为肝硬化患者的常见并发症之一,其发生与肝硬化病情进展后,水钠过量潴留引起的门静脉高压及肝功能损伤密切相关。此并发症一般出现在肝硬化失代偿期,若未及时实施积极治疗或会进一步导致患者免疫功能紊乱并诱发腹腔感染[3-4]。既往临床主要通过腹穿刺活检术判定肝硬化腹水患者是否合并腹腔感染,并以此指导临床治疗。但研究指出[5],传统病原学检测方法耗时较长,且由于患者腹腔中存在大量渗出液,其病原学检测结果或存在一定误差。腹腔感染为导致肝硬化腹水患者病情恶化并发生多种不良预后的危险因素,对此症状进行早期预测和识别对改善患者远期预后有重要意义。目前认为,血清炎症因子为反映机体早期炎症反应活跃程度的重要标志物,对预测并诊断机体是否合并感染具有重要意义[6]。本研究将通过回顾性分析观察不同炎症因子对肝硬化腹水并发腹腔感染的预测效能。
1 资料与方法
1.1 一般资料
本文为回顾性研究,病例纳入郑州大学第一附属医院2022年1月至2023年6月收治的118例肝硬化腹水患者,将入组患者分为感染组(48例)和未感染组(70例)。感染组中男30例,女18例;年龄45~75岁,平均(60.33±5.71)岁;肝硬化病程1~4年,平均(2.52±0.31)年;其中25例有肝病家族病史,30例有吸烟饮酒史,27例有长期抗病毒治疗史。未感染组中男46例,女24例;年龄47~73岁,平均(61.25±5.44)岁;肝硬化病程2~3年,平均(2.45±0.47)年;其中30例有肝病家族病史,33例有吸烟饮酒史,25例有长期抗病毒治疗史。两组患者的性别、年龄、肝硬化病程及肝病家族史等一般资料差异无统计学意义(P>0.05),具有可比性。本次研究已获得郑州大学第一附属医院伦理委员会批准(6362)。
纳入标准:①入组患者均符合肝硬化诊断要点,经临床评估确认存在肝腹水[7];②入院时终末期肝病模型(MELD)评分均≥18分[8];③经评估预计生存周期均≥1年;④均知悉此次研究内容,同意获取并公开既往临床资料。
排除标准:①入院时伴急性肝衰竭表现者;②恶性肿瘤者;③入院后接受过肝移植术治疗者;④发病后1年内死亡者;⑤临床资料缺失者。
1.2 方法
根据是否合并腹腔感染,将入组患者分为感染组(48例)和未感染组(70例),收集、对比两组患者的一般资料、临床资料,经统计学单因素分析、Logistic多因素回归分析归纳导致肝硬化腹水患者并发症腹腔感染的危险因素,经Spearman相关性系数检验各炎症因子与肝硬化腹水并发腹腔感染的相关性,通过绘制受试者工作特征(ROC)曲线并观察曲线下面积(AUC)分析各炎症因子对肝硬化腹水并发腹腔感染的预测效能。腹腔感染[9]:继发性细菌性腹膜炎、自发性细菌性腹膜炎、细菌性腹水均可称为肝硬化腹腔感染。
1.3 观察指标
①比较两组患者的一般资料、临床资料:一般资料包括性别、年龄、肝硬化病程、肝病家族病史、吸烟饮酒史及是否长期接受抗病毒治疗等;临床资料包括白细胞介素-6(IL-6)、降钙素原(PCT)、血清淀粉样蛋白A(SAA)等炎症因子以及等T淋巴细胞亚群CD3+、CD4+、CD8+、CD3+/CD4+、CD4+/CD8+免疫指标。②腹腔感染的危险因素分析[10]:由于自变量、因变量间存在非线性关系,本研究将是否发生腹腔感染设为自变量,其余单因素设为因变量,将存在一定差异的单因素纳入Logistic多因素回归分析,当P<0.05时认为该因素为诱导致腹腔感染的危险因素。③各炎症因子与腹腔感染的相关性分析[11]:使用Spearman相关性系数对各炎症因子水平与腹腔感染进行相关性分析,当P<0.05时认为二者有相关性。④各炎症因子对腹腔感染的预测效能[12]:通过绘制ROC曲线验证各血清炎症因子对肝硬化腹水患者并发腹腔感染的预测效能。
1.4 统计学方法
数据均采用软件SPSS 22.0处理。计数资料以百分率(%)表示,用χ2检验;计量资料以均数±标准差()表示,用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 腹腔感染的统计学单因素分析
统计学单因素分析结果显示,感染组的吸烟饮酒史、抗病毒治疗等一般资料以及炎症因子、免疫指标等临床资料与未感染组比较差异有统计学意义(P<0.05),见表1。

表1 腹腔感染的统计学单因素分析 [n(%)]
2.2 腹腔感染的Logistic多因素回归分析
结合单因素分析分析结果,分别对P<0.05的单因素进行赋值,具体赋值情况见表2。
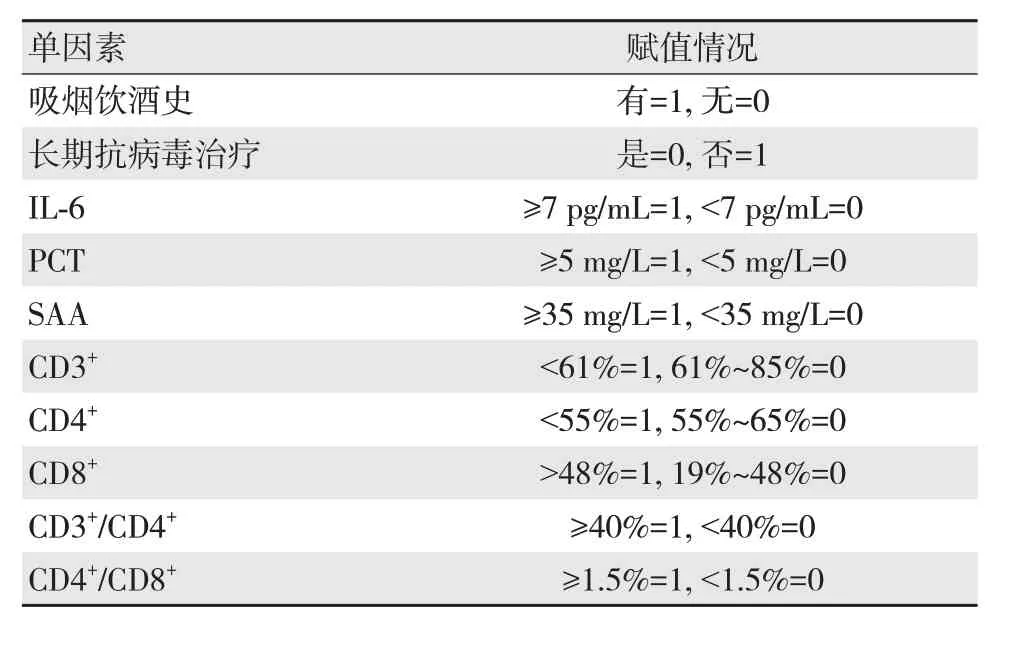
表2 各单因素赋值情况
Logistic多因素回归分析结果显示,长期接受抗病毒治疗、IL-6≥7 pg/mL、PCT≥5 mg/L、SAA≥35 mg/L、CD3+/CD4+≥40%、CD4+/CD8+≥1.5%为导致肝硬化腹水并发腹腔感染的危险因素,见表3。
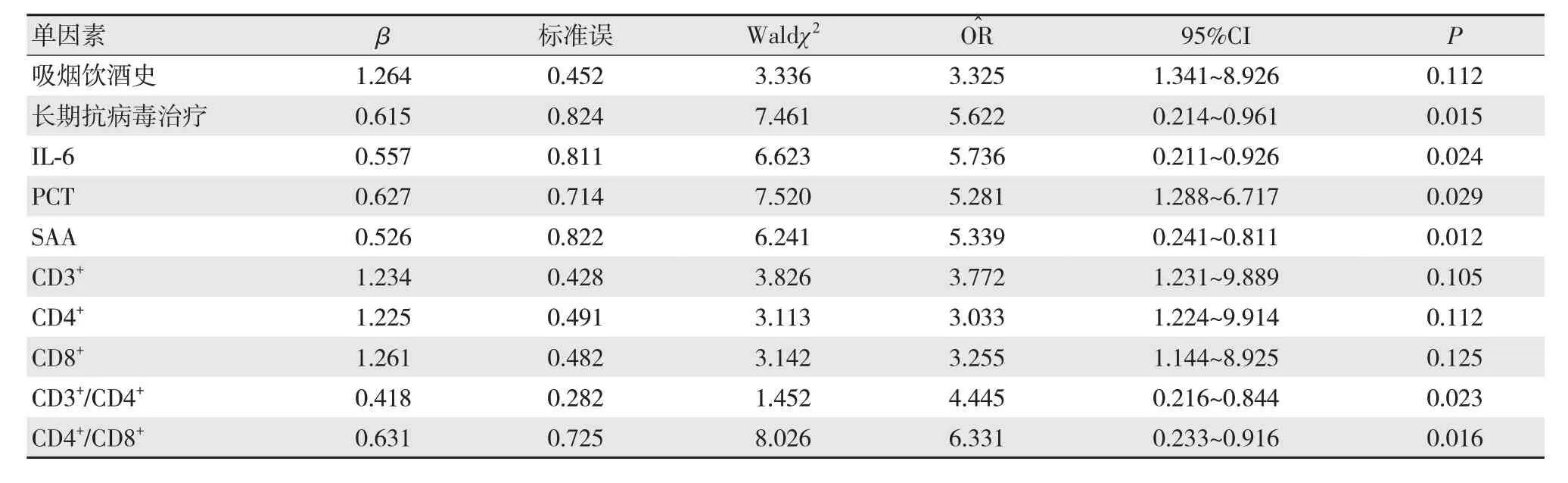
表3 腹腔感染的Logistic多因素回归分析
2.3 各炎症因子与腹腔感染的相关性分析
经Spearman相关性系数检验,IL-6、PCT、SAA等炎症因子与肝硬化腹水的腹腔感染率呈正相关(P<0.05),见表4。
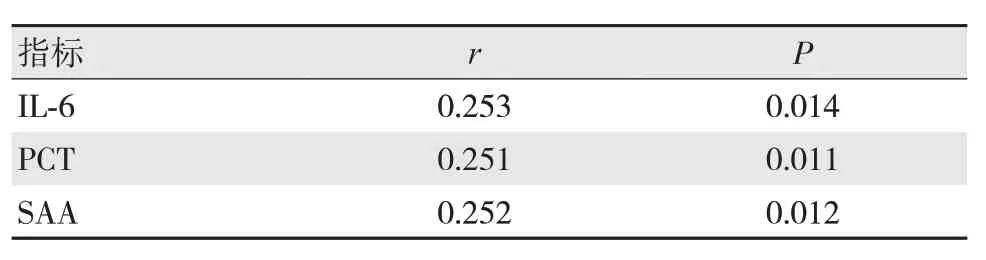
表4 各炎症因子与腹腔感染的相关性分析
2.4 各炎症因子对腹腔感染的预测效能
经ROC曲线验证得知,IL-6、PCT、SAA表达越高,肝硬化腹水并发腹腔感染的风险越高,见表5、图1。
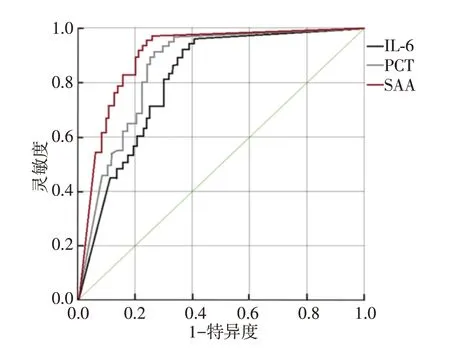
图1 各炎症因子对腹腔感染的预测效能ROC图

表5 各炎症因子对腹腔感染的预测效能
3 讨论
肝硬化为各类肝脏疾病患者的终末阶段,因多种疾病因素长期作用于肝脏,肝硬化患者病情可呈慢性、进行性、弥漫性加重。目前临床主要将肝硬化分为5个时期,其中1~2期为肝硬化代偿期,3~5期为肝硬化失代偿期,不同时期患者的临床特征及症状表现均存在一定差异[13-14]。腹水为肝硬化患者的常见并发症之一,也是诱发细菌性腹膜炎、自发性细菌性腹膜炎及细菌性腹水等多种腹腔感染症状的重要原因[15]。研究表明[16],肝硬化腹水患者1年内的病死率约为15%,而对于合并腹腔感染的肝硬化腹水患者来说,短期内病死率可高达50%。目前临床多通过腹水病原学培养结果实现对腹腔感染的诊断及病情评估,但其检测效率较低,无法充分适应患者的临床需求[17]。检测腹水中的白细胞计数(WBC)也是目前用于鉴别肝硬化患者是否合并腹腔感染的重要手段,但实践表明,腹水患者腹腔内有大量渗出液,因此其WBC检测结果与实际值或会存在较大差异。
此前有相关研究表明,血清炎症因子为反映机体炎症早期活跃程度的重要标志物,其表达水平会随炎症反应加剧而不断升高,目前较为常见的炎症因子主要包括IL-6、PCT以及SAA等[18]。本研究通过统计学单因素分析及Logistic多因素回归分析后结果显示,IL-6≥7 pg/mL、PCT≥5 mg/L、SAA≥35 mg/L、CD3+/CD4+≥40%、CD4+/CD8+≥1.5%为导致肝硬化腹水并发腹腔感染的危险因素,长期接受抗病毒治疗为其保护因素。机体免疫紊乱可导致炎症反应发生,炎症反应加剧会进一步损伤机体免疫系统,二者相互作用、相互影响,因此除炎症因子外,免疫指标也是肝硬化腹水并发腹腔感染的危险因素。抗病毒治疗为缓解病毒性肝炎患者临床症状并促进肝功能恢复的重要手段,研究指出[19],长期接受抗病毒治疗能有效控制患者体内病毒DNA载量,对延缓肝硬化病情进展并降低相关并发症发生风险均有重要意义。除此之外,本研究经Spearman相关性系数验证得知,IL-6、PCT、SAA等炎症因子与肝硬化腹水的腹腔感染率呈正相关(P<0.05),提示上述炎症因子水平越高,肝硬化腹水发生腹腔感染的风险也会逐步升高。IL-6为一种可激活B细胞并增强自然杀伤(NK)细胞对病原菌杀伤能力的炎症因子,其表达水平一般会在机体发生炎症反应且炎症活跃时上升[20]。PCT作为一种降钙素的前肽糖蛋白,也是用于诊断局部感染并评估感染严重程度的重要指标[21]。SAA为一种由肝脏内巨噬细胞及成纤维细胞合成的炎症因子,为早期诊断多种感染性疾病的敏感指标[22]。本研究经ROC曲线验证得知,IL-6、PCT、SAA表达越高,肝硬化腹水并发腹腔感染的风险越高,提示上述炎症因子对肝硬化腹水的腹腔感染症状具有较高诊断效能。张素梅等[23]研究结果显示,与病情好转的肝硬化腹水患者相比,恶化组患者的IL-6、PCT及SAA等炎症因子水平均更高,ROC曲线显示,上述指标对肝硬化腹水患者的腹腔感染及预后均有较高诊断效能,与本研究结果一致。
综上所述,IL-6、PCT、SAA等血清炎症因子及免疫指标均为导致肝硬化腹水并发腹腔感染的危险因素,且各炎症因子指标水平与腹腔感染发生率呈显著正相关,通过早期监测IL-6、PCT、SAA或可实现对腹腔感染的早期识别,上述炎症因子有望成为诊断腹腔感染的血清标志物。
