Sfrp-1通过下调Wnt信号对血管紧张素Ⅱ相关心肌损伤的影响
2024-04-30严宪才李亮吴志光刘锦文冯劲立杨宇琦周耀辉
严宪才 李亮 吴志光 刘锦文 冯劲立 杨宇琦 周耀辉

摘要:目的 觀察分泌型卷曲相关蛋白1(Sfrp1)调控无翼相关整合位点(Wnt)信号通路对血管紧张素Ⅱ(AngⅡ)诱导的体外心肌细胞损伤的影响。方法:体外培养大鼠心肌细胞H9c2,设置空白对照组(control组)、9型腺相关病毒载体组(aav9-Sfrp1组)和无Sfrp1基因组(aav9-NC组);control组仅进行常规培养,aav9-Sfrp1组和aav9-NC细胞分别转染aav9-Sfrp1和aav9-NC后,使用AngⅡ诱导心肌肥大模型。采用细胞计数试剂盒-8检测细胞活性,流式细胞术检测细胞凋亡,免疫荧光对心肌细胞内LC3进行染色,蛋白免疫印迹法检测自噬相关蛋白(Sfrp1、p62、atg5、Beclin1、LC3)和Wnt/β-catenin通路相关蛋白(β-catenin、Dvl-1、Wisp1)表达。结果:aav9-Sfrp1组Sfrp1 mRNA表达水平高于aav9-NC组(P<0.01)。aav9-NC组细胞存活率低于control组,aav9-Sfrp1组细胞存活率高于aav9-NC组(P<0.01)。aav9-NC组细胞凋亡率高于control组,aav9-Sfrp1组细胞凋亡率低于aav9-NC组(P<0.01)。aav9-NC组LC3荧光染色强度低于control组,aav9-Sfrp1组LC3荧光染色强度高于aav9-NC组。aav9-NC组p62、LC3Ⅰ/Ⅱ表达高于control组,atg5、Beclin1表达低于control组(P<0.05);aav9-Sfrp1组p62、LC3Ⅰ/Ⅱ表达低于aav9-NC组,atg5、Beclin1表达高于aav9-NC组(P<0.01)。aav9-NC组β-catenin、Dvl-1和Wisp1表达高于control组(P<0.001),aav9-Sfrp1组β-catenin、Dvl-1和Wisp1表达低于aav9-NC组(P<0.001)。结论:Sfrp1通过抑制Wnt/β-catenin信号通路,诱导细胞自噬,减轻心肌肥大,发挥保护心肌损伤的作用。
关键词 心肌肥大;心肌损伤;分泌型卷曲相关蛋白1;Wnt/β-catenin信号通路;细胞自噬;血管紧张素Ⅱ;实验研究
doi:10.12102/j.issn.1672-1349.2024.05.007
Effect of Sfrp-1 on Angiotensin Ⅱ-related Myocardial Injury by Down-regulating Wnt Signaling
YAN Xiancai, LI Liang, WU Zhiguang, LIU Jinwen, FENG Jinli, YANG Yuqi, ZHOU Yaohui
Zhongshan Hospital of Traditional Chinese Medicine of Guangzhou University of Chinese Medicine, Zhongshan 528400, Guangdong, China, E-mail: yanvec210@yeah.net
Abstract Objective:To observe the effect of secreted frizzled related protein-1(Sfrp1) regulating wingless-related MMTV integration site (Wnt) on angiotensin Ⅱ(AngⅡ)-induced cardiomyocyte injury in vitro.Methods:Rat cardiomyocytes H9c2 were cultured in vitro,and blank control group(control group),type 9 adeno-associated virus vector group(aav9-Sfrp1 group) and non-Sfrp1 gene group(aav9-NC group) were set up.The control group was only cultured routinely,aav9-Sfrp1 group and aav9-NC cells were respectively transfected with aav9-Sfrp1 and aav9-NC cells,and the myocardial hypertrophy model was induced by AngⅡ.Cell activity was detected by cell counting kit 8,cell apoptosis was detected by flow cytometry,LC3 in cardiomyocytes was stained by immunofluorescence.The expression of autophagy associated proteins(Sfrp1,p62,atg5,Beclin1,LC3) and Wnt/β-catenin pathway-associated proteins(β-catenin,Dvl-1,Wisp1) were detected by protein imprinting.Results:The mRNA expression level of Sfrp1 in aav9-Sfrp1 group was higher than that in aav9-NC group(P<0.01).The cell survival rate of aav9-NC group was lower than that of control group,and that of aav9-Sfrp1 group was higher than that of aav9-NC group(P<0.01).The apoptosis rate of aav9-NC group was higher than that of control group,and that of aav9-Sfrp1 group was lower than that of aav9-NC group(P<0.01).The LC3 fluorescence staining intensity of aav9-NC group was lower than that of control group,and the LC3 fluorescence staining intensity of aav9-Sfrp1 group was higher than that of aav9-NC group.The expressions of p62,LC3Ⅰ/Ⅱ in aav9-NC group were higher than those in control group,while the expressions of atg5,Beclin1 in AAV9-NC group were lower than those in control group(P<0.05).The expressions of p62,LC3Ⅰ/Ⅱ in aav9-Sfrp1 group were lower than those in aav9-NC group,and the expressions of atg5,Beclin1 in aav9-NC group were higher than those in AAV9-NC group(P<0.01).The expressions of β-catenin,Dvl-1 and Wisp1 in aav9-NC group were higher than those in control group(P<0.001),and the expressions of β-catenin,Dvl-1 and Wisp1 in aav9-Sfrp1 group were lower than those in aav9-NC group(P<0.001).Conclusion:Sfrp1 could induce the cell autophagy,alleviate myocardial hypertrophy,and protect myocardium injury by inhibiting the expression of Wnt/β-catenin signaling pathway.
Keywords myocardial hypertrophy; myocardial injury; secreted frizzled related protein 1; Wnt/β-catenin signaling pathway; autophagy; angiotensin Ⅱ; experimental study
基金項目 中山市科学技术局2021年第一批社会公益(医疗卫生一般项目)(No.2021B1057)
作者单位 广州中医药大学附属中山中医院(广东中山 528400),E-mail:yanvec210@yeah.net
引用信息 严宪才,李亮,吴志光,等.Sfrp-1通过下调Wnt信号对血管紧张素Ⅱ相关心肌损伤的影响[J].中西医结合心脑血管病杂志,2024,22(5):811-816.
急性心肌梗死是致死率极高的心血管疾病之一,是由冠状动脉急性阻塞、心肌缺血坏死引起的,多发生于45岁以上的中老年人群,若不及时治疗,可使心脏结构和功能受损,进而发展为急性心力衰竭,在短时间内导致死亡[1],严重威胁病人生命安全。现阶段临床多通过再灌注方式进行治疗,可能发生缺血再灌注损伤,影响治疗效果及预后[2]。心肌细胞凋亡是心肌重塑的重要标志,清除凋亡的细胞是治疗心力衰竭的重要过程[3]。随着分子技术的不断发展,细胞凋亡和自噬证实参与了心肌损伤过程,与细胞损伤修复和心功能保护作用有关[4]。无翼相关整合位点(wingless-related MMTV integration site,Wnt)信号通路与心血管疾病有关,参与心肌细胞肥大、主动脉狭窄、动脉粥样硬化等心脏生理病理改变[5]。分泌型卷曲相关蛋白1(secreted frizzled related protein 1,Sfrp1)与Wnt配体竞争性结合负调控Wnt信号通路,与心肌梗死等多种疾病的发生发展有关[6]。既往研究报道,Sfrp1具有较强的促血管新生作用,过表达Sfrp1的骨髓干细胞可抑制心肌梗死区中性粒细胞浸润,拮抗炎症反应,从而抑制心肌缺血损伤[7]。基于此,本研究采用血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)体外诱导大鼠H9c2细胞构建心肌肥大模型,将9型腺相关病毒转染Sfrp-1至H9c2细胞中,探讨Sfrp-1调控Wnt信号通路影响细胞自噬对心肌损伤的影响,为临床治疗心肌肥厚、心肌损伤和心力衰竭提供实验依据,现报道如下。
1 材料与方法
1.1 实验材料
大鼠心肌细胞系H9c2购自中国科学院上海细胞库,将H9c2细胞置于含10%胎牛血清和青霉素链霉素混合物的改良伊格尔培养基(DMEM)37 ℃、5%CO2条件下培养,每日更换新的培养液,当细胞密度达到80%~90%时,以0.25%胰蛋白酶对细胞进行消化后传代。设置空白对照组(control组)、9型腺相关病毒载体组(aav9-Sfrp1组)和无Sfrp1基因组(aav9-NC组),control组仅进行常规培养,aav9-Sfrp1组和aav9-NC组按相关操作构建心肌肥大模型。
1.2 心肌肥大模型的建立
取培养后的对数生长期大鼠H9c2细胞接种于6孔板中,设置每孔细胞密度为5×105个,分别以重组9型腺相关病毒载体(aav9-Sfrp1)、无Sfrp1基因(aav9-NC)转染H9c2细胞,转染复数为6×105(v.g.)/细胞。将病毒液完整覆盖于培养基中的细胞表面,保持37 ℃、5%CO2条件,每隔30 min摇晃培养基,使病毒充分接触细胞。转染5 d后,以10-6 mmol/L AngⅡ刺激H9c2细胞48 h,诱导心肌肥大模型。
1.3 实时荧光定量聚合酶链式反应(real-time quantitative reverse transcription,qRT-PCR)检测H9c2细胞内Sfrp1 mRNA表达
采用TRIzol试剂提取H9c2细胞内的总RNA,之后用PrimeScriptTMRT试剂盒将mRNA逆转录成cDNA,用SYBR GreenPCR试剂进行显色,ABI7500FAST Real-Time PCR仪进行qRT-PCR。采用2-△△Ct方法评估,以GAPDH作为标准化内参校正后Sfrp1 mRNA表达水平。Sfrp1正向引物:5′-ATGCAGTTCTTCGGCTTCTACT-3′;反向引物:5′-CAGCTTCTTCAGCTCCTTCTTC-3′。
1.4 细胞计数试剂盒(cell counting kit-8,CCK8)检测细胞活力
采用CCK8(上海语纯生物科技有限公司)检测各组心肌细胞H9c2的细胞活力,将细胞按每孔1×105个密度接种于96孔板中培养48 h,加入CCK8溶液再次培养2 h,严格按照说明书进行操作,采用酶标仪检测波长450 nm处各组细胞的吸光度值。计算细胞活力,细胞存活率(%)=(试验井平均吸光度)/(对照井平均吸光度)×100%。
1.5 流式细胞术检测细胞凋亡
将各组细胞重悬于缓冲区中,加入膜联蛋白V(Annexin V-FITC)试剂(上海博湖生物科技有限公司)和碘化丙啶(PI)染液(上海如吉生物科技发展有限公司),避光孵育15 min后,采用流式细胞仪(上海三崴医疗设备有限公司)按照试剂盒说明书分析细胞凋亡情况。
1.6 蛋白免疫印迹法检测蛋白表达
将各组细胞加入含有蛋白酶和磷酸酶抑制剂的细胞溶解液中,收集细胞提取物,4 ℃条件下离心15 min,二喹啉甲酸(BCA)蛋白测定试剂盒(福州奥研实验器材有限责任公司)检测蛋白浓度,凝胶电泳分离蛋白质,电转移至膜后室温下封闭,4 ℃条件下,与一抗Sfrp1、p62、atg5、Beclin1、LC3、β-catenin、Dishevelled-1(Dvl-1)、WNT1诱导信号通道蛋白1(Wnt1-inducible signaling pathway protein 1,Wisp1)、β-actin(上海艾博抗贸易有限公司)孵育过夜,室温下与辣根过氧化物酶标记的二抗孵育1 min,采用电化学发光(ECL)试剂(广州济恒医药科技有限公司)显影,Image J软件进行蛋白定量分析。
1.7 免疫荧光分析
将上述处理的各组细胞室温下用4%多聚甲醛固定30 min,用0.4%Triton X-100渗透1 h,37 ℃下以山羊血清阻断1 h,与LC3一抗(上海艾博抗贸易有限公司)和硫氰酸荧光素标记的IgG二抗连续培养,奥林巴斯ckx53荧光显微镜(上海迪圖生物科技有限公司)观察细胞免疫荧光情况。
1.8 统计学处理
采用SPSS 22.0软件进行数据分析,符合正态分布的定量资料以均数±标准差(x±s)表示,两组间比较采用独立样本 t检验,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组Sfrp1 mRNA表达水平比较
aav9-Sfrp1组Sfrp1 mRNA表达水平高于aav9-NC组(P<0.05)。提示转染成功。详见表1、图1。
2.2 各组细胞存活率比较
aav9-NC组细胞存活率低于control组,aav9-Sfrp1组高于aav9-NC组(P<0.01)。详见表2、图2。
2.3 各组细胞凋亡率比较
aav9-NC组细胞凋亡率高于control组,aav9-Sfrp1组低于aav9-NC组(P<0.01)。详见表3、图3及图4。
2.4 各组细胞免疫荧光强度比较
aav9-NC组LC3荧光染色强度低于control组,aav9-Sfrp1组LC3荧光染色强度高于aav9-NC组。详见图5。
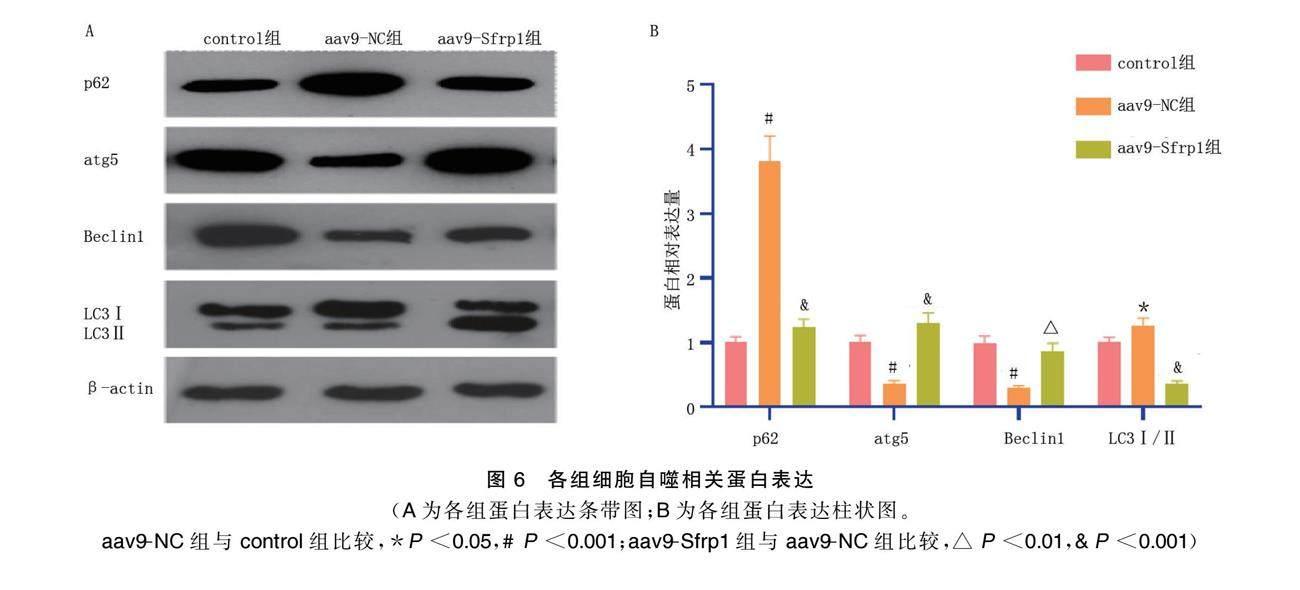
2.5 各组细胞自噬相关蛋白表达比较
aav9-NC组p62、LC3Ⅰ/Ⅱ表达高于control组,atg5、Beclin1表达低于control组(P<0.05);aav9-Sfrp1组p62、LC3Ⅰ/Ⅱ表达低于aav9-NC组,atg5、Beclin1表达高于aav9-NC组(P<0.01)。详见表4、图6。
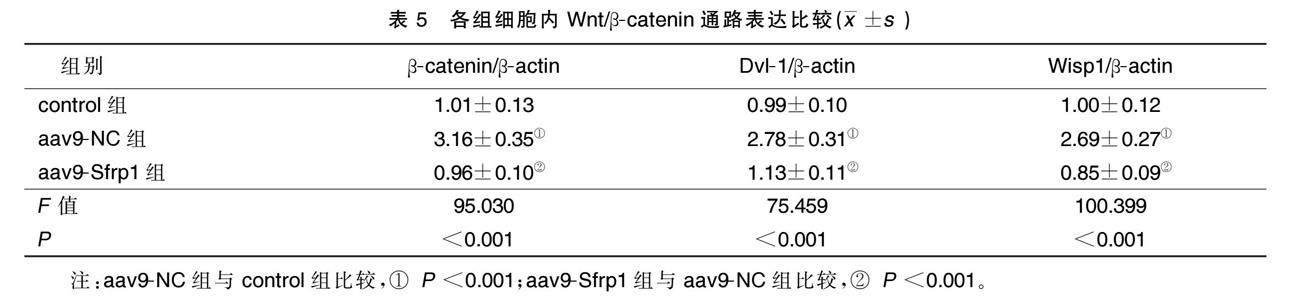
2.6 各组细胞内Wnt/β-catenin通路表达比较
aav9-NC组β-catenin、Dvl-1和Wisp1表达高于control组(P<0.001),aav9-Sfrp1组β-catenin、Dvl-1和Wisp1表达低于aav9-NC组(P<0.001)。提示Sfrp1可抑制Wnt/β-catenin通路活化。详见表5、图7。
3 讨 论
心力衰竭是心肌肥大等心肌损伤疾病的终末期表现,从分子角度分析,细胞凋亡与心肌肥大等心肌损伤密切相关,清除凋亡细胞是心肌肥大水平治疗的重要靶点[8]。AngⅡ是肾素-血管紧张素-醛固酮诱导心肌肥大和心肌细胞凋亡的效应肽,是诱导心肌肥大损伤模型的常用方式,通过刺激细胞间的分子转导、信号通路失活及活化,诱导心肌细胞表型改变[9]。本研究采用AngⅡ诱导大鼠H9c2心肌细胞建立心肌肥大模型,转染aav9-Sfrp1,探讨Sfrp1调控Wnt/β-catenin通路对心肌细胞损伤的影响。
Sfrp1基因是Sfrp分泌糖蛋白家族的一员,在宫颈癌、乳腺癌和非小细胞肺癌等多种肿瘤组织中基因表达缺失[10],通过调控DNA甲基化和microRNA转录导致基因表观遗传沉默,抑制细胞增殖、迁移和侵袭,发挥显著的抑癌作用[11]。有研究显示,Sfrp1在心血管系统中发挥着重要作用,可保护因心肌梗死等造成的心脏损伤[12]。Sklepkiewicz等[13]研究显示,Sfrp1基因敲除小鼠随着年龄增长,心功能逐渐恶化,心肌纤维化水平加剧,可观察到明显的扩张型心肌病特征。本研究结果表明,转染Sfrp1可显著增强AngⅡ诱导的体外心肌细胞增殖活性,抑制细胞凋亡,诱导细胞自噬,发挥显著的保护心肌损伤作用。与Pan等[14]研究结果一致。Sfrp1对心肌细胞的调控作用可能通过影响Wnt/β-catenin信号通路实现的,Sfrp1是Wnt/β-catenin通路的重要抑制剂,Sfrp1通过抑制Wnt/β-catenin通路的活化,抑制α平滑肌肌动蛋白水平、胶原合成能力及心肌纤维化,促进成纤维细胞的激活[15],进而促进正常心肌细胞存活,增强细胞活性,抑制细胞凋亡并影响自噬。
细胞自噬不同于凋亡的代谢过程,通过将细胞质中的物质传送至溶酶体中进行动态分解,清除受损、破裂及癌变的细胞,维持正常细胞和组织的稳态平衡。p62、Beclin1、atg5和LC3是细胞自噬的重要标志物[16]。LC3是由LC3Ⅰ和LC3Ⅱ组成的自噬相关蛋白,细胞自噬发生时,p62表达下调,Beclin1、atg5表达上调,LC3Ⅰ与磷脂酰乙醇胺结合转化为LC3Ⅱ。Wnt/β-catenin通路是调控基因转录、细胞生长、发育及分化的重要信号通路,与心肌肥大、心力衰竭等心血管疾病的发生发展有关[17]。有研究显示,Wnt/β-catenin不仅与细胞增殖、迁移、侵袭和凋亡过程有关,还可激活下游效应分子Dvl-1、Wisp1,参与细胞自噬过程[18]。本研究结果显示,Wnt/β-catenin通路被Sfrp1基因抑制,诱导细胞自噬,促进心肌细胞存活,增强细胞活性,抑制细胞凋亡,在AngⅡ诱导的心肌肥大细胞模型中发挥着保护作用。Tao等[19]研究显示,Wnt/β-catenin通路是老年小鼠心肌梗死的重要靶点,Sfrp1可靶向抑制Wnt/β-catenin通路活化,有效降低心肌纤维化程度,抑制心肌细胞凋亡,改善老年小鼠的心功能,保护心脏免受急性心肌梗死损伤。分析原因,可能与Wnt/β-catenin通路的生物特性有关,Sfrp1与Wnt的配体竞争性结合,导致Wnt/β-catenin通路的信号转导和活化被抑制,下游效应分子Dvl-1、Wisp1的表达显著下调,失活的Wnt/β-catenin通路可抑制血管内皮细胞和血管平滑肌细胞的增殖,增强心肌细胞活性,并通过线粒体凋亡、内质网应激及死亡受体等途径抑制细胞凋亡[20],诱导细胞自噬,从而缓解心肌细胞损伤。
综上所述,Sfrp1通过使Wnt/β-catenin信号通路失活,降低了大鼠心肌细胞H9c2的体外凋亡,促进正常心肌细胞存活,增强细胞活性,诱导细胞自噬,从而发挥保护心肌细胞免受AngⅡ刺激引起的损伤。本研究揭示了Wnt/β-catenin通路在心肌损伤中的重要作用,并提出Sfrp1基因是保护心肌细胞免受AngⅡ诱导造成损伤的关键分子,为心肌梗死等心血管疾病的治疗提供了新的分子靶点和治疗策略。本研究存在一定的局限性,未验证Sfrp1调控Wnt/β-catenin通路是否发挥同样效应,今后需深入探索。
参考文献:
[1] SMIT M,COETZEE A R,LOCHNER A.The pathophysiology of myocardial ischemia and perioperative myocardial infarction[J].Journal of Cardiothoracic and Vascular Anesthesia,2020,34(9):2501-2512.
[2] ROUT A,TANTRY U S,NOVAKOVIC M,et al.Targeted pharmacotherapy for ischemia reperfusion injury in acute myocardial infarction[J].Expert Opinion on Pharmacotherapy,2020,21(15):1851-1865.
[3] HEUSCH G.Myocardial ischaemia-reperfusion injury and cardioprotection in perspective[J].Nature Reviews Cardiology,2020,17(12):773-789.
[4] HAUSENLOY D J,CHILIAN W,CREA F,et al.The coronary circulation in acute myocardial ischaemia/reperfusion injury:a target for cardioprotection[J].Cardiovascular Research,2019,115(7):1143-1155.
[5] LIU Y,NEOGI A,MANI A.The role of Wnt signalling in development of coronary artery disease and its risk factors[J].Open Biology,2020,10(10):200128.
[6] HU Y H,LIU J,LU J,et al.sFRP1 protects H9c2 cardiac myoblasts from doxorubicin-induced apoptosis by inhibiting the Wnt/PCP-JNK pathway[J].Acta Pharmacologica Sinica,2020,41(9):1150-1157.
[7] BARANDON L,CASASSUS F,LEROUX L,et al.Secreted frizzled-related protein-1 improves postinfarction scar formation through a modulation of inflammatory response[J].Arteriosclerosis,Thrombosis,and Vascular Biology,2011,31(11):e80-e87.
[8] LIU F J.LncRNA-P21 suppresses apoptosis of myocardial cells in rats with acute myocardial infarction via regulating Wnt/β-catenin signaling pathway[J].European Review for Medical and Pharmacological Sciences,2020,24(19):10078-10085.
[9] 丁玉紅,姚陡奇,郭秀颖.白藜芦醇抑制血管紧张素Ⅱ诱导的大鼠心肌成纤维细胞分化的作用和机制[J].中国实验诊断学,2020,24(3):504-508.
[10] CHENG L C,CHAO Y J,OVERMAN M J,et al.Increased expression of secreted frizzled related protein 1(SFRP1) predicts ampullary adenocarcinoma recurrence[J].Scientific Reports,2020,10:13255.
[12] 陶静,魏娴,马依彤.Wnt/β-catenin信号通路在Sfrp1抑制乳鼠心肌纤维化中的作用及机制[J].山东医药,2019,59(23):10-13.
[13] SKLEPKIEWICZ P,SHIOMI T,KAUR R,et al.Loss of secreted frizzled-related protein-1 leads to deterioration of cardiac function in mice and plays a role in human cardiomyopathy[J].Circulation Heart Failure,2015,8(2):362-372.
[14] PAN S,ZHAO X J,WANG X,et al.Sfrp1 attenuates TAC-induced cardiac dysfunction by inhibiting Wnt signaling pathway-mediated myocardial apoptosis in mice[J].Lipids in Health and Disease,2018,17(1):202.
[15] 金鑫,郭炳彦,李拥军.AngⅡ诱导大鼠心肌细胞肥大过程中分泌型卷曲相关蛋白5表达上调[J].基础医学与临床,2018,38(1):20-25.
[16] RUNWAL G,STAMATAKOU E,SIDDIQI F H,et al.LC3-positive structures are prominent in autophagy-deficient cells[J].Scientific Reports,2019,9(1):10147.
[17] LI Z K,ZHU S X,LIU Q,et al.Polystyrene microplastics cause cardiac fibrosis by activating Wnt/β-catenin signaling pathway and promoting cardiomyocyte apoptosis in rats[J].Environmental Pollution,2020,265(Pt A):115025.
[18] LORZADEH S,KOHAN L,GHAVAMI S,et al.Autophagy and the Wnt signaling pathway:a focus on Wnt/β-catenin signaling[J].Biochimica et Biophysica Acta Molecular Cell Research,2021,1868(3):118926.
[19] TAO J,WEI X,HUANG Y,et al.Sfrp1 protects against acute myocardial ischemia(AMI) injury in aged mice by inhibiting the Wnt/β-catenin signaling pathway[J].Journal of Cardiothoracic Surgery,2021,16(1):12.
[20] YANG Y Y,ZHAO L,LI N,et al.Estrogen exerts neuroprotective effects in vascular dementia rats by suppressing autophagy and activating the Wnt/β-catenin signaling pathway[J].Neurochemical Research,2020,45(9):2100-2112.
(收稿日期:2022-06-22)
(本文編辑薛妮)
