左旋门冬酰胺酶、培门冬酶对急性淋巴细胞白血病患儿的治疗效果比较
2024-04-29温大科
温大科,徐 旭,张 琳
(无锡市儿童医院小儿内科,江苏 无锡 214000)
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是临床儿科常见的恶性肿瘤疾病,是B淋巴细胞、T淋巴细胞前体或成熟B淋巴细胞异常增殖所致,目前临床对于ALL的临床治疗主要采用化疗、干细胞移植、免疫治疗及分子靶向治疗等[1]。免疫治疗、化疗和分子靶向联合治疗是目前保守治疗中疗效较好的治疗方案,其中免疫治疗、化疗可有效调节淋巴细胞增殖活动[2-3],而左旋门冬酰胺酶、培门冬酶是目前临床常用的治疗药物,其中左旋门冬酰胺酶来源于大肠埃希菌,而培门冬酶是一种聚乙二醇修饰的门冬酰胺酶,两者均可通过降解肿瘤细胞增殖生长必需的左旋门冬酰胺而达到促进肿瘤细胞凋亡的目的[4-5],但目前临床关于左旋门冬酰胺酶、培门冬酶治疗ALL患儿的疗效及副反应优劣尚无统一定论,基于此,本研究分别采用左旋门冬酰胺酶、培门冬酶对ALL患儿进行治疗,对比两者疗效、安全性及对患儿实验室指标的影响,现将结果报道如下。
1 资料与方法
1.1 一般资料
回顾性收集2016年6月~2022年9月无锡市儿童医院收治的所有ALL患儿临床资料,根据治疗用药不同分为:①左旋门冬酰胺组37例,其中男性21例,女性16例;低危16例,中危21例;年龄1岁2月~9岁7月,中位年龄5岁2月,平均(5.63±2.14)岁;②培门冬酶组37例,其中男性24例,女性13例;低危15例,中危22例;年龄1岁1月~9岁10月,中位年龄5岁4月,平均(5.19±2.68)岁。本研究获本院伦理委员会审批(批准号:WXCH2021-09-007),符合《赫尔辛基宣言》[6]相关要求。所有研究对象的监护人均知情同意自愿参与。
1.2 纳排标准
纳入标准:①ALL诊断符合《儿童急性淋巴细胞白血病A诊疗建议(第四次修订)》[7]中的相关标准者;②年龄8岁及以下者;③初诊、初治者;④无精神障碍、语言障碍、听力障碍者;⑤治疗依从性良好者。排除标准:①治疗期间死亡者;②合并其他血液系统疾病者;③合并严重感染性疾病者。
1.3 治疗方法
两组均进行常规基础治疗,注射用盐酸柔红霉素静脉注射,25mg/(m2·d),1次/周;地塞米松磷酸钠注射液,4~6mg/(m2·d),静脉滴注,第8~28天用药,第29~35天逐渐减少药物用量至停药。在此基础上,左旋门冬酰胺酶组采用左旋门冬酰胺酶注射液进行治疗,静脉注射,6 000U/m2,隔日1次,共注射8次。培门冬酶组采用培门冬酶注射液进行治疗,肌肉注射,2 500IU/m2,2周/次,共注射2次。两组均治疗46天。
1.4 观察指标
①临床疗效相关指标:治疗46天后,根据《儿童急性淋巴细胞白血病诊疗建议(第四次修订)》中的相关标准将临床疗效分为完全缓解(患儿骨髓原粒细胞Ⅰ型+Ⅱ型不超过5%,三系造血恢复)、部分缓解(患儿骨髓原粒细胞Ⅰ型+Ⅱ型6%~20%,髓外白血病及三系造血恢复情况有一项未达标)、未缓解(未达到上述标准),总缓解率=完全缓解率+部分缓解率。
②糖脂代谢指标:治疗前和治疗21、46天后、随访3个月后,采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测患者血清胰岛素、C肽、甘油三酯(triglyceride,TG)水平。
③血清细胞因子水平:治疗前和治疗21、46天后,采用ELISA检测患者血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-6(interleukin-6,IL-6)、白介素-8(interleukin-8,IL-8)、白介素-10(interleukin-10,IL-10)、干扰素-γ(interferon-γ,IFN-γ)、铁蛋白(ferritin,SF)水平。
④凝血功能、肝功能:治疗前和治疗21、46天后,采用全自动凝血分析仪对患者凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thrombin time,APTT)进行测定;采用ELISA检测患者血浆纤维蛋白原(fibrinogen,FIB)、血清D-二聚体(D-dimer,D-D)、纤维蛋白原降解产物(fibrinogen degradation product,FDP)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、总胆汁酸(total bile acid,TBil)水平。
⑤不良反应:治疗期间,统计两组急性胰腺炎、肝功能损害、血糖升高、血清淀粉酶升高等不良反应发生情况。
1.5 统计学方法
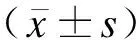
2 结果
2.1 两组临床疗效相关指标比较
治疗46天后,培门冬酶组总有效率与左旋门冬酰胺酶组比较,差异无统计学意义(P>0.05);培门冬酶组总缓解率高于左旋门冬酰胺酶组(P<0.05)。见表1。
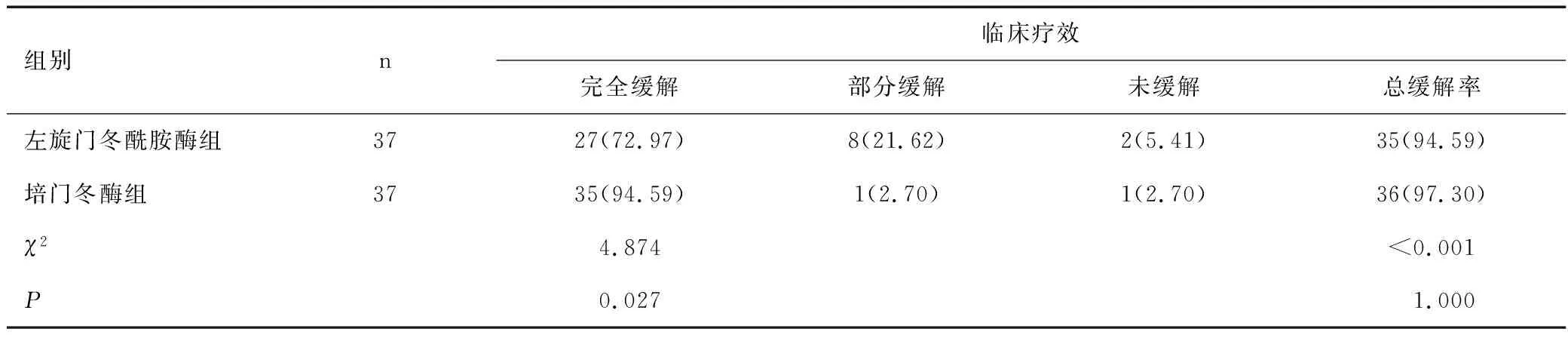
表1 两组临床疗效相关指标比较 [n(%)]Table 1 Comparison of clinical efficacy-related indicators between two groups [n(%)]
2.2 两组糖脂代谢指标比较
治疗前及治疗21天、46天后、随访3个月后,两组血清胰岛素、C肽水平呈降低趋势,不同时间点比较,差异具有统计学意义(P<0.05);治疗21天后,培门冬酶组高于左旋门冬酰胺酶组;治疗46天后、随访3个月后,两组血清TG水平较治疗前、治疗21天后升高,培门冬酶组高于左旋门冬酰胺酶组(P<0.05)。见表2。
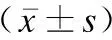
表2 两组糖脂代谢指标比较Table 2 Comparison of glucose and lipid metabolism indicators between two groups
2.3 两组血清细胞因子水平比较
治疗前、治疗21天、46天后,两组血清TNF-α、IL-6、IL-8、IL-10、IFN-γ、SF水平呈先升高后降低趋势,不同时间点比较,差异具有统计学意义;治疗21天后培门冬酶组高于左旋门冬酰胺酶组(P<0.05);治疗46天后,培门冬酶组低于左旋门冬酰胺酶组(P<0.05)。见表3。
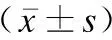
表3 两组血清细胞因子水平比较Table 3 Comparison of serum cytokine levels between two groups
2.4 两组凝血功能、肝功能比较
两组PT、APTT时长呈先升高后降低趋势,培门冬酶组治疗21d后长于左旋门冬酰胺酶组(P<0.05);两组血浆FIB水平呈先降低后升高趋势(P<0.05),培门冬酶组治疗21天后低于左旋门冬酰胺酶组(P<0.05);两组血清D-D、FDP、ALT、TBil水平呈先升高后降低趋势(P<0.05),培门冬酶组治疗21、46天后高于左旋门冬酰胺酶组(P<0.05)。见表4。
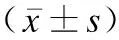
表4 两组凝血功能、肝功能比较Table 4 Comparison of coagulation function and liver function between two groups
2.5 两组不良反应比较
治疗期间,培门冬酶组总不良反应发生率高于左旋门冬酰胺酶组(P<0.05)。见表5。

表5 两组不良反应比较 [n(%)]Table 5 Comparison of adverse effects between two groups [n(%)]
3 讨论
ALL主要发生于9岁以内的儿童,患儿临床主要表现为盗汗、贫血、脸色苍白、低热等,可能出现反复呼吸道感染现象,干细胞移植是治疗ALL最有效的方法,但其配型困难且费用昂贵,因此临床对于ALL患儿通常采取保守治疗措施控制患儿病情,其临床缓解率较高,但治愈率不佳[8-9]。柔红霉素、地塞米松联合的化疗方案可有效杀灭和清除患儿机体恶性增殖细胞,促进骨髓造血功能恢复,但其在快速控制患儿症状和病情方面应用效果不佳,需联合其他药物进行治疗[10-11]。
3.1 左旋门冬酰胺酶、培门冬酶对ALL患儿血清SF水平的改善效果对比
门冬酰胺是ALL患儿恶性增殖肿瘤细胞增殖生殖所必需的物质,但其本身不能合成,只能通过患儿血液获取,因此患儿血液中门冬酰胺消耗完成后肿瘤细胞遗传物质和蛋白质合成受阻可引起肿瘤细胞凋亡[12-13]。左旋门冬酰胺酶和培门冬酶均可特异性水解门冬酰胺,并抑制门冬酰胺的合成,进而促进肿瘤细胞凋亡[14]。本研究结果显示,培门冬酶组治疗46天后完全缓解率高于左旋门冬酰胺酶组,此外本研究结果显示,培门冬酶组治疗46天后血清SF水平低于左旋门冬酰胺酶组,说明与左旋门冬酰胺酶相比,培门冬酶可有效抑制ALL患儿肿瘤细胞增殖,促进其病情缓解。原因在于,左旋门冬酰胺酶是一种异体蛋白,其半衰期仅20小时,同时,左旋门冬酰胺酶具有较强的免疫原性,可诱导机体产生特异性抗体,导致左旋门冬酰胺酶活性降低而影响治疗效果[15]。而培门冬酶不仅保留了左旋门冬酰胺酶的抗肿瘤活性,同时半衰期更长,使得药物作用时间更长,其免疫原性更低,可有效降低机体特异性免疫反应,因而具有更好的作用效果,可有效降低患儿血清SF水平[16-17]。
3.2 左旋门冬酰胺酶、培门冬酶对ALL患儿机体炎症反应及糖脂代谢、凝血功能、肝功能的影响效果对比
ALL患儿在治疗过程中会出现炎性因子释放综合征,机体炎症反应升高,促进其病情进展及不良预后的发生,本研究结果显示,治疗21天后培门冬酶组血清TNF-α、IL-6、IL-8、IL-10、IFN-γ水平高于左旋门冬酰胺酶组,治疗46天后,培门冬酶组血清TNF-α、IL-6、IL-8、IL-10、IFN-γ水平低于左旋门冬酰胺酶组,说明与左旋门冬酰胺酶相比,培门冬酶可快速控制患儿病情,进而降低其机体炎症反应,原因可能与其对ALL患儿病情缓解作用更佳有关。此外,胰岛素、C肽是评估患儿机体糖代谢的指标,TG是评估患儿机体脂代谢情况的指标,FIB、D-D、FDP、PT、APTT是评估凝血功能的指标,ALT是评估肝功能的指标,本研究结果显示,培门冬酶组治疗21天后血清胰岛素、C肽水平高于左旋门冬酰胺酶组,培门冬酶组治疗46天后、随访3个月后血清TG水平高于左旋门冬酰胺酶组,培门冬酶组治疗21天后PT、APTT长于左旋门冬酰胺酶组,培门冬酶组治疗21天后血清FIB水平低于左旋门冬酰胺酶组,培门冬酶组治疗21天、46天后血清D-D、FDP、ALT水平高于左旋门冬酰胺酶组,说明与左旋门冬酰胺酶相比,培门冬酶治疗ALL对患儿机体糖脂代谢、肝功能等相关器官功能及凝血功能的损伤更大,同时培门冬酶组治疗期间总不良反应发生率高于左旋门冬酰胺酶组,说明与左旋门冬酰胺酶相比,培门冬酶治疗ALL安全性相对较差。原因在于,左旋门冬酰胺酶和培门冬酶均可抑制门冬酰胺合成,其对肝、胰岛等合成分泌功能旺盛的器官均可产生损伤作用,可引起机体胰岛素抵抗的发生,对相关的糖脂代谢产生影响,但培门冬酶半衰期是左旋门冬酰胺酶的5倍,同时生物活性也更高,因此其对患儿肝功能、胰岛功能及抗凝血酶、纤维蛋白溶解酶原、纤维蛋白原、凝血因子Ⅸ及凝血因子Ⅺ合成的影响更大[18],且与培门冬酶相比,左旋门冬酰胺酶用药频次相对较多,但每次用药剂量相对较少,因此更加温和,安全性相对较高[19-20]。
综上,与左旋门冬酰胺酶相比,采用培门冬酶治疗对ALL患儿胰岛功能和肝功能、凝血功能影响较大,安全性相对较差,但其在降低患儿机体炎症反应方面应用效果更好,同时疗效更好,临床可根据患儿具体情况选取合适的药物进行治疗。
