琥珀酰化修饰对甘油醛-3-磷酸脱氢酶活性的影响
2024-04-27李晓旭王猛李晶晶马小霞梁文裕王玲霞
李晓旭 王猛 李晶晶 马小霞 梁文裕 王玲霞

摘 要 通过定点突变和生物学分析,研究了赖氨酸琥珀酰化对GAPDH活性的影响。结果表明:发菜GAPDH基因全长为1 014 bp,由338个氨基酸组成,其中K264位点在藻类中高度保守。将K264位点的氨基酸K(AAA)突变为R(AGA),野生型和突变型GAPDH在大肠杆菌中表达,获得一个36.61 ku的外源蛋白。纯化后蛋白活性测定发现,发生琥珀酰化修饰比未发生琥珀酰化修饰的GAPDH(K264)活性显著降低,表明琥珀酰化修饰参与发菜GAPDH活性的调节。研究结果为深入研究发菜GAPDH的分子信息和生物学功能提供理论参考。
关键词 发菜;干旱胁迫;GAPDH;琥珀酰化修饰;定点突变
蛋白质琥珀酰化修饰是一种普遍存在、可逆且高度调控的蛋白质翻译后修饰方式,通过改变蛋白质的结构、稳定性、复合体的形成及酶活性等,参与调控光合作用、糖酵解/糖异生、TCA循环和脂肪酸代谢等多种细胞过程,在植物生长、发育、开花、逆境胁迫及激素信号应答等中起重要的调控作用。近年来,蛋白质琥珀酰化修饰调控机制研究首先是在哺乳动物、细菌等物种中展开。Park等[1]在小鼠细胞中发现,deacylase Sirtuin 5(SIRT5)是细胞和组织中去琥珀酰化修饰的主要酶,SIRT5抑制丙酮酸脱氢酶复合物体(PDC)和琥珀酸脱氢酶(SDH)两个细胞呼吸相关酶活性。另外,研究发现小鼠中的限速生酮酶3-羟基-3-甲基戊二酰辅酶A合酶2 (HMGCS2)的活性受特异性的去琥珀酰化酶SIRT5的调控,HMGCS2作为线粒体中赖氨酸琥珀酰化修饰的调节因子,通过抑制HMGCS2的活性限制酮的生成[2]。在天蓝色链霉菌(Streptomyces coelicolor)中发现一种类似Sirtuin的去琥珀酰化修饰酶ScCobB2,并证明了它在S. coelicolor的多个生物学过程中具有关键的调节作用,主要影响甘油醛-3-磷酸脱氢酶、乌头酸水合酶和几种核糖体蛋白的丰度[3]。此外,TCA循环中的异柠檬酸脱氢酶2 (IDH)被SIRT5去琥珀酰化,以维持细胞NADPH稳态并增强细胞抗氧化防御[4]。这些研究表明,琥珀酰化修饰可能是呼吸作用相关酶活性的重要调节因素。至今植物和蓝藻中有关琥珀酰化修饰调节酶活性的研究报道较少。在植物中,将体外重组表达蛋白(酶)与SIRT5孵育,然后检测对照与处理组的酶活性变化,发现去琥珀酰化修饰酶SIRT5改变了水稻叶片中过氧化氢酶和谷胱甘肽S-转移酶的活性[5]。在蓝藻中,为了评估蛋白质翻译后修饰(丙酰化和丙二酰化修饰)对果糖-1,6二磷酸酶(FbpI)和磷酸甘油酸酯激酶(PGK)活性的影响,对FbpI的K156和PGK的K205进行定点突变,K156和K205的突变导致了FbpI和PGK酶活性显著降低,表明了赖氨酸丙酰化和丙二酰化修饰参与调节FbpI和PGK酶活性[6-7]。但是在蓝藻中目前还没有琥珀酰化修饰调节酶活性的相关报道。
发菜(Nostoc flagelliforme Born. et Flah)是一种主要分布于西北干旱-半干旱荒漠地区的陆生固氮耐旱蓝藻,对干旱具有极强的耐受性,研究发菜耐旱的分子调控机理具有重要意义[8]。GAPDH是细胞质中参与糖酵解的重要酶[9],主要催化依赖于NAD的甘油醛-3-磷酸转化为1,3二磷酸甘油酸,为植物的生长发育提供ATP和细胞代谢所需中间产物。在植物生长过程中,呼吸作用是植物所需能量及体内各种物质之间转换代谢的枢纽,对植物的生长发育尤其是对逆境的适应起重要作用。通过呼吸损失的碳水化合物的比例决定了植物的整体代谢效率[10]。干旱胁迫往往会导致植物的光合作用下降,除非碳消耗同时按比例减少,否则干旱期间光合作用能力下降会导致负碳平衡[11]。有研究报道,干旱胁迫下不同品种金银花和芦苇的呼吸速率下降,即呼吸作用消耗的光合产物减少,以利于碳水化合物代谢平衡,提高植物耐旱性[12-13]。耐旱小麦在土壤严重干旱条件下,通过降低根系呼吸和生物量提高其的生长和生理活性,这也使得在干旱地区耐旱小麦比干旱敏感品种更有优势[14]。值得注意的是,越来越多的证据表明,GAPDH不仅是糖酵解途径的关键酶,而且作为一种多功能蛋白广泛参与生物体内的转录调控、信号转导和 DNA修复等过程,尤其是生物和非生物胁迫显著诱导GAPDH的转录[15]。笔者前期研究发现GAPDH 中的8个位点发生了琥珀酰化修饰,且干旱胁迫下发菜的GAPDH(K169、K264)琥珀酰化修饰水平显著上调(FC>1.5, P<0.05)[16]。但目前为止发菜GAPDH基因的分子信息及是否会通过琥珀酰化修饰改变其酶活性进而响应干旱胁迫尚未明确。因此,本研究从发菜基因组中克隆GAPDH基因,并采用定点突变对发菜琥珀酰化修饰GAPDH的保守性位点进行单一点突变,以验证琥珀酰化修饰对其酶活性的影响,进一步阐释蛋白质琥珀酰化修饰对发菜干旱胁迫的响应 机制。
1 材料与方法
1.1 试验材料
发菜藻丝体于2020年10月13日采自宁夏贺兰山东麓(38.41′N,105.95′E)发菜自然生长地,自来水冲洗后自然风干,贮藏于-80 ℃, 备用。
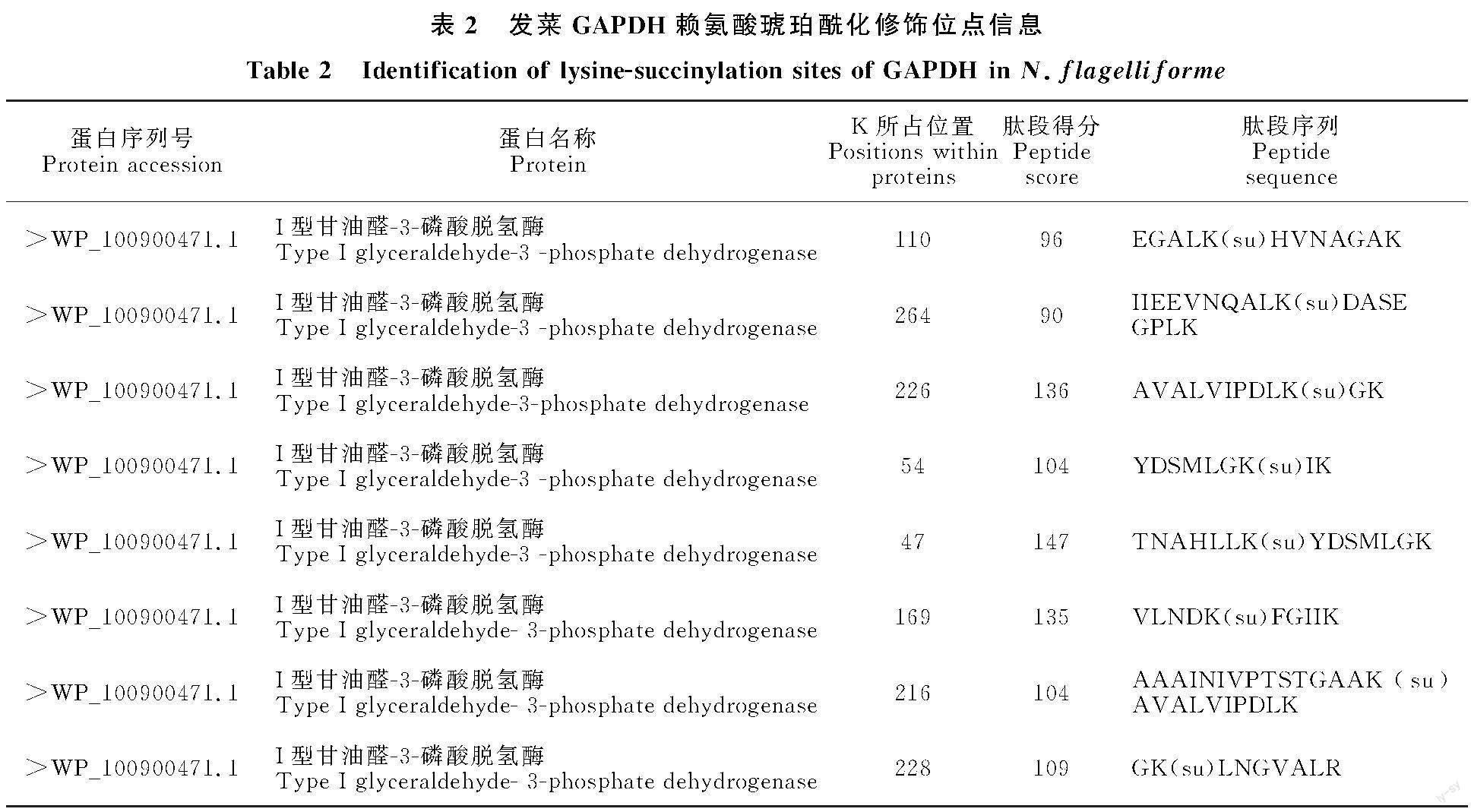
1.2 发菜GAPDH琥珀酰化修饰位点质谱检测及序列分析
发菜GAPDH琥珀酰化修饰位点质谱检测参照Li等[16]的方法。运用NCBI中的BLAST进行序列比對分析。利用SWISS-MODEL预测GAPDH的三级结构。
1.3 发菜野生型GAPDH基因克隆及突变型基因序列的合成
采用CTAB法提取发菜总DNA[17]。根据发菜的GAPDH序列设计特异性引物(表1),扩增条件为94 ℃变性8 min,(94 ℃ 50 s,55.9 ℃ 50 s,72 ℃ 1 min)进行25个循环,72 ℃延伸10 min。扩增产物经1%琼脂糖凝胶电泳后,将回收纯化的目的基因与pMD18-T载体进行连接,然后涂布于Amp筛选的LB固体培养基上培养后进行菌液PCR验证,并对菌液进行测序和BLAST检索比对。对GAPDH琥珀酰化蛋白修饰位点进行序列保守性分析,根据野生型基因的测序结果,将具有保守性且差异表达的琥珀酰化修饰蛋白K位点突变为R[6,18],以保持赖氨酸的电性不变,由上海生工生物合成GAPDH突变型基因序列。
1.4 GAPDH基因原核表达
根据发菜GAPDH的基因测序结果,设计并合成酶切引物(表1)。对含有GAPDH基因的阳性菌液进行PCR扩增,然后使用BamH I和Xho I分别对目的基因与pET28a进行双酶切 1 h。将连接后获得的重组质粒转化至大肠杆菌BL21感受态细胞,最后涂布于Kan筛选的LB固体培养基上,37 ℃过夜倒置培养后挑取阳性克隆子至含Kan的LB液体培养基内培养12 h,进行双酶切鉴定。过夜培养物加入100 mL含Kan的LB液体培养基,37 ℃,180 r/min震荡培养至OD600为0.5~1.0。1 mmol/L的IPTG进行诱导表达GAPDH,最后进行12.5% SDS-PAGE电泳检测,用BeyotimeTM考马斯亮蓝超快染色液(中国,上海)染色1 h,蒸馏水脱色。
1.5 GAPDH原核表达产物的蛋白纯化
取2 mL的磁珠悬液用于蛋白纯化,磁性分离后弃上清,加入5 mL的Binding buffer(20 mmol/ L Phosphate Buffer, 500 mmol/ L NaCl, 5~50 mmol/ L Imidazole, pH 7.4)重复洗涤磁珠3次,弃上清。将验证表达成功的野生型和突变型GAPDH菌液进行扩大培养,4 ℃, 12 000 r/min离心10 min,弃上清,加入10 mL的Binding buffer进行重悬,低温下(冰浴)超声破碎(200 W、15 min),4 ℃,12 000 r/min离心10 min,取上清,加入装有预处理磁珠的离心管中,在4 ℃,100 r/min的摇床上结合2 h,然后进行磁珠洗涤,具体操作步骤参照Beaver BeadsTM His-tag Protein Purification 说明书,最后采用BCA蛋白测定法测定蛋白浓度[19] 。
1.6 GAPDH酶活性检测
按照苏州科铭生物技术有限公司生产的试剂盒(中国,江苏)进行GAPDH活性测定。
2 结果与分析
2.1 发菜GAPDH琥珀酰化修饰位点同源性 比对
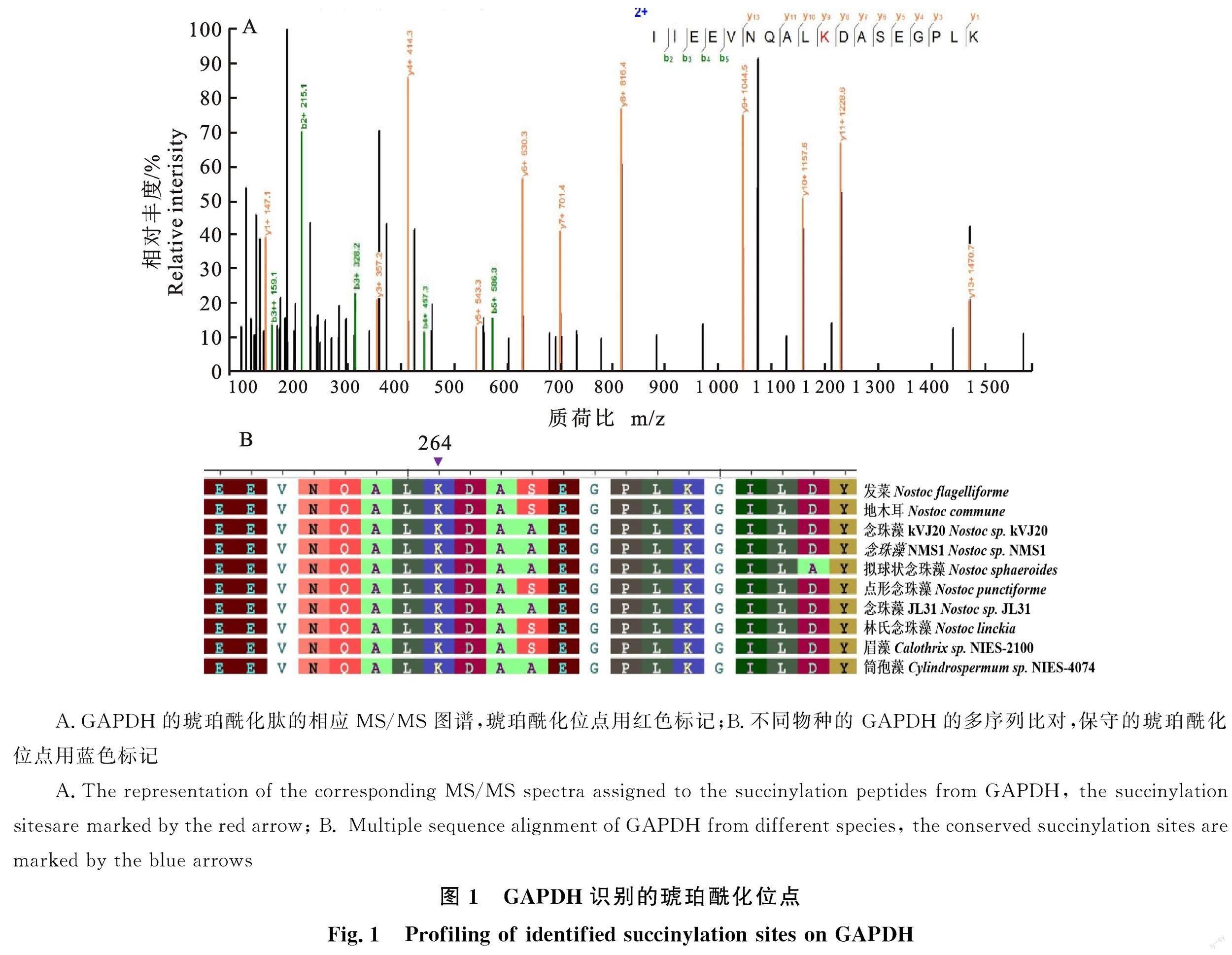
GAPDH是发菜糖酵解途径中的关键酶,催化1,3-二磷酸甘油酸和NADH的形成。笔者前期研究发现在干旱胁迫下,发菜GAPDH中有8个可靠的琥珀酰化修饰位点(K47、54、110、169、216、226、228、264)(表2),且GAPDH(K264)的琥珀酰化修饰发生了显著变化[16],其相应肽段的MS/MS谱见图1-A。多序列比对分析表明,GAPDH的K264位点在藻类中高度保守(图1-B)。通过SMART软件预测,发现GAPDH(K264)位点在C端结构域上。高度保守的K264位于α-螺旋区域(图2)。因此选择GAPDH的K264作为突变位点,进一步分析该琥珀酰化修饰位点是否会影响GAPDH的酶活性。
2.2 发菜GAPDH基因的突变
以发菜DNA为模板,PCR扩增得到1 014 bp的单一条带(图3-A)。Blastn检索比对,GAPDH基因由338个氨基酸组成,其理论分子质量为36.61 ku。将GAPDH的K264位点突变为R,即将该位点的AAA序列突变为AGA序列,通过DNA测序验证表明,该位点突变成功(图3-B)。
2.3 野生型和突变型GAPDH的原核表达
构建GAPDH表达载体pET28a-GAPDH,转化至大肠杆菌,然后进行质粒双酶切验证,分别得到pET28a与GAPDH和GAPDH突变型两条条带,表明表达载体构建成功 (图4)。IPTG诱导后GAPDH野生型和突变体在大肠杆菌BL21中均可以高效表达。[FL)]
2.4 野生型和突变型GAPDH蛋白纯化和酶活性分析
为了进一步检测发菜野生型和突变型GAPDH的活性是否受到琥珀酰化修饰的影响,对诱导表达成功的GAPDH蛋白进行了纯化。SDS-PAGE结果显示,野生型和突变型GAPDH蛋白条带单一且清晰,与预测蛋白分子量大小一致(图5-A)。酶活性检测结果显示,与野生型GAPDH(K264)相比,GAPDH突变型(K264R)的活性显著增加(P <0.05)(图5-B),表明GAPDH(K264R)琥珀酰化修饰会显著影响其酶活性。
3 讨 论
近年来,研究发现GAPDH在多种细胞过程中的新作用,不仅仅作为催化糖酵解的关键酶,而且正在成为许多基本细胞过程的功能和调节的关键成分,特别是GAPDH在植物细胞中一个重要的非催化作用是对各种非生物胁迫的响应,包括盐、干旱、热、冷、厌氧和镉毒性[20-26]。非生物胁迫诱导GAPDH的表达,这可能是植物适应环境变化的自然机制。
笔者前期研究发现参与发菜糖酵解的GAPDH有8个位点发生了琥珀酰化修饰,其中K264位点在发菜响应干旱胁迫过程中发生了显著变化[16]。为了进一步验证GAPDH酶活性是否受琥珀酰化修饰影响进而响应干旱胁迫,笔者对糖酵解的关键酶GAPDH琥珀酰化修饰位点进行分析。本研究通过设计特异性引物克隆获得 1 014 bp的野生型发菜GAPDH全序列。将GAPDH的K264位点的AAA序列突变为AGA序列,获得突变型GAPDH。原核表达得到一个分子量大小约36.61 ku的外源蛋白,且野生型和突变型GAPDH在大肠杆菌BL21中均高效表达。多序列比对分析发现GAPDH的K264位点在藻类中高度保守,且K264琥珀酰化修饰位点在发菜响应干旱胁迫时显著上调,暗示了这个位点在GAPDH进化过程中功能的保守性具有重要的意义。通过位点突变发现K264对R的突变导致GAPDH酶活性显著增加(P<0.05),這表明GAPDH(K264)的琥珀酰化修饰会导致GAPDH的酶活性下降,琥珀酰化修饰可能影响GAPDH酶活性。因为琥珀酰化的赖氨酸基团被赋予2个负电荷,价态从+1变成-1,高于乙酰化(+1到0)和单甲基化(无变化)造成的电荷改变[27],并在赖氨酸上增加了一个琥珀酰基(100 D)[18]。这种结构变化对发生琥珀酰化修饰的蛋白的结构和功能有着更实质性的影响。因此,K264位点的琥珀酰化引起GAPDH构象和酶活性的显著变化,并进一步改变了发菜细胞呼吸作用等代谢过程。呼吸作用决定了植物在长时间干旱下的生存和生产力的快速恢复[28]。植物在干旱胁迫下,体内水分代谢与碳代谢会发生失衡,而植物根系呼吸速率上升,使得ATP合成减少和活性氧增加[11],从而对植物的生长造成伤害。为了维持植物新陈代谢,植物通过呼吸作用的下调,维持碳代谢平衡[29]。因此认为发菜能耐受极端干旱环境且在复水后迅速恢复生理活性[30],其很可能通过降低呼吸速率和减少碳消耗适应干旱。
蛋白质的功能受转录、翻译及蛋白质翻译后修饰等多因素、多水平調节。本研究结果揭示了琥珀酰化修饰对发菜GAPDH活性的调节作用,证实了琥珀酰化修饰能够改变GAPDH的活性,并推测发菜可能由于GAPDH活性下降等原因降低呼吸作用来提高其耐旱性。这一研究发现为今后进一步深入探究发菜GAPDH响应非生物胁迫的重要作用提供了参考。
参考文献 Reference:
[1] PARK J,CHEN Y,TISHKOFF D X,et al.SIRT5-mediated lysine desuccinylation impacts diverse metabolic pathways[J].Molecular Cell,2013,50(6):919-930.
[2]RARDIN M,HE W,NISHIDA Y,et al.SIRT5 regulates the mitochondrial lysine succinylome and metabolic networks[J].Cell Metabolism,2013,18(6):920-933.
[3]ZHANG H,LI P,REN S X,et al.ScCobB2-mediated lysine desuccinylation regulates protein biosynthesis and carbon metabolism in Streptomyces coelicolor[J].Molecular & Cellular Protemics,2019,18(10):2003-2017.
[4]ZHOU L S,WANG F,SUN R Q,et al.SIRT5 promotes IDH2 desuccinylation and G6PD deglutarylation to enhance cellular antioxidant defense[J].EMBO Reports,2016, 17(6):811-822.
[5]ZHOU H,FINKEMEIER I,GUAN W,et al.Oxidative stress-triggered interactions between the succinyl- and acetyl-proteomes of rice leaves[J].Plant,Cell & Environment,2018,41(5):1139-1153.
[6]MA Y Y,YANG M K,LIN X H,et al.Malonylome analysis reveals the involvement of lysine malonylation in metabolism and photosynthesis in cyanobacteria[J].Journal of Proteome Research,2007,16(5):2030-2043.
[7]YANG M K,HUANG H,GE F.Lysine propionylation is a widespread post-translational modification involved in regulation of photosynthesis and metabolism in cyanobacteria[J].International Journal of Molecular Sciences,2019, 20(19):4792.
[8]王 猛,李晓旭,张 筝,等.发菜PspA基因克隆及其转基因植物的抗旱性分析[J].植物遗传资源学报,2021,22(2):224-233.
WANG M,LI X X,ZHANG ZH,et al.Analysis of drought resistance of PspA gene cloning and transgenic plants[J].Journal of Plant Genetic Resources,2021,22(2):224-233.
[9]JAMES T,HARPER,PATRICK J,et al.Keeling.Nucleus-encoded,plastid-targeted glyceraldehyde-3-phosphate dehydrogenase (GAPDH) indicates a single origin for chromalveolate plastids[J].Molecular Biology and Evolution,2003,20(10):1730-1735.
[10] DAVIDSON E A,VERCHOT L V,CATTANIO J H,et al.Effects of soil water content on soil respiration in forests and cattle pastures of eastern Amazonia[J].Biogeochemistry,2000,48(1):53-69.
[11]FAROOQ M,WAHID A,KOBAYASHI N,et al.Plant drought stress:effects,mechanisms and management[J].Agronomy for Sustainable Development,2009,29(1):185-212.
[12]戚志伟,姜 楠,高燕娜,等.崇明岛东滩湿地芦苇光合作用对土壤水盐因子的响应[J].湿地科学,2016,14(4):538-545.
QI ZH W,JIANG N,GAO Y N,et al.Response of reed photosynthesis to soil water and salt factors in dongtan wetland of chongming island[J].Wetland Science,2016,14(4):538-545.
[13]彭素琴,劉郁林.不同品种金银花光合作用对干旱胁迫的响应[J].北方园艺,2016(19):191-193.
PENG S Q,LIU Y L.Photosynthesis of different varieties of honeysuckle in response to drought stress[J].Northern Horticulture,2016(19):191-193.
[14]LIU H S,LI F M.Root respiration,photosynthesis and grain yield of two spring wheat in response to soil drying[J].Plant Growth Regulation,2005,46(3):233-240.
[15]MIRKO Z,SIMONA F,ALEX C,et al.Plant cytoplasmic GAPDH:redox post-translational modifications and moonlighting properties[J].Frontiers in Plant Science,2013,4:450.
[16]LI X X,WANG L X,WANG M,et al.Global analysis of protein succinylation modification of Nostoc flagelliforme in response to dehydration[J].Journal of Proteomics,2021,237:104149.
[17]梁文裕,焦广飞,周有文,等.干旱胁迫条件下发菜Ferritin差异表达与基因克隆[J].植物科学学报,2012, 30(1):75-81.
LIANG W Y,JIAO G F,ZHOU Y W,et al.Differential expression and gene cloning of Nostoc flagelliforme under drought stress[J].Journal of Plant Science,2012, 30(1):75-81.
[18]ZHANG Z H,TAN M J,XIE Z Y,et al.Identification of lysine succinylation as a new post-translational modification[J].Nature Chemical Biology,2011,7(1):58-63.
[19]LI X X,DING M M,WANG M,et al.Proteome profiling reveals changes in energy metabolism,transport and antioxidation during drought stress in Nostoc flagelliforme[J].BMC Plant Biology,2022,22(1):162.
[20]JEONG M J,PARK S C,KWON H B,et al.Isolation and characterization of the gene encoding glyceraldehyde-3-phosphate dehydrogenase[J].Biochemical and Biophysical Research Communications,2000,278(1):192-196.
[21]JIANG Y,YANG B,HARRIS N S,et al.Comparative proteomic analysis of NaCl stress-responsive proteins in Arabidopsis roots[J].Journal of Experimental Botany,2007,58(13):3591-3607.
[22]BAEK D,JIN Y,JEONG J C,et al.Suppression of reactive oxygen species by glyceraldehyde-3-phosphate dehydrogenase[J].Phytochemistry,2008,69(2):333-338.
[23]WAWER I,BUCHOLC M,ASTIER J,et al.Regulation of Nicotiana tabacum osmotic stress-activated protein kinase and its cellular partner GAPDH by nitric oxide in response to salinity[J].Biochemical Journal,2010,429(1):73-83.
[24]GUO L,DEVAIAH S P,NARASIMHAN R,et al.Cytosolic glyceraldehyde-3-phosphate dehydrogenases interact with phospholipase Dδ to transduce hydrogen peroxide signals in the Arabidopsis response to stress[J].Plant Cell,2012,24(5):2200-2212.
[25]KRASENSKY J,JONAK C.Drought,salt,and temperature stress-induced metabolic rearrangements and regulatory networks[J].Journal of Experimental Botany,2012,63(4):1593-1608.
[26]LIM H,HWANG H,KIM T,et al.Transcriptomic analysis of rice plants overexpressing PsGAPDH in response to salinity stress[J].Genes,2021,12(5):641.
[27]YANG Y,GIBSON G E.Succinylation links metabolism to protein functions[J].Neurochemical Research,2019, 44(10):2346-2359.
[28]PINHEIRO C,CHAVES M M.Photosynthesis and drought:can we make metabolic connections from available data? [J].Journal of Experimental Botany,2011, 62(3):869-882.
[29]董 蕾,李吉躍.植物干旱胁迫下水分代谢,碳饥饿与死亡机理[J].生态学报,2013,33(18):5477-5483.
DONG L,LI J Y.Water metabolism,carbon starvation and death mechanism under plant drought stress[J].Acta Ecologica Sinica,2013,33(18):5477-5483
[30]LIU Y H,YU L,KE W T,et al.Photosynthetic recovery of Nostoc flagelliforme (Cyanophyceae) upon rehydration after 2 years and 8 years dry storage[J].Phycologia,2010,49(5):429-437.
Effect of Succinylation Modification on Activity of Glyceraldehyde-3-phosphate Dehydrogenase
Abstract Lysine succinylation,a reversible and widely distributed post-translational modification,is known to play a regulatory role in both eukaryotes and prokaryotes.Our previous study found significant succinylation of GAPDH in Nostoc flagelliforme under drought stress,however,the effect of succinylated modification on GAPDH enzyme activity remains unclear.In this study,we investigated the influence of lysine succinylation on GAPDH activity by site-directed mutagenesis and biological analysis.The results showed that the GAPDH gene of N.flagelliforme was 1 014 bp in length and consisted of 338 amino acids,of which K264 was highly conserved in algae.The amino acid sequence AAA at K264 site was mutated into R (AGA),and wild type and mutant GAPDH of N.flagelliforme were expressed in E.coli to obtain a 36.61 ku foreign protein.The activity of GAPDH (K264) with succinylation modification after purification was significantly lower than that of GAPDH without the modification,indicating that succinylation modification was involved in the regulation of GAPDH activity in N.flagelliforme.These results confirm that the succinylation modification of GAPDH is an regulation mechanism in response to drought stress of N.flagelliforme,which provide a theoretical basis for further research on the molecular information and biological functions of GAPDH in N.flagelliforme.
Key words Nostoc flagelliforme;Drought stress;GAPDH;Succinylation; Site-directed mutagenesis
