辣椒果实性状主基因+多基因遗传分析
2024-04-27陈楠周云云陈朗张华锋陈儒钢
陈楠 周云云 陈朗 张华锋 陈儒钢

摘 要 以西北农林科技大学蔬菜种质资源创新实验室提供的辣椒品系AA5与CK18为亲本构建F2代群体,统计调查群体各性状的分离情况,经相关性分析以及主基因+多基因遗传分析的方法来获得辣椒6个果实性状的主基因模型以及遗传效应。结果表明:6个果实性状皆是受主基因调控的数量性状,而且其相关性密切。辣椒果形指数、果肉厚度和果宽等3个性状中存在两组等加性主基因,属于2MG-EA模型;果长和单果质量存在两组加-显性主基因,属于2MG-AD模型;果皮硬度性状的遗传属于1MG-AD模型,存在一组 加-显性主基因。辣椒的果形指数和单果质量第1对主基因的正加性更显著。果皮硬度和果长性状的主基因效应为负显性以及正加性。果宽和果肉厚度性状的两对主基因表现为正向等加性。主基因遗传率∶单果质量(53.69)>果宽(48.42)>果长(34.67)>果肉厚度(25.42)>果皮硬度(22.91)>果形指数(22.23)。因此辣椒的这6个果实性状不宜于低代开展选育。研究结果为本材料的后续分子标记以及更高效、更具针对性的辣椒分子选育工作提供理论参考。
关键词 辣椒;果实性状;主基因+多基因;遗传模型
=辣椒(Capsicum annuum L),木兰纲茄科辣椒属,中南美洲为其原产地[1]。中国辣椒栽培于21 世纪取得较大发展,截至2019年末,其栽培面积达226万hm2,已成为种植面积及产值最大、加工方式和消费功能最多的蔬菜,而且种植风险较小[2]。果实性状直接影响商品的品质和销量,因此选育出优质的果实性状至关重要,而明确性状的遗传模型和遗传参数以及性状间的相关性是分子选育的重要手段。
前人利用主基因+多基因遗传模型分析方法对多种作物的遗传模型进行了分析。陈学军等[3]认为始花节位是由 1对加性主基因+加性-显性多基因模型来控制的。通过对B9431、吉林长椒进行杂交发现其后代始花节位遗传模型属于包含加性主基因、加性和显性多基因的模型[4]。同年,陈学军等[5]将D-2模型即1对加性主基因+加性-显性多基因模型确定为B9431ב吉林长椒株高的最适遗传模型,但其在基因效应上存在差异,显性效应受多基因控制[3-5]。最近也有研究报道细胞核当中的遗传物质主要参与成熟期辣椒果皮颜色的形成,加性主基因+加性-显性多基因模型主要控制辣椒紫-绿组合颜色性状[6]。辣椒果皮硬度能够体现果实品质和成熟度,对果实采收前后处理方式、货价期限、口感及其风味等有较大影响[7],但其相关的研究较少,可以借鉴同为茄科的番茄的相关研究。番茄的果实硬度与番茄果实的心室数量、宽度、长度呈正相关,但是与果实肉质的粘度负相关,与果实形状指数和果肉厚度之间均呈显著负相关[8-9]。于芬弟[10]和龙四安等[11]也报道了番茄果实硬度和pH、果型指数和总酸含量显著正相关。此外,在葫芦科作物上,研究表明西瓜果皮厚度性状遗传属于C-0模型[12]。两对加性-显性-上位性主基因+加性-显性-上位性多基因影响和制约甜瓜的柄蔓夹角的遗传关系[13]。两对加性-显性-上位性主基因+加性-显性多基因混合遗传模型影响及控制冬瓜果实的宽长度和果形指数的遗传[14]。棉花苗期耐盐性由1对主基因控制,育种时可利用杂交的方法来转移主效基因,而后于F2代开展单株选择[15]。黄瓜把长性状受2对加性-显性-上位性主基因+加性-显性多基因(E-1模型)控制,而且环境对其遗传影响较大,适于高代选择[16]。
本研究以性状差异明显的两个辣椒品系AA5和CK18构建F2代群体,统计调查群体各性状的分离情况,通过相关性分析以及主基因+多基因遗传模型分析出辣椒6个果实性状的主基因模型以及遗传效应,以期为本材料辣椒后续相关基因的精细定位、相关分子标记的开发以及更高效、更具针对性的辣椒分子选育工作提供理论参考和现实依据。
1 材料与方法
1.1 材 料
本研究选用的辣椒材料为亲本 CK18和AA5,以及两亲本杂交构建的F2群体,由西北农林科技大学蔬菜种质资源创新分子生物课题组提供。
1.2 试验方法
1.2.1 田间试验设计 F2群体于2020年1月中下旬在温室中进行穴盘播种育苗,4月份整地做畦,定植于西北农林科技大学北校区园艺场的塑料大棚内。每畦种植2行,每行12株,共24株,每6畦为一个小区。2020年共种植F2群体 1 314株,分为9个小区,统一进行田间管理。
1.2.2 试验观测项目及标准 性状调查方法参照《辣椒种质资源描述规范和数据标准》[17]。调查性状如下:
果长(cm):辣椒果基部至果顶的长度。
果宽(cm):辣椒果实最粗横截面的直径。
果形指数:辣椒果长与果宽的比值。
果肉厚度(mm):辣椒果实果肉最厚处的 厚度。
單果质量(g):辣椒单个果实的质量。
果皮硬度(N):辣椒果皮的硬度。
测量用具及仪器:GY-4-J型硬度计,游标卡尺,网袋,电子秤,手术刀。
测量方法:每株随机摘取3个成熟的四门斗果实,独立装袋,做好标记,取3个果实数据的平均值。
1.2.3 统计分析的方法 使用Microsoft Excel 2019对数据进行记录整理,使用SPSS 23.0对数据进行变异分析、正态性检验和相关性分析等。采用单个 F2 世代数量性状主基因+多基因混合遗传分析方法[18],使用章元明教授团队在曹锡文等[19]的C++数量性状分离分析软件包 SEA基础上研制的 R 软件包 SEA 2.0,对F2群体的果长、果宽、单果质量、果皮厚度、果皮硬度和果形指数6个果实性状进行分析[20]。盖钧镒[21]采用似然比检验(AIC准则是权衡估计模型复杂度和模型拟合数据优良性的一种标准)确定为备选模型,接着利用适合性检验获得统计量,将显著统计量最少的备选模型定为最适模型,同时估算对应的成分分布参数。
2 结果与分析
2.1 辣椒AA5与CK18杂交F2代群体的性状遗传多样性分析
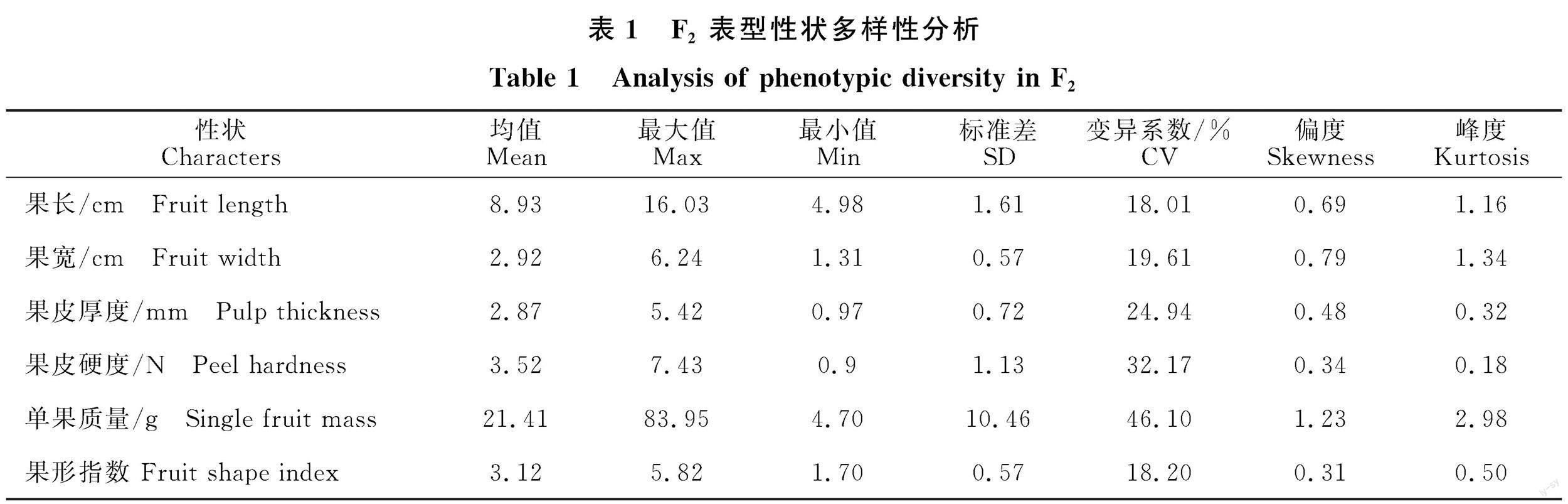
辣椒AA5与CK18杂交F2群体的6个果实性状表现出不同程度的变异情况。变异系数大小:单果质量46.10% >果皮硬度32.17% >果肉厚度24.94% >果宽19.61% >果形指数 18.20%>果长18.01%。这说明各性状在F2群体内存在明显变异且单果质量的遗传变异幅度大,能为选育优良辣椒品种提供种质资源。 F2代群体各性状的分离情况见图1、表1。各性状皆为连续性变化,如表1所示,各性状的偏度值为 0.31~1.23,峰度值为0.18~2.98,在-3~3之间,这与正态或偏正态分布特点相契合。除单果质量外,另外5个性状皆满足正态分布,由于F2群体总样本数较多,共981株,所以单果质量近似属于正态分布,说明这6个性状是受主基因调控的数量性状。
2.2 相关性分析
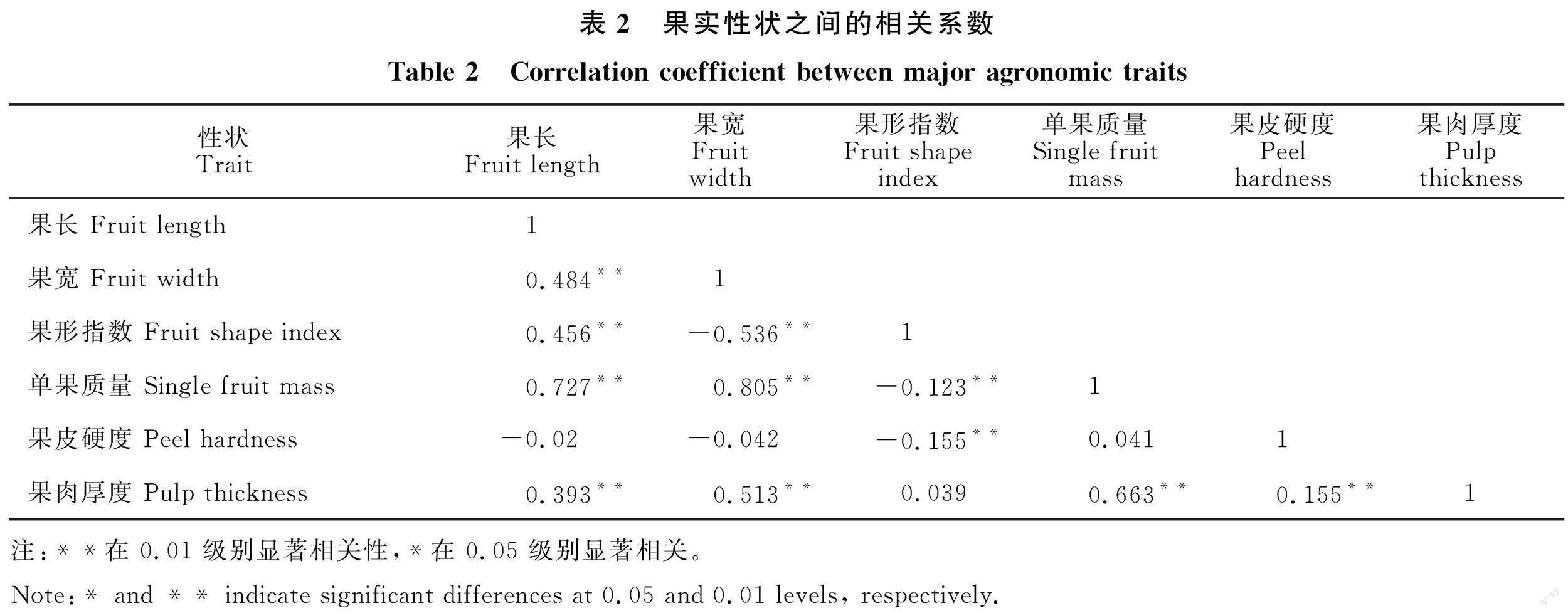
对杂交后代的果长、果宽、单果质量、硬度、果形指数和厚度等6个性状进行 Pearson相关分析(表2)。如表2所见,果宽与果长,果形指数与果长,单果质量与果长、果宽,果肉厚度与果长、果宽、果皮硬度、单果质量分别呈极显著正相关;果形指数与果皮硬度、果宽,单果质量与果形指数,分别呈极显著负相关。其中单果质量与果长的相关系数最大,与果宽的相关系数次之;果肉厚度与单果质量、果宽和果长的相关系数较大。果形指数与果宽、果长的相关系数较大。总之,辣椒育种时要全面考虑到各农艺性状间的相关性以及制约情况。
2.3 主基因+多基因遗传模型分析
2.3.1 备选模型的确定
使用单个F2世代分析法,对AA5和CK18的F2世代群体果形指数性状数据进行主基因+多基因混合遗传模型分析。如表3、表4所见,选取AIC值最小的3个模型为备选模型。因此,果形指数备选模型分别是2对等加性主基因模型(2MG-EA)、2对加性主基因模型(2MG-A)和2对加性-显性主基因模型(2MG-AD),对应的AIC值分别为1 644.719、 1 647.134和1 649.411。果皮硬度的3个备选模型分别是1对加性-显性主基因模型(1MG-AD)、2MG-EA和2MG-AD,对应的AIC值分别为2 975.814、2 796.395和2 976.545。果宽的3个备选模型分别是2MG-EA、2MG-AD和2MG-A,对应的AIC值分别为1 566.917、1 568.884和 1 572.158。果长的3个备选模型分别是2MG-EA、2MG-AD和2MG-A,对应的AIC值分别是 3 629.244、3 627.975和3 630.477,果肉厚度3个备选模型分别是2MG-EA、2MG-A和2MG-AD,对应的AIC值分别为2 077.821、2 078.492和 2 079.27。单果质量的3个备选模型分别是2MG-EA、2MG-A和2MG-AD,对应的AIC值分别为6 942.077、6 947.576和6 955.283。
2.3.2 最适模型的确定 从表4、表5可知,所有备选模型中皆不存在显著统计量,所以按照AIC值准则,选AIC值最小的即可,因此果形指数、果宽和果肉厚度性状属于2MG-EA模型,其中各存在2 对等加性主基因共同调控辣椒的果形指数、果宽和果肉厚度性状。果皮硬度性状的最适遗传模型为1MG-AD模型,由此说明1对加性-显性主基因调控辣椒的果皮硬度性状。果长和单果质量性状与2MG-AD模型相匹配,其中存在两组加-显性主基因。
2.3.3 遗传参数估算
如表7所示,辣椒单果质量性状的主基因加性效应值da为9.63,db为 4.99主基因显性效应值,ha为-3.80,hb为 -0.60,主基因遗传率为53.69%。经过遗传参数分析后发现da>db>0,ha的绝对值大于hb ,同时hb和ha皆小于零,这表明第一对主基因的加-显性更显著,主基因加性效应较强,加性效应呈正向,而显性效应呈负向。由此可见辣椒的单果质量性状由2对加性-显性主基因调控,二者分别呈负显性以及正加性。辣椒果长性状的da为1.12,db为1.26,ha为-0.60,hb为-0.42,主基因遗传率为34.67%,经过遗传参数分析后发现da>db>0,ha的绝对值大于hb ,同时hb和ha皆小于零,这表明第一对主基因的加-显性更显著,主基因加性效应较强,加性效应呈正向,而显性效应呈负向。由此可见辣椒的果长和单果质量性状由2对加性-显性主基因调控,而且二者遗传力较低,不适于低代开展选育。
果肉厚度性状的da为0.49,db为 0.43,主基因遗传率为25.42%;辣椒果宽性状的da为 0.36,db为0.34,主基因遗传率为 48.42%;辣椒果形指数的da为0.44,db为0.42,主基因遗传率:22.23%,经过遗传参数分析后三者的da和db分别基本相等,且皆大于零,因此辣椒的果实厚度、果宽和果形指数性状分别由2对等加性主基因共同控制,加性效应皆呈正向,但其遗传力不高,不适于低代开展选育。
果皮硬度性状的da为9.63,而ha为 -3.80,主基因遗传率为18.81%。经过遗传参数分析后发现果皮硬度性狀的主基因加性更强,加性效应呈正向,而显性效应呈负向。由此可见辣椒的果皮硬度性状由1对加性-显性主基因调控,二者分别呈负显性以及正加性,但其遗传力不高,不适于低代开展选育。
3 结论与讨论
本研究以西北农林科技大学蔬菜种质资源创新实验室提供的辣椒品系AA5与CK18为亲本构建F2代群体,统计调查群体各性状的分离情况,经相关性分析发现辣椒AA5与CK18的杂交F2代单果质量以及果宽表现为极其显著的正相关关系;茎粗指标与单果质量显著正相关,然而果形指数却与果宽、主茎长呈极显著负相关,这些结果与张佳琦[22]的报道相似。而果宽、果长、单果质量和果皮硬度与果肉厚度的正相关关系都极为显著,其中单果质量和果宽与果肉厚度的相关系数较大,均大于0.5,说明单果质量和果宽对果肉厚度的贡献率较大,这又与李晴等[23]有不同之处。这一现象可能归因于种植环境以及研究材料的差异,可以用重复的家系平均数或重组自交系为基础进行进一步的主基因+多基因混合遗传分析,来减小试验误差[24]。果皮硬度性状的遗传属于1MG-AD模型,其存在一组加-显性主基因,分别呈正加性以及负显性效应,主基因遗传率接近20%。这和刘军等[25]的报道类似。
同时,本研究认为果形指数、果肉厚度和果宽等性状皆分别受到两对加性主基因共同控制,属于2MG-EA遗传模型;辣椒果长和单果质量性状由两对加性-显性主基因决定,与其2MG-AD模型特点相符合。辣椒6个果实性状的主基因加性皆是正向。果形指数、果肉厚度和果宽等3个性状的两个主基因加性效应基本相等;果长和单果质量性状的主基因加性效应和显性效应都以第一对主基因的为主,果皮硬度和单果质量性状的主基因显性效应为负向,这与陈学军等[26]的报道相类似。陈学军等[26]认为辣椒果宽、果肉厚度和单果质量量的遗传模型中存在两对加-显-上位性主基因。虽然通过本试验能够得知辣椒AA5与CK18构建的F2代群体的6个果实性状的主基因数量以及对应的遗传效应,但无法获知其多基因的相关信息,后续还需利用多世代联合分析法进行更深入的主基因+多基因遗传分析。而且6个果实性状在F2代的主基因遗传率均较低,位于18.81%~53.69%,低代选育的效果不佳,在高世代遗传才能稳定,因此,这6个果实性状均不适于低代开展选育。
辣椒作为中国产量最高、种植面积最大的蔬菜,已成为人们饭桌上必不可少的佐料,其供应尤为重要。而辣椒的果实性状与辣椒的产量密切相关,目前,与辣椒性状的遗传模型分析相关的报道不多,本研究可为辣椒的果长、果宽、单果质量、果肉厚度以及果实形状指数等数量性状遗传模型分析做出重要贡献,也为本材料辣椒后续相关基因的精细定位、更高效更具针对性的辣椒分子选育工作以及相关分子标记的开发提供了理论参考和现实依据。
参考文献 Reference:
[1] 程海刚,郭艳萍,李 翎,等.线辣椒主要生物学性状相关性分析及产量因素通径分析[J].陕西农业科学,2012,58(2):71-73.
CHENG H G,GUO Y P,LI L,et al.Correlation analysis of main biological characters and path analysis of yield factors in hot pepper [J].Shaanxi Journal of Agricultural Sciences,2012,58(2):71-73.
[2] 邹学校,马艳青,戴雄泽,等.辣椒在中国的传播与产业发展[J].园艺学报,2020,47(9):1715-1726.
ZOU X X,MA Y Q,DAI X Z,et al.Spread and industry development of pepper in China[J].Acta Horticulturae Sinica,2020,47(9):1715-1726.
[3] 陳学军,陈劲枫,方 荣,等.辣椒始花节位遗传研究[J].园艺学报,2006,33(1):152-154.
CHEN X J,CHEN J F,FANG R,et al.Inheritance of the node for first flower in pepper(Capsicum annuum L.)[J].Acta Horticulturae Sinica,2006,33(1):152-154.
[4] 陈学军.辣椒早熟性状遗传分析、相关基因分子标记及辣椒属栽培种遗传多样性研究[D].南京:南京农业大学,2006.
CHEN X J.Studies on inheritance of earliness traits,molecular markers of related gene and genetic diversity among cultivated species in pepper[D].Nanjing:Nanjing Agricultural University,2006.
[5] 陈学军,陈劲枫.辣椒株高遗传分析[J].西北植物学报,2006,26(7):1342-1345.
CHEN X J,CHEN J F.Genetic analysis of plant height in pepper(Capsicum annuum L.)[J].Acta Botanica Boreali-Occidentalia Sinica,2006,26(7):1342-1345.
[6] 丁盼盼.辣椒果皮颜色的遗传分析及QTL定位[D].合肥:安徽农业大学,2017.
DING P P.Genetic analysis and QTL mapping of peel color in pepper fruit[D].Hefei:Anhui Agricultural University,2017.
[7] 程杰山,沈火林,井玉芳,等.辣椒果实成熟过程中硬度及相关生理生化指标的变化[J].华北农学报,2006,21(6):75-78.
CHENG J SH,SHEN H L,JING Y F,et al.The changes of characters related to fruit firmness of two pepper(Capsicum annuum L.) lines during fruit ripening[J].Acta Agriculturae Boreali-Sinica,2006,21(6):75-78.
[8] 罗 静,田丽萍,张 超,等.加工番茄果实硬度与相关性状间的分析[J].中国农学通报,2011,27(28):217-220.
LUO J,TIAN L P,ZHANG CH,et al.Analysis of firmness and related characters of processing tomato[J].Chinese Agricultural Science Bulletin,2011,27(28):217-220.
[9] 曲瑞芳.番茄果实中番茄红素的遗传分析及与农艺性状的相关性研究[D].陕西杨凌:西北农林科技大学,2006.
QU R F.The genetic analysison lycopene of tomato and correlation of the lycopene content in fruit with the agronomic traits[D]. Yangling Shaanxi:Northwest A&F University,2006.
[10] [ZK(#]于分弟.番茄杂交一代杂种优势表现、遗传效应及性状相关性的研究[D].南宁:广西大学,2012.
YU F D.Research on heterosis,genetic effects and correlation in characters of hybridization generation of tomato[D].Nanning:Guangxi University,2012.
[11] 龙安四,陈 勇,韦冠睦,等.番茄11个品质性状的相关分析及通径分析[J].安徽农业科学,2014,42(11):3209-3211.
LONG A S,CHEN Y,WEI G M,et al.Correlation analysis and path analysis of characters of 11 tomato( Lycopersicon esculentum Mill.) Varieties[J].Journal of Anhui Agri.Sci.,2014,42(11):3209-3211.
[12] 王学征,张志鹏,陈克农,等.西瓜果实硬度性状主基因+多基因遗传分析[J].东北农业大学学报,2016,47(9):24-32.
WANG X ZH,ZHANG ZH P,CHEN K N,et al.Mixed major gene and polygene inheritance analysis of fruit hardness in Citrullus lanatus [J].Journal of Northeast Agricultural University,2016,47(9):24-32.
[13] 熊姜玲,赵光伟,徐志红,等.甜瓜柄蔓夹角主基因+多基因遗传分析[J].中国农学通报,2016,32(34):55- 61.
XIONG J L,ZHAO G W,XU ZH H,et al.Genetic analysis of leaf stalk-stem angle using mixture model of major gene plus polygene in Cucumis melo L.[J].Chinese Agricultural Science Bulletin,2016,32(34):55-61.
[14] 程志魁,劉政国,陈婕英,等.冬瓜果实形状的主基因+多基因遗传分析[J].分子植物育种,2022,20(17):5703-5710.
CHENG ZH K,LIU ZH G,CHEN J Y,et al.Genetic analysis of fruit morphological traits in wax gourd by mixture model of major genes and polygenes molecular plant breeding[J].Molecular Plant Breeding,2022,20(17):5703-5710.
[15] 马 娟,司龙亭,田 友.黄瓜把长主基因+多基因混合遗传分析[J].西北农业学报,2010,19(10):161-165.
MA J,SI L T,TIAN Y.Mixed major gene plus polygene inheritance analysis of stalk length in cucumber[J].Acta Agriculturae Boreali-occidentalis Sinica,2010,19(10):161-165.
[16] 刘雅辉,王秀萍,李 强,等.棉花苗期耐盐性主基因和多基因混合遗传分析[J].西北农业学报,2015,24(8):57-61.
LIU Y H,WANG X P,LI Q,et al.Mixed inheritance analysis of salt tolerance in cotton seeding stage[J].Acta Agriculturae Boreali-occidentalis Sinica,2015,24(8):57-61.
[17] 李锡香,张宝玺.辣椒种质资源描述规范和数据标准[M].北京:中国农业出版社,2006.
LI X X,ZHANG B X,et al.Description Specification and Data Standard of Pepper Germplasm Resources[M].Beijing:China Agricultural Press,2006.
[18] 王建康,盖钧镒.利用杂种F2世代鉴定数量性状主基因-多基因混合遗传模型并估计其遗传效应[J].遗传学报,1997,24(5):432-440.
WANG J K,GAI J Y.Identification of major gene and polygene mixed inheritance model and estimation of genetic parameters of a quantitative trait from F2 progeny[J].Acta Genetica Sinica,1997,24(5):432-440.
[19] 曹錫文,刘 兵,章元明.植物数量性状分离分析Windows软件包SEA的研制[J].南京农业大学学报,2013,36(6):1-6.
CAO X W,LIU B,ZHANG Y M.SEA:a software package of segregation analysis of quantitative traits in plants[J].Journal of Nanjing Agricultural University,2013, 36(6):1-6.
[20] 王靖天,张亚雯,杜应雯,等.数量性状主基因+多基因混合遗传分析R软件包SEA v2.0[J].作物学报,2022, 48(6):1416-1424.
WANG J T,ZHANG Y W,DU Y W,et al.SEA v2.0:an R software package for mixed major genes plus polygenes inheritance analysis of quantitative traits[J].Acta Agronomica Sinica,2022,48(6):1416-1424.
[21] 盖钧镒.植物数量性状遗传体系的分离分析方法研究[J].遗传,2005(1):130-136.
GAI J Y.Segregation analysis of genetic system of quantitativetraits in plants[J].Hereditas,2005(1):130-136.
[22] 张佳琦.辣椒果实性状相关性分析QTL定位[D].广东湛江:广东海洋大学,2014.
ZHANG J Q.QTL mapping and relationship analysis of fruit-related traits in pepper[D].Zhanjiang Guangdong,Guangdong Ocean University,2014.
[23] 李 晴,韩玉珠,张广臣.辣椒品种主要农艺性状的相关性和主成分分析[J].长江蔬菜,2010(6):29-33.
LI Q,HAN Y ZH,ZHANG G CH.Physiological responses of leaf and bulb of longya lily to drought stress[J].Journal of Changjiang Vegetables,2010(6):29-33.
[24] 闫立英,楼丽娜,冯志红,等.雌雄同株黄瓜单性结实性主基因+多基因混合遗传分析[J].西北植物学报,2009, 29(6):1122-1126.
YAN L Y,LOU L N,FENG ZH H,et al.Analysis on mixed major gene and polygene inheritance of parthenocarpy in monoecious cucumber(Cucumis sativus L.)[J].Acta Botanica Boreali-Occidentalia Sinica,2009,29(6):1122-1126.
[25] 刘 军,郭 爽,张 维,等.辣椒果实硬度性状的主基 因+多基因遗传分析[J].西南农业学报,2011,24(4):1464-1468.
LIU J,GUO SH,ZHANG W,et al.Mixed major gene and polygene inheritance analysis of fruit firmness in pepper[J].Southwest China Journal of Agricultural Sciences,2011,24(4):1464-1468.
[26] 陈学军,方 荣,周坤华,等.辣椒果实性状主基因+多基因遗传分析[J].西北植物学报,2012,32(2):246-251.
CHEN X J,FANG R,ZHOU K H,et al.Major gene plus polygene inheritance analysis of fruit traits in pepper[J].Acta Botanica Boreali-Occidentalia Sinica,2012,32(2):246-251.
Genetic Analysis of Major Genes and Polygenes of
Fruit Traits in Capsicum annuum
Abstract In current study, the F2 population of the Capsicum annuum lines AA5 and CK18 provided by the vegetable Germplasm Resources Innovation Laboratory of Northwest A&F University was constructed,and the segregation of each character of the population was investigated statistically. The correlation analysis and main gene + polygene genetic analysis were used to obtain the main gene models and genetic effects of 6 fruit traits in Capsicum annuum. The results showed that the six fruit traits were all quantitative traits regulated by major genes. There were significant correlations among six fruit characters. There were two groups of iso-additive major genes in Capsicum annuum fruit shape index, pulp thickness and fruit transverse diameter, which belonged to 2MG-EA model, fruit length and single fruit mass had two groups of additive-dominant major genes, which belonged to 2MG-AD model, and the inheritance of pericarp firmness traits belonged to 1MG-AD model, which had a group of additive-dominant major genes. The positive additive of the first pair of major genes in fruit shape index and single fruit mass of Capsicum annuum was more significant. The major genes affected the pericarp hardness and fruit length traits, which were negative dominance and positive additive. The two pairs of major genes of fruit transverse diameter and pulp thickness were positive and iso-additive. Major gene heritability was as follows:single fruit mass (53.69), fruit transverse diameter (48.42), fruit longitudinal diameter (34.67), pulp thickness (25.42), pericarp firmness (22.91), fruit shape index (22.23). Therefore, the six fruit characters of pepper are not suitable for breeding in lower generations. This study provides a theoretical reference for the follow-up molecular markers of this material and more efficient and targeted molecular breeding of Capsicum annuum.
Key words Pepper; Fruit characters; Major gene + polygene; Genetic model
