化妆品滞留类型区分对产品合规性的影响及建议
2024-04-25葛婧李锦聪陶浩博肖树雄
葛婧 李锦聪 陶浩博 肖树雄


为使化妆品能达到法规要求,本文通过分析一些具体案例,来研究产品中淋洗类和驻留类等滞留类型的区分对产品合规性的影响,为合理选择原料和配方设计,合理选用安全和功效评价方法,合理引用安全评估数据提出建议。
关键词:驻留类;淋洗类;合规性;安全评估数据
自化妆品《已使用化妆品原料目录(2021 版)》[1] 和《化妆品安全评估技术导则》[2] 发布以来,部分产品淋洗类和驻留类等滞留类型的区分模糊,可能是使用者对这两个术语的定义和区分存在理解偏差等原因造成的,这一偏差可能会影响化妆品的生产、安全评估、检验和功效评价[3-6],进而影响产品的合规性。下面我们将结合一些具体案例,对化妆品中滞留类型区分产生的影响进行分析,并提出几点建议。
Part 1
驻留类和淋洗类化妆品法规要求评析
国内外针对化妆品的现行法规中,对驻留类和淋洗类化妆品有不同的要求,现梳理如下:
1.1 《化妆品安全技术规范》[7]
概述中对淋洗类和驻留类化妆品已有明确定义:
淋洗类化妆品:在人体表面(皮肤、毛发、甲、口唇等)使用后及时清洗的化妆品。
驻留类化妆品:除淋洗类产品外的化妆品。
对于第一个定义,“及时” 在一般情况下不难理解,即在使用产品后清洗。对于某些使用方法特殊的产品,如发膜、护发素、面膜等,通常可能需要在产品使用方法中对“用后清洗” 作进一步说明,如标明“需要在体表(包括毛发)停留一定时间(若干分钟,1 ~ 30 分钟)”。
由此可见,对产品滞留类型进行区分非常重要,因为这涉及到个别原料的使用限制,产品的安全性评价、功效评价和安全评估等问题。
1.2 《化妆品分类规则和分类目录》[8]
自2021 年5 月1 日起,化妆品注册人、备案人申请特殊化妆品注册或者进行普通化妆品备案时,应当依据《化妆品分类规则和分类目录》填报产品分类编码。
化妆品按使用方法分类可分为:01 淋洗,02 驻留。根据国家标准、《化妆品安全技术规范》要求,选择编码。
1.3 《已使用化妆品原料目录》
载明原料最高历史使用量是安全评估的依据。需要注意的是,《已使用化妆品原料目录》中的一部分原料按淋洗类和驻留类产品分开标明。如果是只有驻留类产品最高历史使用量信息的原料,那么淋洗类产品可参照驻留类产品信息使用。
1.4 《化妆品注册和备案检验工作规范》[9]
除了对不同类别产品设定不同的检验项目外,《化妆品注册和备案检验工作规范》还对不同滞留类型产品设定不同的检验项目。
(1) 毒理学试验项目:驻留类的普通类产品,如化学防晒剂含量≥ 0.5%(w/w) 应加测皮肤光毒性试验和皮肤变态反应试验。与驻留类不同,淋洗类护肤产品只需要进行急性皮肤刺激性试验,而不需要进行多次皮肤刺激性试验。
(2) 人体安全性检验项目:宣称祛痘、抗皱、祛斑等功效的淋洗类产品均应增加人体试用试验安全性评价。
(3) 功效评价检验项目:非防晒类化妆品中化学防晒剂含量之和≥ 0.5%(w/w) 的产品,需要检测SPF 值,但淋洗类除外。
此外,在化妆品功效评价方面,淋洗类和驻留类的判定直接影响了功效评价方法的选择。例如,化妆品祛斑美白功效测试存在两种方法,第一种是紫外线诱导人体皮肤黑化模型祛斑美白功效测试法,第二种是人体开放使用祛斑美白功效测试法,而淋洗类美白祛斑产品在注册申报时更适合选择第二种方法进行功效评价测试。
除了测试方法本身存在的限制外,两种测试方法在费用上也存在显著差异。具体而言,第二种测试方法的费用远高于第一种。
1.5 美国化妆品原料评价委员会(Cosmetic Ingredient Review,CIR)
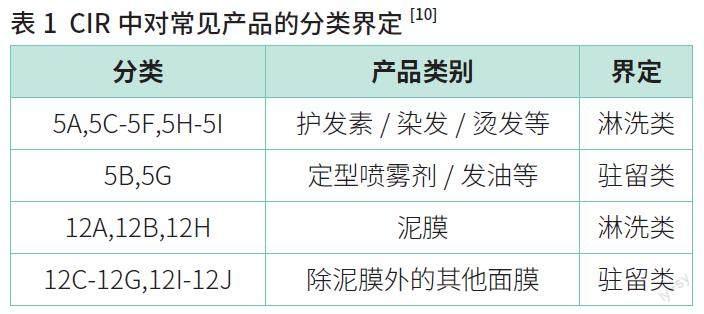
化妆品安全评估时也常常引用国外权威数据,如CIR 的数据和标准。CIR 对驻留类和淋洗类产品有详细的区分界定,将除清洁、泥膜外的其他面膜列为驻留类,将护发素、清洁类面膜、泥膜等列为淋洗类,具体界定可參考下表,详见表1。
综上所述,化妆品的使用方法分类是产品合规的前提条件之一, 产品必须在研发阶段就确定其分类,以确保原料使用的安全性和功效评价测试方法等符合相关的法规规定。
Part 2
区分不同滞留类型对产品合规性影响
2.1 配方
化妆品在选用原料和设计配方时应尽量考虑使用方法的影响,合理界定滞留类型,以满足配方需求。如《已使用化妆品原料目录(2021 版)》部分原料的最高历史使用量或CIR 安全用量按照淋洗类和驻留类分开列出,护发素、发膜如果按照驻留类标准选用原料,添加量可能会偏低,满足不了配方要求。
除了护发素和发膜外,常见的需关注滞留类型的产品还有面膜类。市面上常见的面膜根据剂型、质地、使用等特点进行区分,大致分为贴片面膜、膏状面膜、撕拉式面膜和粉状面膜四大类。膏状面膜中热门的产品主要有冻膜和泥膜。泥膜和其他膜类不同,在使用部位停留一段时间后必须清洗。因此,合理界定滞留类型对原料选用和配方要求非常重要。其他产品如手膜、足膜等,也存在类似情况。
2.2 原料
在《化妆品安全技术规范》中,部分原料在淋洗类和驻留类产品中有明确的使用限制要求。表2 列出了《化妆品安全技术规范》中,烷基(C12-C22) 三甲基铵氯化物在驻留类和淋洗类产品中限量要求的比较。
表2 中,烷基(C12-C22) 三甲基铵氯化物包含《已使用化妆品原料目录(2021 版)》中至少8 种原料:01744大豆油基三甲基氯化铵、03637 鲸蜡硬脂基三甲基氯化铵、04900 牛脂基三甲基氯化铵、05956 山嵛基三甲基氯化铵、06886 西曲氯铵、07526 椰油基三甲基氯化铵、08024 硬脂基三甲基氯化铵和08377 月桂基三甲基氯化铵。这些成分既是《化妆品安全技术规范》表3 的限用组分,也是表4 的准用防腐剂,其限度须与使用目的和滞留类型相符。当作为限用组分使用时,产品如被界定为驻留类,此类成分在配方中的添加量受很大的限制,尤其是发膜、护发素类产品。如作为防腐剂使用,其最大允许浓度为0.1%。
类似地,CIR 也收载了一些在驻留类和淋洗类产品中限量要求比较,部分数值相差几十倍,见表3。
安全用量的差别在洗护类产品中显得更加突出,最明显的是“卡松”。卡松又称凯松(Kathon),是一种高效的广谱抑菌剂,因性价比高,使用历史长,是淋洗类化妆品(特别是洗护类) 中常用的防腐剂。它是由2- 甲基-4- 异噻唑啉-3-酮( MI) 和 2- 甲基-5- 氯-4- 异噻唑啉-3- 酮( CMI) 及无机盐作为稳定剂组成的混合物,通常CMI∶MI = 3∶1。其中还规定,卡松和CMI 仅用于淋洗类产品;CMI 不能和MI 同时使用;MI 不能用于驻留类产品。通常情况下,护发素、发膜这些产品中经常会使用卡松作为防腐剂。护发素如按CIR 标准可判定为淋洗类,但发膜的标准在CIR 中并未界定,需要根据使用方法进行说明。
其它原料,如水杨酸、吡硫鎓锌(Zinc Pyrithione,ZPT)、吡罗克酮乙醇胺盐(Octopirox, OCT) 在淋洗类和驻留类产品中有不同的使用限制要求,也需要判断好滞留类型再设计配方并进行安全评估,详见表4。
2.3 安全评估数据
很多原料的历史最高使用量是按滞留类型进行分类的,如《已使用化妆品原料目录》05886 号原料山茶(CAMELLIA JAPONICA) 籽提取物(CAMELLIA JAPONICASEED EXTRACT),淋洗类产品最高历史使用量为4.0072%,驻留类产品最高历史使用量为0.15%,两者相差很大。同时,在计算全身暴露量(SED) 或安全边际值(MoS) 时,淋洗类的驻留因子为0.01,驻留类的驻留因子为1,两者在计算暴露剂量时,风险系数相差了100 倍。
因此,化妆品滞留类型判定对安全评估数据引用影响很大。
2.4 检验或评价项目
上文1.3 中提及,根据《化妆品注册和备案检验工作规范》选用不同检验或评价项目,首先要对产品滞留类别进行准确判定,否则也有可能因滞留类型设置错误导致检验或评价项目的偏差,进而得出不准确的结果。
Part 3
建议产品滞留类型,即驻留类和淋洗类的界定,是产品上市后进行抽样检验时执法人员重要的判定依据。部分原料在《化妆品安全技术规范》中有明确的限制规定和质量规格要求,在《化妆品监督管理条例》第六十条中,对“使用不符合强制性国家标准、技术规范的原料”“不按照强制性国家标准或者技术规范使用原料”“生产经营不符合强制性国家标准、技术规范的化妆品” 的违法行为,明确将面临严厉的处罚。因此,区分产品滞留类型极为重要。为使产品能达到合规要求,笔者提出几点建议,以供参考:
(1) 结合目前国内化妆品的实际情况和各类产品使用要求来看,建议由监管部门或行业协会制定我国化妆品驻留类和淋洗类的界定标准,作为化妆品注册备案的重要执行依据。
(2) 对产品研发人员来说,在产品研发阶段应充分了解产品特性和使用要求,特别要考虑产品在使用部位的滞留时间,明确是否有用后清洗要求,才能合理选择原料和配方设计,合理选用安全和功效评价方法。
(3) 针对产品安全评估,如需引用权威机构的评估数据,已经明确该原料驻留类和淋洗类安全使用量的,应优先根据权威机构结论选取与产品对应的安全使用量数据作为评估证据。对于产品滞留类型难以区分的,基于保守评估原则,满足驻留类要求的安全评估时选用驻留类数据。尤其是《化妆品安全技术规范》中对驻留类和淋洗类有“限制使用规定”或“质量规格要求” 的原料,应充分考虑原料在配方中应用的安全性。
【基金项目】《化妆品植物原料安全性评价研究》(广东省药品监督管理局科技创新项目2022ZDZ04 )
作者介绍
葛 婧:新疆药品监督管理局
李锦聪:广东省化妆品科学技术研究会
陶浩博:广州金域医学检验集团股份有限公司
肖树雄:广东省药品检验所,国家药监局风险评估重点实验室
[ 参考文献]
[1] 国家药品监督管理局.国家药监局关于发布《已使用化妆品原料目录(2021 年版)》的公告(2021 年第 62 号)
[2] 国家药品监督管理局.国家药监局关于发布《化妆品安全评估技术导则(2021 年版)》的公告(2021 年 第51 号)
[3] 张燕燕, 林隆强. 驻留类化妆品中镉和汞的监测结果及健康风险评估[J]. 中国口岸科学技术 , 2016(12): 92-96.
[4] 国家药品监督管理局.国家药监局关于9 批次化妆品检出禁用原料的通告(2023 年第60 号)
[5] 郭潔, 张华珺, 刘齐, 等. 高效液相色谱法同时测定洗发水中5 种去屑剂[J]. 日用化学工业, 2015, 45(12): 715-718.
[6] 郑荣, 茹歌, 王柯.高效液相色谱-串联质谱法测定化妆品中16 种防腐剂[J]. 中国卫生检验杂志,2016,26(19):2758-2761.
[7] 国家食品药品监督管理总局.化妆品安全技术规范2015 年版[M].北京:人民卫生出版社,2015.
[8] 国家药品监督管理局.国家药监局关于发布《化妆品分类规则和分类目录》的公告(2021 年第49 号)
[9] 国家药品监督管理局.国家药监局关于发布实施《化妆品注册和备案检验工作规范》的公告(2019 年 第72 号)
[10] https://cir-safety.org/sites/default/files/CIR%20Use%20Categorization.pdf
