基于基因表达综合数据库和网络药理学探讨香参丸治疗溃疡性结肠炎的分子机制
2024-04-24缪涛声李逸婷郑鸿铭胡芝凡莫乔兰邱泽鑫陈斌
缪涛声,李逸婷,郑鸿铭,胡芝凡,莫乔兰,邱泽鑫,陈斌
作者单位:1广州中医药大学第一临床医学院,广东 广州 510006;
2广州中医药大学第一附属医院脾胃科,广东 广州510405
溃疡性结肠炎(ulcerative colitis,UC)是炎症性肠病(inflammatory bowel disease,IBD)一种常见的慢性、非特异性结、直肠炎性疾病[1],临床表现主要有腹痛、腹泻、黏液脓血便等,如今UC 因其发病率的不断上升已成为全球公共卫生问题[2]。UC 目前的治疗药物主要有5-氨基水杨酸、生物制剂及激素等,但仍具有药物依赖性、病人经济负担较大等问题[3],因此迫切需要为UC 病人开发新型有效、副作用较低且经济实惠的治疗方法。
中医药是我国重要的医学资源宝库,具有经济负担与副作用较低、疗效较好、病人依从性较高等优势。香参丸出自《奇方类编》,由木香、苦参以及甘草组成,具有清热燥湿、行气止痛的功效,常用于治疗痢疾。最新研究表明香参丸可用于治疗UC[4-5],但目前关于香参丸治疗UC 的临床研究相对较少,且相应作用机制尚未明确,本研究自2023年1—5 月通过生物信息学和网络药理学探讨香参丸治疗UC 的分子机制,以期为香参丸的临床应用提供依据,并为其作用机制的进一步研究提供参考。
1 材料与方法
1.1 材料基因表达综合(GEO)数据库(https://www.ncbi.nlm.nih.gov/geo/),中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP,https://old.tcmsp-e.com/tcmsp.php),蛋白质数据库UniProt(https://www.uniprot.org/),STRING 数据库(https://cn.string-db.org/),Metascape 数据库(https://metascape.org/),Cytoscape3.7.2软件,GraphPad Prism 9.0 软件,R 语言4.0.1 软件,Autodock4.0 软件,PyMOL2.5软件。
1.2 方法
1.2.1GEO 数据库溃疡性结肠炎差异表达基因筛选 从GEO 数据库中搜索“ Ulcerative colitis”,筛选并下载GSE38713芯片,其平台为GPL570,该芯片有43 个样本,其中包括13 例健康受试者与15 例活动期溃疡性结肠炎病人。以log|FC|≥1,校正P<0.05 为条件进行差异基因表达分析。
1.2.2加权共表达分析 将GEO 数据库获取的差异基因数据导入R 语言进行加权共表达分析,构建无标度共表达网络。利用R 语言WGCNA 包goodSamplesGenes 方法去除离群的基因和样本,使用幂函数a_mn=|C_mn|^β(a_mn:基因与基因的邻间矩阵;C_mn:所有基因对的皮尔逊相关性获得的相似性矩阵;β:软阈值)构建加权邻接矩阵,并转换为拓扑重叠矩阵(TOM)及其相关的相似度(1-tom),以最小基因组数30 和敏感度3 为条件构建1-tom 矩阵的层次聚类树。在与溃疡性结肠炎高度相关的模块中根据|MM|>0.8 筛选获得溃疡性结肠炎的HUB基因。
1.2.3香参丸化学成分的筛选及其靶点的预测利用TCMSP 数据库,以“木香”“苦参”以及“甘草”分别作为关键词对香参丸的主要化学成分及其相关作用靶点进行搜索。香参丸的主要化学成分的筛选条件为口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug likeness,DL)≥0.18。将筛选得到的化学成分在TCMSP 数据库查询相关靶点信息,并通过UniProt 数据库将相关靶点信息转化为基因靶点信息,最终得到243个基因靶点信息。
1.2.4预测香参丸治疗UC 的作用靶点 将香参丸UniProt 的基因靶点信息与UC 相关的HUB 基因信息取交集,筛选出可能共同作用的基因靶点信息并绘制韦恩图,最终得到37个共同作用靶点。
1.2.5PPI 网络模型的构建与分析 将香参丸与UC 的共同靶点信息导入STRING 数据库,蛋白种属设置为“ Homo Sapiens”,得到蛋白质相互作用网络(protein proteinInteractio,PPI)数据,将数据导入Cytoscape3.7.2 软件进行进一步可视化处理,得到PPI网络模型。同时利用Cytoscape 3.7.2 软件工具中的Network Analyzer 进行拓扑分析,得到香参丸与UC交集靶点的度值。
1.2.6KEGG 与GO 通路富集分析 利用Metascape对香参丸与UC 的共同基因靶点做KEGG 与GO 通路富集分析,蛋白种属设置为“ Homo Sapiens”,其中GO 通路包括生物学过程(biological process,BP),细胞组分(cellular component,CC),分子功能(molecular function,MF)。将获得的数据进行进一步可视化处理得到功能富集气泡图。
1.2.7“中药-成分-疾病-靶点-通路”网络模型的构建与分析 将香参丸的主要成分、香参丸与UC的交集靶点信息、Metascape 数据库获得的KEGG 富集通路信息导入Cytoscape3.7.2,构建“中药-成分-疾病-靶点-通路”网络模型。
1.2.8分子对接 根据“中药-成分-疾病-靶点-通路”网络及PPI网络模型筛选关键药物成分及靶点,利用Chem3D MM2 进行能量最小化结构优化,利用PyMOL 软件移除水分子、无机盐、配体等,通过Autodock软件对筛选出的核心药物成分及核心靶点进行半柔性分子对接预测,利用PyMOL 对对接结果进行可视化处理,并通过R 语言pheatmap 包绘制结合能热图。
2 结果
2.1 溃疡性结肠炎差异表达基因筛选从GEO 数据库下载GSE38713 芯片数据和GPL570 平台数据,借助R语言对数据进行整理分析。最终获得溃疡性结肠炎差异表达基因共8 020 个,其中UC 病人结肠黏膜组织中上调基因3 953 个,下调基因4 067 个,根据UC 差异表达基因筛选结果绘制火山图与热图(图1)。图1A 中每个点代表一个基因,其中红色代表UC 中上调的基因,绿色代表UC 中表达下调的基因。图1B 中横坐标为样本信息,纵坐标为基因名,每一个色块代表基因在该样本的表达量。

图1 溃疡性结肠炎差异表达基因:A为溃疡性结肠炎病人结肠黏膜与正常结肠黏膜差异基因火山图;B为结肠黏膜与正常结肠黏膜差异基因热图
2.2 溃疡性结肠炎差异表达基因加权共表达分析利用函数pick Soft Threshold选择软阈值构建无标度网络(图2),图2 中A 和B 的横坐标为软阈值,纵坐标分别为相关系数和基因连接数的均值,如图2 所示β=14 时相关系数为0.85,基因连接数均值为38.13,因此选择β=14 构建无标度网络。模块特征向量分析中共筛选得到4个加权基因模块(图3),图3 的B 中横坐标代表分组情况,其中蓝色为正常结肠黏膜,红色代表UC 病人的结肠黏膜,纵坐标代表聚类的模块,图中左上角的三角色块代表相关性,右下角三角色块代表显著性,其中青色模块和粉色模块在UC 与正常组的结肠黏膜之间相关性高,所以选取青色模块中的796 个基因和粉色模块中的954 个基因共1 750 个基因用于后续香参丸治疗UC的靶点分析。图3 的C 为青色模块基因与UC 相关性的散点图,可见基因集中于y=x 上,位于图片中央,与UC高度相关。
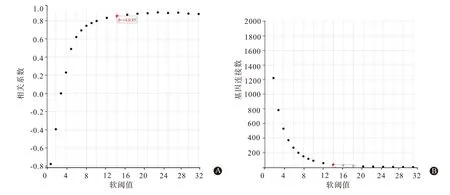
图2 溃疡性结肠炎差异表达基因筛选的散点图:A为软阈值与标度独立性散点图;B为软阈值与标度连通性散点图
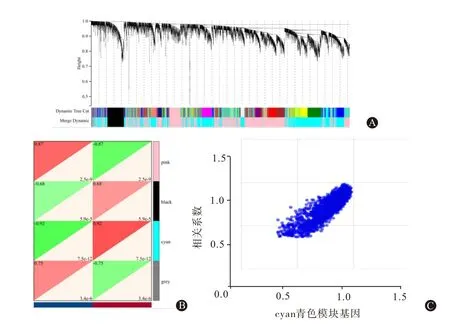
图3 溃疡性结肠炎差异表达基因加权共表达分析:A为加权共表达分析基因聚类树;B为聚类模块与溃疡性结肠炎(UC)相关性热图;C 为cyan青色模块基因与UC相关性散点图
2.3 香参丸主要化学成分的筛选与其靶点的预测以OB≥30%,DL≥0.18 为筛选条件利用TCMSP数据库分别检索“木香”“苦参”以及“甘草”获取有效成分,共得到木香主要有效成分6个,苦参主要有效成分45 个,甘草主要有效成分92 个,经去除重复项后共得到香参丸主要有效成分136 个。利用TCMSP 数据库检索其主要成分相关作用靶点,经去除重复项、UniProt 数据库转化并以“ Reviewed”“ Human”为条件筛选后得到香参丸主要作用靶点243个。
2.4 香参丸与UC 共同作用靶点的获取将UC 的1 750 个靶点与香参丸的243 个活性成分靶点信息绘制成韦恩图(图4),其中左侧圆圈代表香参丸的活性成分靶点,右侧圆圈为UC 的相关靶点,交集部分为香参丸与UC的共同靶点共37个。

图4 香参丸与UC的共同靶点韦恩图
2.5 PPI网络构建将香参丸与UC 的37个共同靶点导入STRING 数据库,物种选择“ Homo Sapiens”,分析得到PPI 网络数据,将数据导入Cytoscape3.7.2软件进行可视化(图5)。该PPI 网络节点的颜色越深、越靠近中心,大小越大代表其度值越高且同一圆圈上的靶点的度值从大到小以逆时针为顺序进行排列。每条边则是代表PPI 网络的关系,线条越多关联度越大。
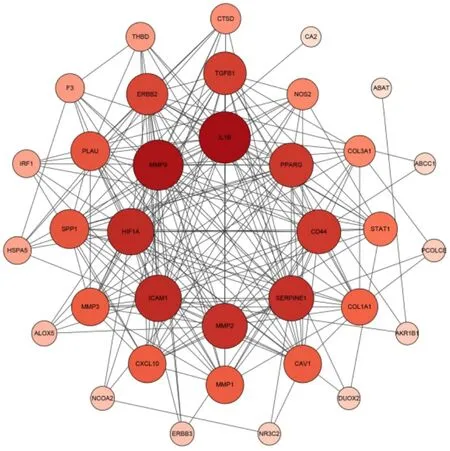
图5 香参丸与溃疡性结肠炎共同靶点PPI网络图
2.6 KEGG 与GO 通路富集分析使用Metascape网站对37 个香参丸与UC 的共同靶点进行KEGG 与GO 通路富集分析。KEGG 富集分析共富集至49 条通路,其中主要的通路包括糖尿病并发症中的AGERAGE 信号通路(AGE-RAGE signaling pathway in diabetic complications)、松弛素信号通路(Relaxin signaling pathway)、TNF 信号通路(TNF signaling pathway)、Toll 样受体信号通路(Toll-like receptor signaling pathway)、HIF-1 信号通路(HIF-1 signaling pathway)以及MAPK 信号通路(MAPK signaling pathway)等(图6)。GO 通路分析包括MF、BP、CC 分析,所有的富集分析按P值大小从小到大进行排序。结果显示GO 富集分析BP共有440条、CC共有28条、MF共有30条,涉及的生物学过程主要有细胞运动的正调节(positive regulation of cell motility)、对损伤反应的调节(regulation of response to wounding)、血管生成调节(regulation of angiogenesis)等。分子功能够涉及丝氨酸型内肽酶活性(serine-type endopeptidase activity)、生长因子的结合(growth factor binding)、核受体结合(nuclear receptor binding)、泛素样蛋白连接酶结合(ubiquitin-like protein ligase binding)等。细胞组分涉及细胞外基质(extracellular matrix)、细胞质的核周区域(serine-type peptidase complex)、内质网腔(endoplasmic reticulum lumen)等(图7)。
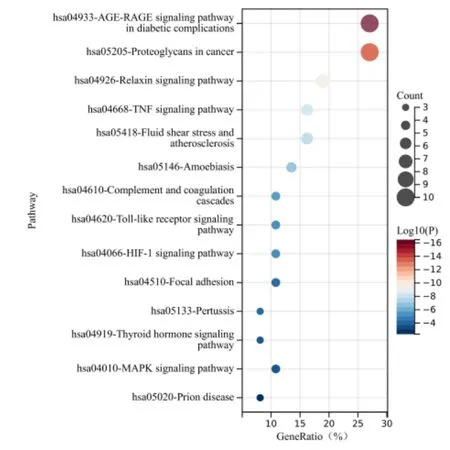
图6 香参丸与溃疡性结肠炎共同靶点KEGG富集气泡图

图7 香参丸与溃疡性结肠炎共同靶点GO富集分析:A为 GO BP分析;B 为GO CC分析;C 为GO MF分析
2.7 “中药-成分-疾病-靶点-通路”网络将香参丸所含的中药、37 个共同作用靶点、含有共同靶点的共90 个成分、KEGG 富集通路导入Cytoscape 3.7.2,构建“中药-成分-疾病-靶点-通路”网络(图8)。其中橙色方块形节点代表香参丸所含的中药,红色菱形节点代表各中药含有的成分,黄色菱形节点代表中药间含有的相同成分,位于网络左侧的三个黄色菱形节点为甘草和苦参的共同成分,位于网络右侧黄色菱形节点为甘草和木香的共同成分。蓝色椭圆形节点为香参丸与UC 的共同作用靶点。绿色三角形节点为KEGG 富集的主要通路。通过Cytoscape 对网络中的中药成分及靶点进行分析得到对应度值,网络度值>4 的中药成分度值排名见表1,主要靶点度值排名见图9。

表1 香参丸治疗UC的主要成分
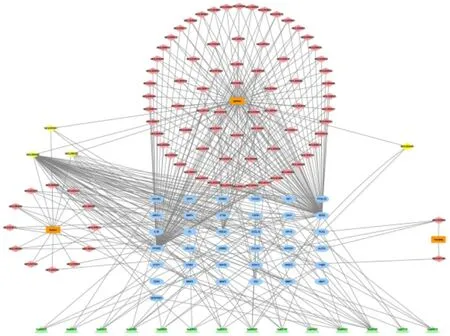
图8 “中药-成分-疾病-靶点-通路”网络图
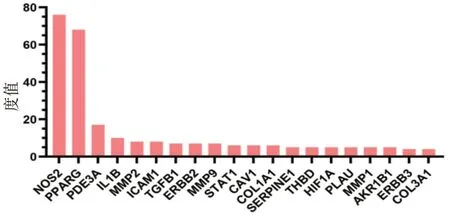
图9 “中药-成分-疾病-靶点-通路”网络靶点度值排序图
2.8 分子对接利用PubChem 及蛋白质结构数据库(protein data bank,PDB)获取小分子配体及蛋白质受体结构文件,利用Chem3D MM2 进行能量最小化结构优化,利用PyMOL 软件移除水分子、配体、无机盐等,通过Cytoscape 对“中药-成分-疾病-靶点-通路”网络进行分析,根据度值大小排序筛选出度值排名前十的化合物和靶点并利用Autodock 进行半柔性对接(具体排序可见表1及图9),后通过火山图对对接结果进行可视化处理,如图10 所示,横坐标代表靶点,纵坐标为化合物,热图中的数字为对接结合能,平均结合能为-5.598 6 kCal/mol,结果显示对接良好。结合能排名前四的对接为MMP2和甘草查尔酮B(Licochalcone B,结能为-7.00 kCal/mol)、PDE3A 和豆甾醇(Stigmasterol,结合能为-6.97 kCal/mol)、MMP2 和刺果甘草查耳酮(glypallichalcone,结合能为-6.92 kCal/mol)、ICAM1 和甘草查尔酮B(Licochalcone B,结合能为-6.66 kCal/mol),结果展示见图11。筛选的核心靶点NOS2、PPARG、PDE3A、IL1B、MMP2、ICAM1、TGFB1、ERBB2、MMP9、STAT1 分别对应的PDB 数据库X 衍射晶体结构ID 为5XN3、8B8Y、7LRE、7Z3W、8H78、3E2M、1KLC、3BCZ、5OM6以及8D3F。
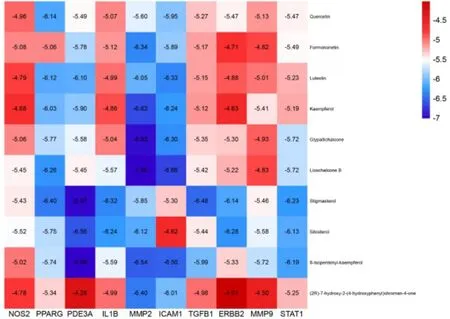
图10 分子对接结合能热图

图11 分子对接图:A为MMP2和Licochalcone B;B为PDE3A和Stigmasterol;C为MMP2和Glypallichalcone;D为ICAM1和Licochalcone B
3 讨论
通过分析香参丸治疗UC 的“中药-成分-疾病-靶点-通路”网络,推测槲皮素(quercetin)、刺芒柄花素(formononetin)、木犀草素(luteolin)以及山柰酚(kaempferol)等成分可能是香参丸治疗UC的主要成分。槲皮素为黄酮醇类化合物,具有抗氧化、抗肿瘤等药理作用[6],而氧化应激是UC发生的重要机制之一[7],减轻肠道炎症以及氧化应激反应则是治疗UC 的重要手段,因此槲皮素已被列为治疗UC 的重要候选化合物之一[8]。Riemschneider 等[9]通过用槲皮素治疗由葡聚糖硫酸钠诱导的UC 小鼠发现槲皮素可以显著改善UC 小鼠的症状以及结肠的组织病理学评分,经槲皮素治疗后小鼠的结肠黏膜上皮炎症细胞的浸润减少且肠上皮屏障可以得到一定程度的恢复。另一项研究表明槲皮素可下调LCN-2、TNF-α抑制炎症介质的表达,从而减轻肠道炎症,发挥治疗UC 的作用[10]。刺芒柄花素是一种异黄酮类化合物,具有抗炎、抗氧化、抗肿瘤、促进细胞凋亡的作用[11-12]。Wu 等[13]通过研究证实刺芒柄花素可通过抑制NLRP3 炎性小体通路(NLRP3、ASC、IL-1β等)蛋白水平,并上调紧密连接蛋白(ZO-1、claudin-1等)治疗经DSS 诱导的急性结肠炎。杨倩等[14]给予UC 小鼠刺芒柄花素后,结肠的TNF-α、IL-6 以及COX-2 的含量都出现明显下降,并通过基因敲除等技术推测刺芒柄花素可能通过激活Nrf2 的表达来改善UC 的症状。木犀草素和山柰酚与槲皮素一样也是黄酮类化合物,李越、沈磊[15]发现木犀草素可以显著降低UC 小鼠疾病活动指数评分(DAI),其机制可能与激活Nrf2信号通路、抑制促炎因子TNF-α、IL-6 mRNA 等表达有关 。Andrade 等[16]证实山柰酚和槲皮素可下调NF-κB 与Toll 样受体的表达,使促炎、趋化因子及细胞黏附分子减少,改善肠道损伤、减少肠道的氧化应激反应和炎症细胞的浸润。
结合PPI 网络和“中药-成分-疾病-靶点-通路”网络,推测NOS2、PPARG、IL1B、MMP2 以及ICAM1等是香参丸治疗UC 的靶点。有研究表明NOS2 编码的诱导型一氧化氮合酶(iNOS)在UC 病人的结肠黏膜上被显著上调[17],研究表明iNOS 在炎症性疾病中发挥着重要作用,其机制可能与超氧阴离子相互作用生成过氧亚硝酸盐破坏肠上皮有关[18-19]。Bernstein 等[20]则证实抑制NOS2 可以减轻肠道炎症,所以NOS2 可能是治疗UC 的重要靶点。PPARG为过氧化物酶体增生激活受体,可以激活结肠上皮细胞的线粒体增加耗氧量,使结肠黏膜上皮缺氧坏死并破坏肠道菌群稳态[21-22],Stephanie 等[23]研究表明5-氨基水杨酸可能通过激活肠上皮中的PPAR-γ发挥治疗UC 的作用,其机制可能与PPARG 抑制NF-κB 活化[24]和肠黏膜中前列腺素的产生[25]有关。IL1B 即为IL-1β,为促炎细胞因子之一,已有许多研究表明其存在与肠道炎症关系密切[26-27]。Rawat等[28]证实IL1B 可以上调MIR200C-3p 从而增加肠黏膜的紧密连接降低肠细胞occludin 蛋白的表达,从而增加紧密连接的通透性。
KEGG 富集分析中主要富集在TNF 信号通路、Toll 样受体信号通路、HIF-1 信号通路以及MAPK 信号通路等。TNF 称为肿瘤坏死因子,是参与NF-κB通路的重要转录调节因子,而NF-κB 信号通路已被证实是参与UC 发生发展的重要通路之一[29-30]。有研究表明NF-κB 信号通路可在UC 的肠固有层中的单核细胞中被激活,参与UC炎症的产生[31],目前UC的主要治疗药物柳氮磺胺吡啶和糖皮质激素的作用机制之一就是抑制NF-κB 信号通路的表达[32]。“中药-成分-疾病-靶点-通路”网络分析得到的关键成分如槲皮素、山柰酚、刺芒柄花素等都能通过调节核因子NF-κB 的表达来抑制肠道炎症反应减少肠道损伤[14,16]。关键靶点PPARG 也被证实可以抑制NF-κB 活化[24],且NF-κB 信号通路的激活则会通过LPS/IFN-γ 或IL-1β/IFN-γ 诱导关键靶点iNOS 的表达[33],所以富集得到的TNF 信号通路与筛选出的关键成分、关键靶点相吻合。Toll 样受体(toll-like receptor,TLR)是一种跨模信号转运蛋白,参与人体免疫、炎症反应。有研究表明TLR 可以与相应的配体结合,激活TLR-NF-κB 信号通路,介导IFN-γ、TNF、IL-1β 等因子的释放[34],目前研究认为TLR4/NF-κB 信号通路是UC 发生发展的重要信号通路之一,且如山柰酚等香参丸的关键成分也可作用于TLR4/NF-κB信号通路发挥对结肠的保护作用[35],所以Toll 样受体信号通路可能是香参丸作用于UC 的潜在通路。缺氧诱导因子HF-1 在缺氧状态下可被诱导产生,活化后可形成HF-1α 介导炎症、氧化应激等反应。苏淑伶等[36]表明HIF-1α、COX-2 等因子水平与UC 病情严重程度呈正相关,可为临床诊断及临床治疗评估提供可靠依据。Tang 等[37]则研究证实HF-1α 可激活NF-κB 信号通路,从而介导NLRP3炎症小体产生,引起一系列级联炎症反应,所以HIF-1 信号通路与TNF 信号通路息息相关。如今,MAPK 信号通路在IBD 中的作用已被许多研究所证实,成为研究治疗IBD 的经典通路之一[38-39]。在UC中MAPK 信号通路可以调控下游的能调控下游的NF-κB 信号通路,介导TNF-α、IL-6、IL-1等炎症因子的释放、嗜中性粒细胞活化和细胞凋亡,诱导细胞内NO的表达,提高细胞内INOS活性[40-41]。
综上所述,香参丸主要成分槲皮素、刺芒柄花素、木犀草素以及山柰酚等可能通过TNF 信号通路、Toll 样受体信号通路、HIF-1 信号通路以及MAPK 信号通路作用于NOS2、PPARG、IL1B、MMP2以及ICAM1等靶点发挥治疗UC的作用。
