基于硫化钠的垃圾焚烧飞灰EDTA提取液中重金属回收试验研究*
2024-04-23邹威亮陈欣宇李斯宇邓跃全
曾 洁,邹威亮,陈欣宇,李斯宇,叶 刚,李 敏,吴 昊,邓跃全
(西南科技大学 材料与化学学院,四川 绵阳 621010)
0 引言
我国生活垃圾的处理方式主要有填埋和焚烧,年焚烧量高达1.460 76亿t[1],在焚烧过程中将产生15%~20%的垃圾焚烧飞灰(简称“飞灰”)[2]。因飞灰中重金属、二噁英和可溶性盐类严重超标,现已被列入《国家危险废物名录》[3]。重金属主要来自生活垃圾中废弃的电器、电池、化学溶剂、彩色报纸等,尤其是废电池中Cd、Pb含量较高,焚烧后部分重金属转移至飞灰中[4],飞灰中重金属质量分数可达0.5%~3%[5]。
目前,主要采用熔融及螯合剂+水泥固化两种方式处理飞灰中的重金属[6]。熔融处理成本约为2 000~3 000 元/t,飞灰中重金属经高温熔融后形成熔融玻璃体,从而实现对重金属的固化,但其处理费用高,固化体堆放占地面积大;螯合剂+水泥固化的处理成本约为500~700 元/t[7],其是通过化学药剂螯合和水泥固化将飞灰中的重金属固化及稳定化。当飞灰进入填埋场后或资源化利用时,会因为螯合剂老化失效[6],经暴雨冲淋后,其中的重金属会直接释放到土壤、地表水和地下水中,再通过食物链进入生物体内并不断富集,从而对生态环境和人体健康造成危害。
本文将乙二胺四乙酸(EDTA)与飞灰进行球磨反应,使EDTA与飞灰中的Cd、Cu、Cr、Pb和Zn重金属离子形成稳定的、易溶于水的络合物,经固液分离后,所得飞灰解毒渣可用于制备砂浆和墙板[8];液相即为飞灰EDTA提取液,针对该提取液,利用硫化钠回收其中的重金属,探讨了硫化钠用量对重金属回收率的影响,并对获得的重金属回收渣成分及回收效果进行了分析。
1 试验部分
1.1 原料、试剂及仪器设备
1.1.1 原料
飞灰取自绵阳中科绵投环境服务有限公司,其主要化学组成见表1。

表1 飞灰的主要化学组成
将飞灰和水按质量比1∶1混合,再按总物料质量的0.2%投入EDTA,球与总物料的质量比为4∶1,球磨至反应完全,采用离心法进行固液分离,过滤得到飞灰EDTA提取液,各重金属和其他离子的质量浓度见表2、表3。

表2 飞灰EDTA提取液处理前的重金属质量浓度
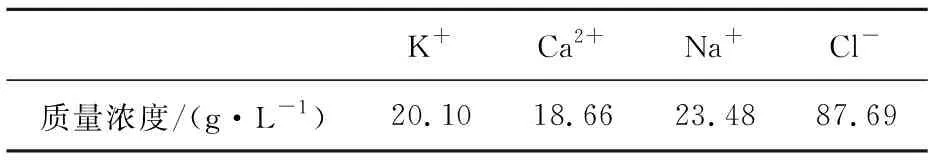
表3 飞灰EDTA提取液处理前的其他离子质量浓度
1.1.2 试剂与仪器
九水硫化钠,分析纯,成都鼎恒达化工产品有限公司;30%过氧化氢、浓硝酸,分析纯,成都市科隆化学品有限公司;EDTA,分析纯,成都市联合化工试剂研究所;AA700型原子吸收光谱仪,美国珀金埃尔默股份有限公司;X’Pert PRO型X射线衍射仪,荷兰帕纳科公司;BS-3000L型电子天秤,启东友铭衡器有限公司;DF-101S集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;GQM-2-5实验室滚筒球磨机,长沙天创粉末技术有限公司;80-2型离心器,常州澳华仪器有限公司;PHS-320型酸度计,成都世纪方舟科技有限公司。
1.2 试验方法
1.2.1 5%Na2S的配制
称取76 g九水硫化钠于烧杯中,加入蒸馏水溶解,将其倒入500 mL容量瓶中,定容至刻度线。
1.2.2 飞灰EDTA提取液中重金属的沉淀分离
将一定量的5%Na2S母液缓慢加入1 L飞灰EDTA提取液中,同时在磁力搅拌器上搅拌至反应完全,再抽滤,获得滤液和重金属回收渣。
1.2.3 滤液成分分析
采用火焰原子吸收光谱法(FAAS)检测滤液中Cd、Cu、Cr、Pb、Zn的含量。
1.2.4 重金属回收渣的成分分析
利用X射线衍射仪对重金属回收渣进行成分分析。称取0.2 g重金属回收渣,加入5.00 mL浓硝酸,在加热炉上保持微沸状态,滴加30%H2O2[9],然后不断补入硝酸和30%H2O2,在磁力搅拌器上缓慢搅拌至反应完成,静置后进行普通过滤,滤液移至50 mL容量瓶中定容,采用火焰原子吸收光谱法检测样品中Cd、Cu、Cr、Pb、Zn的含量。
2 结果与讨论
2.1 理论计算
飞灰EDTA提取液体系中的重金属离子Cd2+、Cu2+、Pb2+和Zn2+既与EDTA形成MY2-络合物,也与硫化钠反应形成重金属硫化物MS。飞灰EDTA提取液体系中pH通常在9~12,Na2S沉淀反应涉及的固化化学平衡反应式有
M2++Y4-MY2-,
(1)
M2++S2-MS,
(2)
式中:M代表Cd、Cu、Pb、Zn,以M二价作后续推演;Y4-为EDTA;MY2-为金属络合物。
式(1)的络合平衡常数K稳表示为
(3)
式(2)的溶度积平衡常数Ksp表示为
Ksp=[M2+][S2-]。
(4)
用式(2)减式(1)得到重金属与S2-的反应关系式:
MY2-+S2-→Y4-+MS↓。
(5)
式(5)的平衡常数K为
(6)
平衡常数K表示平衡进行程度,一般认为K>105时反应较完全,10-5

表4 不同重金属反应的平衡常数K
由表4可知:Cd、Cu、Pb平衡常数K分别为4.33×109、2.64×1016和1.14×109,均远大于105,表明反应完全;Zn平衡常数K接近105,说明反应较完全;S2-从溶解性重金属配合物中夺取重金属离子而形成CdS、CuS、PbS、ZnS等金属硫化物沉淀。
1)酸度的影响
飞灰EDTA提取液体系中pH通常为9~12,酸度的变化一方面会触发EDTA的酸效应,另一方面会涉及S2-的水解平衡问题。
由酸度变化引起Y4-平衡浓度发生改变的现象称为EDTA的酸效应,通常用αY(H)来表示EDTA的酸效应系数:
(7)
不同pH下的EDTA酸效应系数见表5。
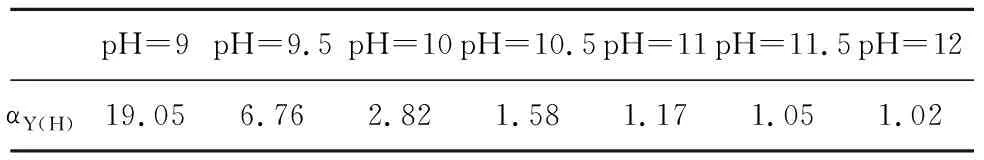
表5 不同pH下EDTA酸效应系数[11]
酸碱平衡体系中,S2-的浓度随着酸度的变化而变化,溶液中某酸碱组分的平衡浓度占其总浓度的分数称为分布系数。在该反应体系中S2-分布系数δ0为:
(8)
由解离常数表可知H2S的Ka1= 1.07×10-7,Ka2= 1.26×10-13,不同pH下,根据式(8)可算得对应的δ0值(见表6)。

表6 不同pH下的δ0值
反应体系采用5%Na2S溶液,即cS2-=0.641 mol/L,则S2-的有效浓度为
[S2-]=δ0c。
(9)
由式(6)、式(7)得
(10)
不同pH下,反应体系cEDTA=10-3mol/L,根据式(10)可算得重金属与EDTA络合物的浓度[MY2-],结果见表7。

表7 不同pH下的[MY2-] 单位:mol/L
由表7可知:pH在9~12时,MY2-络合物的浓度均低于1.0×10-5mol/L,且随着pH的升高而降低,说明飞灰EDTA提取液中的Cd2+、Cu2+、Cr3+、Pb2+和Zn2+重金属离子能与S2-反应形成MS硫化物沉淀,从而实现重金属的沉淀分离。
2)钙离子对硫离子固化重金属的影响
生活垃圾焚烧设施的烟气净化系统一般采用烟气捕集剂石灰乳收集飞灰,其中含有较多的Ca2+,飞灰经解毒后,有少部分Ca2+进入飞灰EDTA提取液中,而S2-与Ca2+生成的CaS微溶于水,其稳定性远低于CdS、CuS、PbS、ZnS沉淀,故S2-优先与Cd2+、Cu2+、Pb2+、Zn2+重金属离子反应,Ca2+不会影响S2-沉淀重金属。
3)Cr3+在飞灰EDTA提取液体系中的状况分析
已有研究表明,Cr3+不会与S2-反应形成硫化物沉淀。当pH=9~12时,Cr3+与EDTA发生络合反应,与OH-发生沉淀反应,反应式为
Cr3++Y4-CrY-,
(11)
Cr3++3OH-Cr(OH)3。
(12)
式(11)的络合平衡常数K稳表示为
(13)
式(12)的溶度积平衡常数Ksp表示为
Ksp=[Cr3+][OH-]3。
(14)
用式(12)减式(11)得到重金属与S2-的反应关系式:
CrY-+3OH-→Y4-+Cr(OH)3↓。
(15)
式(15)的平衡常数K为
(16)
根据式(16)计算式(15)的平衡常数K,结果见表8。
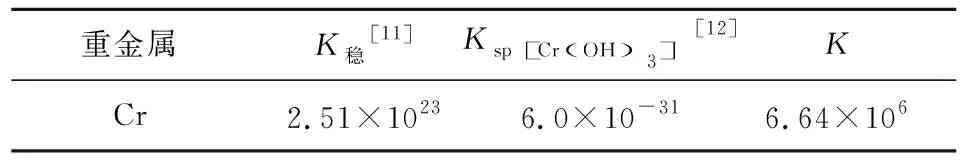
表8 Cr在反应体系中的平衡常数K
由表8可知,标准情况下,式(15)的平衡常数K= 6.64×106>105,反应是可以进行的。但实际情况下,酸度和浓度对其有着重要影响。
由式(13)得:
[CrY-]=K稳[Y4-][Cr3+]。
(17)
由式(14)得:
[Cr3+]=Ksp[Cr(OH)3]/[OH-]3。
(18)
由式(7)得:
(19)
将式(18)、式(19)代入式(17)得:

(20)
不同pH下,设反应体系cEDTA=10-3mol/L,根据式(20)和表2可算得Cr3+与EDTA络合物的浓度[CrY-],结果见表9。

表9 不同pH下的[CrY-] 单位:mol/L
由表9可知,用EDTA提取飞灰重金属的过程中,酸度对Cr3+的形态分布影响显著,要使Cr3+以Cr(OH)3沉淀形式存在,pH应大于11,大部分Cr3+进入飞灰解毒渣中,少部分存在于滤液中;pH小于11时,Cr3+主要以CrY-形式存在并进入滤液中。
2.2 Na2S加入量对飞灰EDTA提取液中重金属回收率的影响
处理飞灰EDTA提取液时,控制5%Na2S加入量分别为30、40、50、60、70 mL,考查Na2S用量对飞灰EDTA提取液中重金属回收率的影响,结果见表10、图1。

图1 5%Na2S用量对飞灰EDTA提取液中重金属回收率的影响
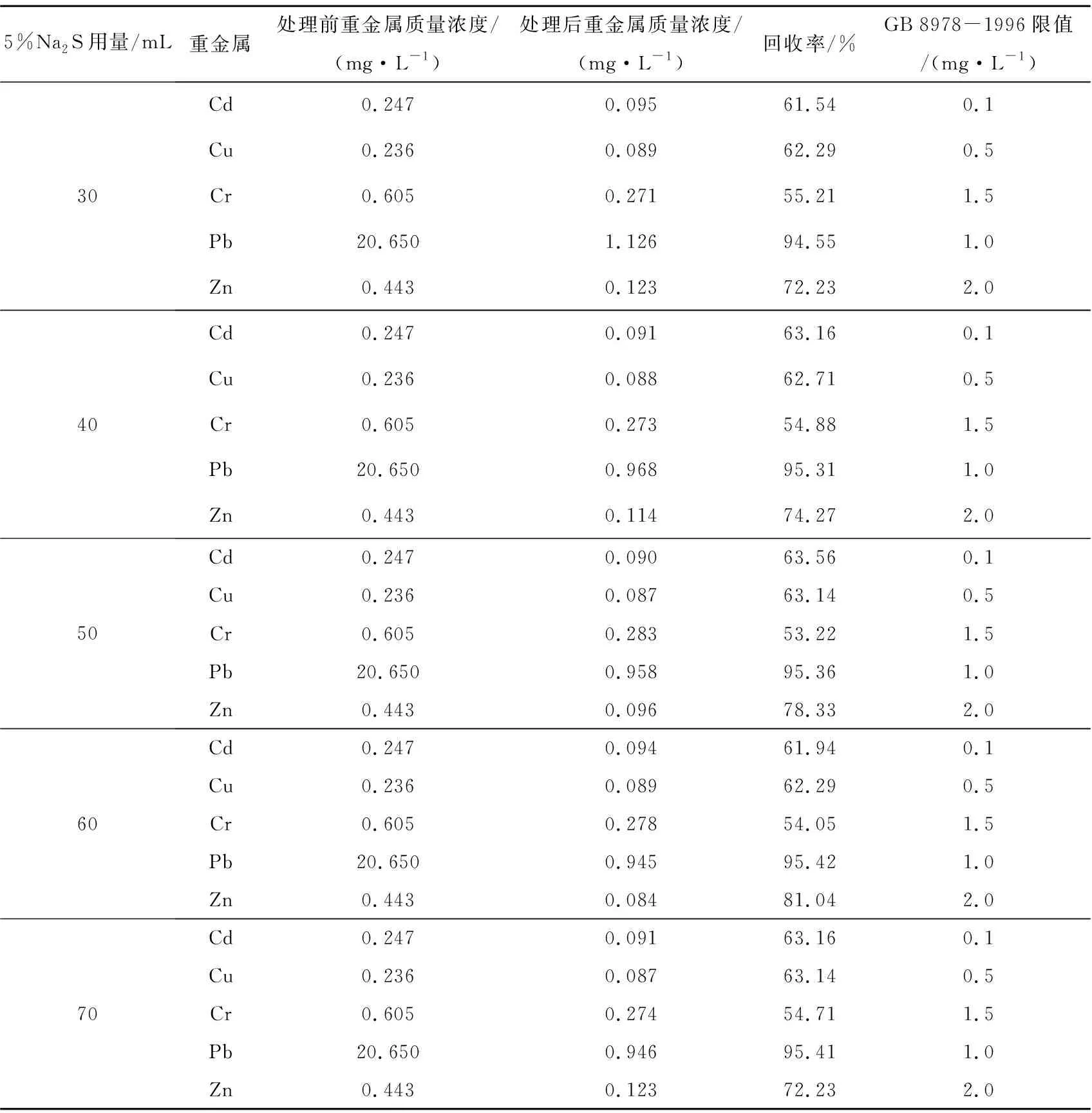
表10 硫化钠用量对飞灰EDTA提取液中重金属的影响
由表10可知:提取液处理前,Cd、Pb浓度超出标准GB 8978-1996限值,尤其是Pb超出了限值的20倍;Cu、Cr和Zn的浓度较低,未超标。处理1 L提取液,当投入40 mL 5%Na2S时,浓度较高的Pb回收率达95.31%,而浓度较低的Cd、Cu、Zn和Cr的回收率分别为63.16%、62.71%、66.37%和54.88%,处理后的提取液中各重金属浓度均低于标准限值。提取液处理前的pH为11.69,当投入40 mL 5%Na2S处理后,其pH为12.20,此时Cr3+不与S2-反应。
而由图1可知,滤液中Cr3+的回收率为54.88%,主要是由于Cr3+通过包藏、吸附等方式被其他重金属硫化物共沉淀进入重金属回收渣,从而实现Cr3+的分离回收。一般而言,垃圾焚烧飞灰中的Cr不超标[13],不会影响飞灰的整体处理。
由图1可知,随着Na2S用量的增加,各重金属回收率总体上变化不大,处理1 L提取液,5%Na2S的适宜投入量为40 mL。
2.3 重金属回收渣成分分析
2.3.1 X射线衍射分析(XRD)
用X射线衍射仪对重金属回收渣进行成分分析,结果见图2。由图2可知,重金属回收渣中含有铅的硫化物,其余重金属由于含量极低,未发现其衍射峰,其他主要组分有Ca(OH)2、CaCO3、NaCl等。
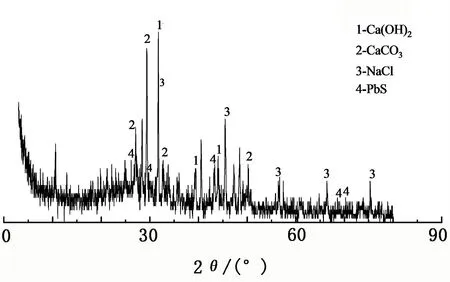
图2 重金属回收渣的XRD图谱
2.3.2 重金属的火焰原子吸收光谱(FAAS)
对重金属回收渣进行重金属浸出试验,采用火焰原子吸收光谱法检测样品中Cd、Cu、Cr、Pb、Zn的含量,通过计算得到重金属质量浓度、硫化物质量分数和氧化物质量分数(见表11)。
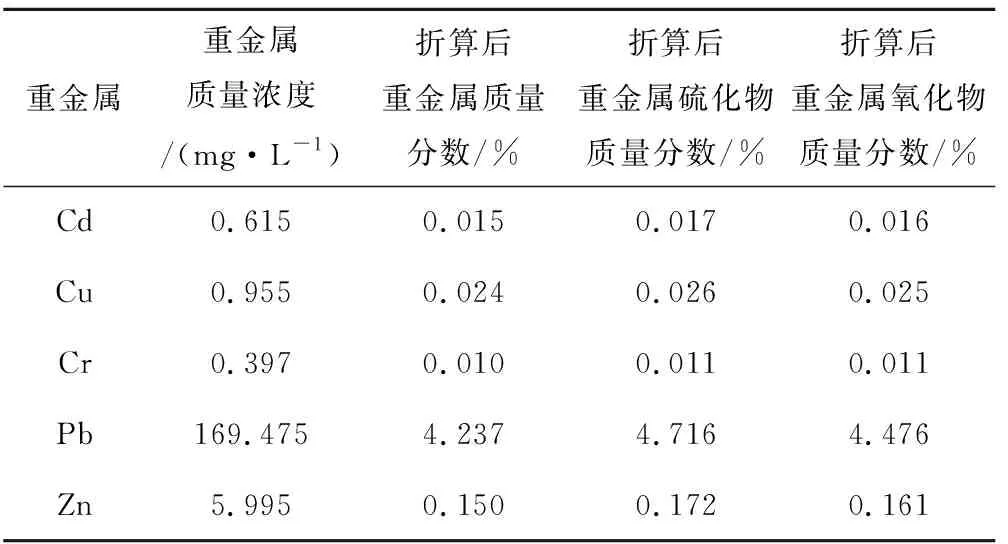
表11 重金属回收渣中重金属质量分数
由表11可知,飞灰提取液处理后所得重金属回收渣中的铅含量很高,其折算后重金属、重金属硫化物和重金属氧化物的质量分数分别为4.237%、4.716%和4.476%,而其他重金属质量分数均低于0.2%。根据《矿产工业要求参考手册》的规定,原生铅锌矿的最低边界品位为ω(Pb)=0.3%~0.5%,最低工业品位为ω(Pb)=0.7%~1%,氧化矿的最低边界品位为ω(Pb)=0.5%~1%,最低工业品位为ω(Pb)=1.5%~2%[14],重金属回收渣的铅含量不仅超过原生铅锌矿Pb最低工业品位的4倍,也超过了其氧化矿最低工业品位的2倍,可见其铅含量非常高,可为炼铅提供原料,从而将重金属回收渣“变废为宝”。
3 结论
a.理论计算结果表明,在pH为9~12的体系中,S2-能从溶解性重金属配合物中夺取Cd2+、Cu2+、Pb2+和Zn2+重金属离子而形成金属硫化物沉淀,Ca2+不会影响S2-沉淀重金属。
b.每处理1 L提取液,5%Na2S的适宜用量为40 mL,Na2S用量对各重金属的回收率总体上影响不大。提取液处理前,Cd、Cu、Zn和Cr的质量浓度较低,Cd、Pb质量浓度超标,尤其是Pb超出了标准限值的20倍;对Pb的回收效果最为显著,其回收率高达95.31%,Cd、Cu、Zn和Cr的回收率分别为63.16%、62.71%、66.37%和54.88%;处理后,提取液中各重金属质量浓度均符合GB 8978-1996要求;Cr3+虽然不与S2-反应,但通过包藏、吸附等方式被其他重金属硫化物共沉淀进入重金属回收渣,从而实现Cr3+的分离回收。
c.重金属回收渣中,铅质量分数高达4.237%,Cd、Cu、Cr和Zn质量分数均低于0.2%,其中铅含量是原生铅锌矿Pb最低工业品位的4倍多以及铅氧化矿最低工业品位的2倍多,故该重金属回收渣能作为一种产铅资源,从而实现资源的循环利用。
d.本工艺简单、实用性强,有效实现了飞灰EDTA提取液的达标排放和重金属回收,回收得到的重金属回收渣可以作为炼铅资源,从而为垃圾焚烧飞灰EDTA提取液的综合利用提供了一条新途径。