老年肝癌病人经肝动脉化疗栓塞术联合仑伐替尼治疗的疗效及安全性分析
2024-04-22孔杰姜锐刘正立何旭赵伯翔公茂峰王小平陆照璇顾建平张磊
孔杰 姜锐 刘正立 何旭 赵伯翔 公茂峰 王小平 陆照璇 顾建平 张磊
原发性肝细胞癌(hepatocellular carcinoma, HCC)是一种恶性肿瘤,起源于肝细胞,常见于老年人群。近年来,全球范围内HCC的发病率和死亡率均呈上升趋势[1]。HCC病人的预后不佳,其中高复发率、高转移率和高恶性程度是重要原因[2-3]。其治疗方法包括手术切除、化学治疗、靶向治疗以及经肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)等[4]。TACE是介入性治疗方法,常用于治疗HCC。通过经股动脉穿刺进入肝动脉,将化疗药物注入肝癌动脉供应区,增加病灶内化疗药物浓度,减少系统性毒性。但该方法也会对病人的肝脏造成损伤,因为它既能杀死肝癌细胞,也会破坏正常肝组织,导致肝功能异常。TACE是治疗晚期HCC病人的常见手段之一,但其治疗效果并不理想。肿瘤细胞具有较高的代谢活性,当其面临低氧缺血状态时,会启动一系列恢复血管供应的反应,促进肿瘤内新生血管形成,是TACE治疗效果不佳的主要原因之一[5]。仑伐替尼是一种新型分子靶向药物,能有效抑制肿瘤增殖和新生血管生成,用于肝癌的一线治疗[6]。然而,目前关于老年HCC病人联合应用TACE和仑伐替尼的研究尚不多见。因此,本研究旨在探讨TACE联合仑伐替尼治疗老年HCC病人的有效性和安全性,现报道如下。
1 资料与方法
1.1 临床资料 选择2018年6月至2020年8月就诊于南京市第一医院的139例老年中晚期HCC病人为研究对象。纳入标准:(1)年龄>60岁,按照巴塞罗那临床肝癌分期体系(BCLC)为中晚期(B/C期)病人;(2)根据Child-Pugh分级标准,肝功能为A级或B级;(3)美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分≤2分;(4)依据改良实体瘤疗效评估标准(mRECIST),要求至少能够观察到一个可测量的病灶,以便进行实体瘤的评估。排除标准:(1)合并其他原发性恶性肿瘤的病人;(2)临床资料不完整的病人;(3)存在较多基础性疾病的病人,如严重肾功能不全、心功能不全、感染等;(4)口服药物无法控制的高血压病人;(5)在30 d内有消化道出血或经历过大手术的病人;(6)正在联用其他具有抗肿瘤作用的药物的病人。按照治疗方式分为TACE组和TACE+仑伐替尼组。入组病人HCC的诊断及分期均参照2022年中国肝细胞癌临床指南和亚洲HCC管理临床实践指南[7-8]。2组病人各项基线指标比较,除了ALT、AST、总胆红素和凝血酶原时间,其他指标差异均无统计学意义(P>0.05),见表1。

表1 2组病人基线资料比较(n,%)
1.2 治疗方法 TACE组给予单纯TACE治疗。手术中,通过经股动脉插管,以RH导管经腹主动脉将导管头端置入腹主动脉,然后逆时针旋转导管将导管头端超选至肝动脉,注入碘克沙醇对比剂,明确肝癌部位、大小、血供及数目等信息;随后,将盐酸表柔比星30 mg、洛铂50 mg及适量碘化油混合剂注入到肿瘤供血动脉内,并利用Embosphere栓塞微球对供血动脉进行栓塞。TACE+仑伐替尼组病人在结束TACE手术后的第3~5天开始口服甲磺酸仑伐替尼胶囊8~12 mg/次,1次/d。为了减轻手术后的不适感,常规给予止吐、抑酸、护肝等对症治疗。术后3 d复查血常规及生化指标,术后4周再次进行腹部增强CT检查,以评估肝癌病变的变化情况。
1.3 观察指标 本研究运用mRECIST评估标准来进行肿瘤疗效评估。完全缓解(CR):靶向病灶无肝动脉期增强;部分缓解(PR):靶向病灶在动脉期增强扫描中的直径总和缩小≥30%;疾病进展(PD):动脉期强化的病变直径总和比原始水平至少增大20%,或者有新的病变出现;疾病稳定(SD):靶向病灶的变化介于PR和PD之间。客观缓解率=(完全缓解人数+部分缓解人数)/总病人数×100%。疾病控制率=(完全缓解人数+部分缓解人数+疾病稳定人数)/总病人数×100%。无疾病进展时间(PFS)定义为病人开始自主治疗至发现肿瘤进展的时间,或者随访丢失或死亡时间;总生存期(OS)定义为病人开始自主治疗至最后一次随访或死亡。不良反应的评价按照常见的不良事件等级表(CTCAE 4.0)进行分级,共分为1~5级。
1.4 随访方法 所有病人均要求术后4周再次进行腹部增强CT检查,根据CT结果评估治疗效果并指导进一步治疗,未能定期随访的病人采用电话随访,电话随访每3个月一次。
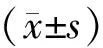
2 结果
2.1 2组病人肿瘤控制情况比较 TACE组和TACE+仑伐替尼组的CR、PR、PD、SD人数分别为6、9、10、9例和13、24、8、9例。2组的疾病控制率分别为38.1%和60.1%,差异有统计学意义(P=0.013)。2组的客观缓解率分别为23.8%和43.7%,差异有统计学意义(P=0.004)。
2.2 2组生存情况比较 TACE组的中位PFS为7.5个月(95%CI:6.7~11.1),TACE+仑伐替尼组的中位PFS为12.5个月(95%CI:10.5~15.3),2组HR=0.37(95%CI:0.23~0.60),差异有统计学意义(P<0.001)。TACE组的中位OS为9.6个月(95%CI:9.3~14.6),中位随访时间为11.5月,死亡29例(46.0%),失访7例(11.1%)。TACE+仑伐替尼组的中位OS为15.8个月(95%CI:13.6~18.3),中位随访时间为18.5月,死亡22例(28.9%),失访6例(7.9%),2组HR=0.40(95%CI:0.23~0.71),差异有统计学意义(P=0.002)。见图1、图2。

图1 2组HCC病人PFS的Kaplan-Meier曲线图

图2 2组HCC病人OS的Kaplan-Meier曲线图
2.3 2组病人不良反应分析 TACE组和TACE+仑伐替尼组术后均出现不同程度的不良反应,仑伐替尼相关的并发症为手足皮肤反应、高血压、腹痛、头痛、疲劳、咳嗽、蛋白尿、声音嘶哑及口腔溃疡,其中手足皮肤反应、高血压、腹泻及疲劳发生率在2组间差异均有统计学意义(P<0. 05)。2组病人的并发症经过对症治疗后都得到了有效的控制。在治疗过程中,未发生任何3级及以上的不良反应。见表2。

表2 2组病人随访过程中的并发症发生率比较(n,%)
3 讨论
HCC是全球范围内最常见的恶性肿瘤之一,其死亡率高、生存率低。由于老年HCC的发病隐匿且进展较快,常常在确诊时已经晚期,失去了手术机会。在目前可用的肝癌治疗方法中,TACE被广泛应用于晚期肝癌病人的治疗[9]。然而,TACE治疗仍存在很多问题,例如治疗效果不理想、容易发生不良反应等。其原因可能是TACE治疗会造成局部缺氧环境,从而促进肿瘤血管再生,提高了HCC的复发率和转移率[10]。
研究表明,在TACE基础上加用抑制血管再生药物治疗,可以有效降低复发率和抑制肿瘤转移[11]。2018年在中国批准上市的新型分子靶向药物——仑伐替尼,可以抑制血管再生,为肝癌的治疗提供了新的选择[12-13]。该药物的作用机制广泛,包括抑制血小板衍生生长因子受体、血管内皮生长因子受体、成纤维细胞生长因子受体等,目前已成为肝癌的一线治疗药物[14]。仑伐替尼可以有效地抑制TACE治疗后诱发的促肿瘤血管生成因子的分泌,在缩小肿瘤的同时,抑制肿瘤的复发和转移[15-16]。本研究发现,TACE+仑伐替尼组的病人治疗后疗效更为显著,客观缓解率和疾病控制率均优于TACE组,差异有统计学意义。这可能和TACE直接将化疗药物注入肿瘤的供血动脉,促使肿瘤组织缺血缺氧而起到抗肿瘤作用,并结合仑伐替尼抑制新生血管生成的作用,弥补了TACE的缺陷,从而提高了治疗效果,改善了预后。
恶性肿瘤细胞具有无限增殖的特性,这是区别良、恶性肿瘤的最大特征。老年HCC病人常常伴有肝功能受损。本研究中,TACE+仑伐替尼组术前的胆红素水平和凝血酶原时间高于TACE组,白蛋白水平2组间差异无统计学意义。TACE会阻断肝动脉对肝脏的血供,加重肝组织缺血,从而影响肝功能。而联合使用仑伐替尼治疗可以抑制肝癌细胞增殖和分化,缓解肝功能恶化。仑伐替尼的常见不良反应包括蛋白尿、腹泻等[17],本研究中TACE+仑伐替尼组的手足皮肤反应、腹泻及疲劳发生率均高于TACE组(P<0.05)。然而,2组病人的并发症经过对症治疗后都得到了有效的控制,并未出现严重的不良反应。由于仑伐替尼在国内上市时间较短,本研究样本量较少且观察时间较短,因此仍需进一步深入研究并长期随访以证实。
总体而言,仑伐替尼联合TACE治疗老年HCC可延长生存时间、抑制肿瘤进展,且联合治疗未观察到严重不良反应发生。因此,可以考虑在临床实践中进一步开展联合治疗。
