电针对反复丙泊酚暴露大鼠炎症反应的影响
2024-04-22王喜军范舜钦
王喜军,高 宁,范舜钦
1.广西中医药大学附属国际壮医医院,广西 南宁 530201;2.广西中医药大学,广西 南宁 530200
丙泊酚作为一种静脉麻醉药,具有诱导时间短、起效快、恢复时间短和降低脑氧耗等[1]优点,是一种临床常用的静脉全麻药物,通常用于小儿麻醉的诱导和维持,已经在临床工作中被广泛使用。有研究表明,单次接触丙泊酚麻醉对新生大鼠大脑神经发育无明显影响,且能够缓解手术创伤所造成的幼鼠中枢炎症反应[2-3]。但反复接受丙泊酚麻醉可引起中枢炎症介质释放增多,产生神经炎症反应,由此产生的神经回路结构改变可导致神经功能认知障碍[4],术后对患者的生活造成不良影响。针灸“治未病”已有悠久的历史,可激发人体内的正气,增强抗病能力,防止疾病的发生发展[5]。电针是传统针灸与现代电刺激相结合的产物,它是指在毫米针具上接通与人体生物电相似的脉冲电流,利用针、电双重刺激,调节经络之气以达到防止疾病的目的[6]。2003年,动物实验首次证实重复电针刺激百会穴可以减轻脑缺血后神经受损程度,发挥脑保护效应[7]。目前已有研究表明,电针能够降低脑缺血再灌注损伤大鼠模型脑组织中炎症因子IL-1β、IL-6的表达[8]。电针大椎、百会减轻神经炎症的效果明显[9-10]。因此,本研究观察电针干预对反复丙泊酚暴露大鼠炎症反应的影响,以期为临床麻醉后的重要器官功能保护提供参考。
1 材料与方法
1.1 实验动物及分组
10日龄健康SD大鼠40只(雌雄各半,体质量26~28 g)购自广西医科大学实验动物中心(实验动物许可证号:SCXK[桂]2014-0002)。实验动物于普通动物房饲养,温度24 ℃,相对湿度60%~70%。每天8:00—20:00日光灯照明,模拟12 h/12 h的白昼比例。本研究所有动物实验取得了广西中医药大学伦理委员会的许可(审批号:DW20230313-036)。
1.2 试剂与仪器
1.2.1 试剂 丙泊酚注射液(四川国瑞,批号:22120212);兔抗IL-6(1:1 000,A0286,Servicebio,China);兔抗TNF-α(1:1000,A0277,Servicebio,China);兔抗β-actin(1:1000,GB11001,Servicebio,China);兔抗HMGB1(1:1000,GB11103,Servicebio,China);兔抗Iba-1(1:1 000,GB11105,Servicebio,China)。
1.2.2 仪器 一次性无菌针灸针(华佗牌);SDZ-Ⅱ华佗牌电针仪(苏州医疗用品有限公司)。
1.3 分组与干预方法
采用随机数字表法将其分为5组(每组8只):生理盐水对照(C)组,腹腔注射生理盐水100 μL;脂肪乳剂(F)组,腹腔注射脂肪乳剂100 μL;电针(E)组,选取大鼠“百会穴”“大椎穴”进行电针刺激;丙泊酚(P)组,腹腔注射异丙酚100 mg/kg;电针+丙泊酚(EP)组,先给予丙泊酚(同P组),后电针干预(同E组)。
1.3.1 电针方法 电针的穴位选取百会穴(顶骨正中、两耳连线中点),大椎穴(第7颈椎与第1胸椎间、背部正中);根据中国针灸学会实验针灸研究会制定的大鼠穴位定位方法[11]进行定位。将一次性无菌针灸针平刺入百会穴2 mm,斜刺入大椎穴3 mm,通过连接电针仪,疏密波,频率2 Hz/10 Hz,刺激强度以大鼠针刺部位皮肤微颤为宜,1次/d,每次持续30 min,连续干预3 d。
1.3.2 反复丙泊酚暴露模型 首次腹腔注射丙泊酚50 mg/kg,待大鼠翻正反射恢复后,再追加丙泊酚50 mg/kg,连续给药5 d。
1.4 取材
造模完成后进行取材,对大鼠充分麻醉后,立即于冰面上断头取海马组织。用冰的生理盐水和冰的多聚甲醛溶液依次进行灌流,脑组织充分固定后,用解剖器械钝性剥离颅骨,快速取出整个脑组织于多聚甲醛溶液中固定备用。
1.5 观察指标与检测方法
1.5.1 免疫荧光染色检测海马组织中Iba-1、HMGB1的表达量 将每组脑组织切片进行脱蜡、复水后进行抗原修复等操作,随后孵育一抗:封闭完成后,取出脑组织切片,倒去封闭液,将稀释好的一抗工作液滴加在脑切片表面,置于湿盒中4 ℃孵育过夜。孵育二抗:一抗孵育完毕后,充分清洗再滴加荧光二抗工作液于脑切片表面,放入湿盒内,置于37 ℃恒温箱内孵育1 h。最后封片和观察,每组选取3个视野进行拍照。
1.5.2 Western blot法检测海马组织中TNF-α、IL-6表达量 加入适量蛋白样品和Marker,上样完成后,设定90 V恒压,开始电泳,观察到蓝色蛋白样品位于分离胶和浓缩胶交界位置,Marker分离成多条清晰的直线时,调整电压为120 V,继续电泳,直至溴酚蓝指示剂到达凝胶下缘时,可以终止电泳。转膜:设置快转电流为0.4 A,时间为15 min。封闭:快转完毕后将PVDF膜取出,5%脱脂奶粉封闭液中封闭1 h。孵一抗:封闭完毕后将PVDF膜用TBST溶液洗3次,每次10 min,然后浸泡在一抗工作液中,放在摇床均匀摇晃,4 ℃过夜。敷二抗:将孵育好一抗的PVDF膜取出,TBST洗3次,每次10 min,然后浸泡在二抗工作液中常温孵育1 h。显影与结果分析:利用化学发光进行显影,使用ImageJ软件对蛋白条带进行结果分析,以β-actin为内参,以目标蛋白与内参蛋白灰度值的比值作为TNF-α、IL-6相对表达量。
1.6 统计学处理
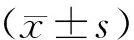
2 结果
2.1 各组海马组织小胶质细胞活化情况比较
Iba-1是小胶质细胞活化的主要标志物。与C组比较,P组海马小胶质细胞Iba-1累积荧光强度明显升高,差异具有统计学意义(P<0.05),提示小胶质细胞激活明显增多;丙泊酚注射液的主要成分是脂肪乳剂和2,6-二异丙基苯酚,故设脂肪乳剂组(F组)以排除脂肪乳剂对实验结果的干扰。与C组比较,F组海马小胶质细胞Iba-1累积荧光强度差异无统计学意义(P>0.05),提示丙泊酚注射液中的脂肪乳剂成分对本实验结果无影响。与C组比较,E组海马小胶质细胞Iba-1累积荧光强度比较差异无统计学意义(P>0.05),提示电针对健康新生大鼠海马区无影响。与P组比较,EP组海马Iba-1累积荧光强度下降,差异具有统计学意义(P<0.05),提示电针能抑制海马小胶质细胞的激活。见图1、表1。
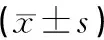
表1 各组新生大鼠海马区Iba-1累积荧光强度比较
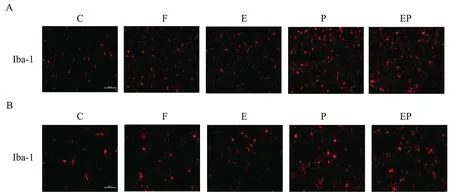
注:免疫荧光检测各组海马Iba-1表达;红色为Iba-1,A标尺=100 μm,B标尺=50 μm。图1 电针对新生大鼠海马区小胶质细胞活化的影响
2.2 各组海马组织中HMGB1的表达情况比较
与C组比较,P组海马区HMGB1累积荧光强度明显升高,差异具有统计学意义(P<0.05)。与P组比较,EP组海马区HMGB1累积荧光强度下降,差异具有统计学意义(P<0.05),提示电针能抑制海马区HMGB1的表达。C组与F组、E组的差异比较无统计学意义。见图2、表2。
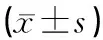
表2 各组新生大鼠海马区HMGB1累积荧光强度比较
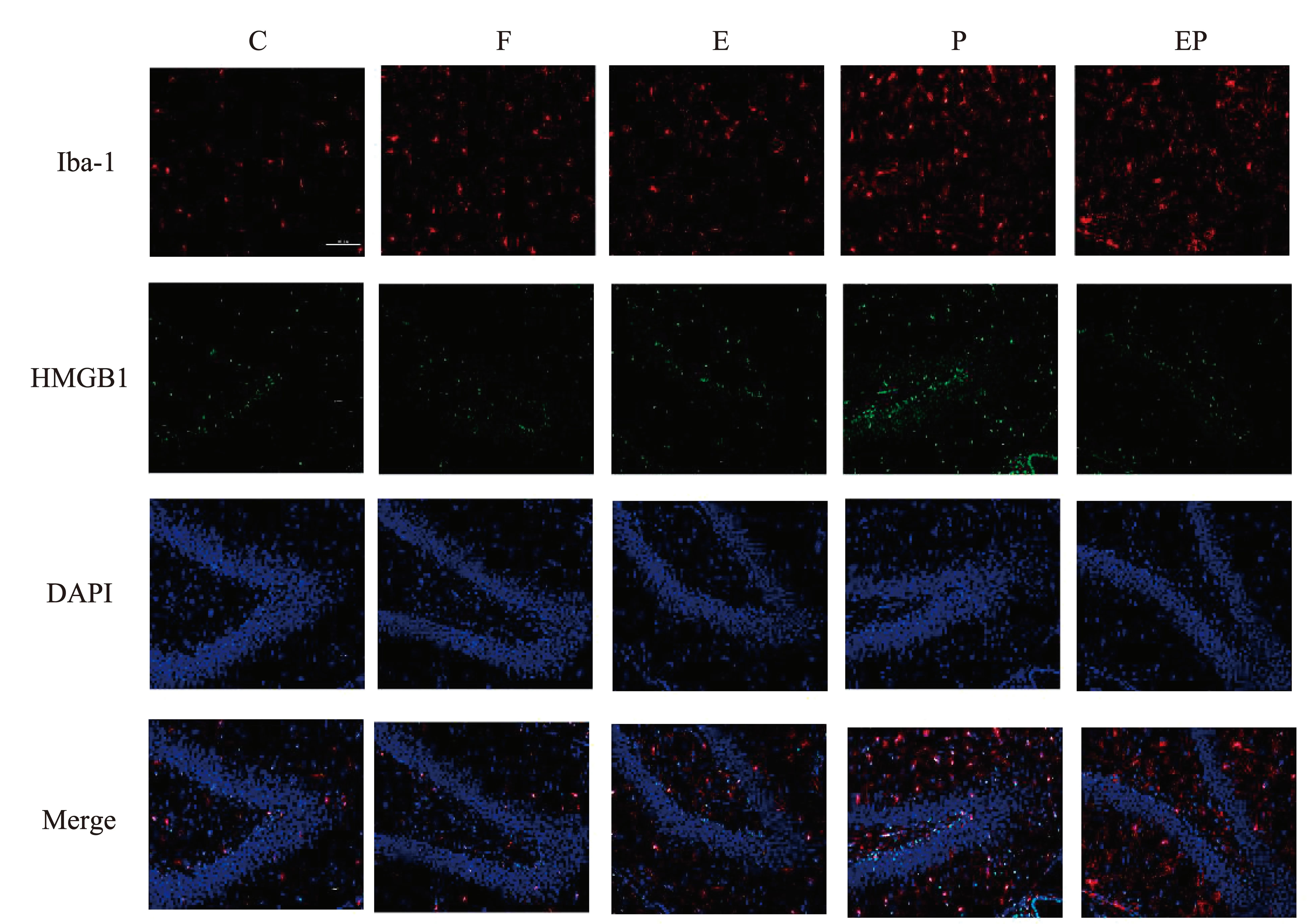
注:红色为Iba-1,绿色为HMGB1, 蓝色为DAPI标记细胞核。 图2 电针对新生大鼠海马区HMGB1表达的影响
2.3 各组海马组织中TNF-α、IL-6表达量比较
与C组比较,P组海马组织中TNF-α、IL-6表达量升高,差异具有统计学意义(P<0.05)。与P组比较,EP组海马组织中TNF-α、IL-6表达量降低,差异具有统计学意义(P<0.05)。E组和EP组比较差异无统计学意义(P>0.05)。见图3、表3。
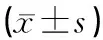
表3 各组新生大鼠海马区TNF-α、IL-6表达含量比较
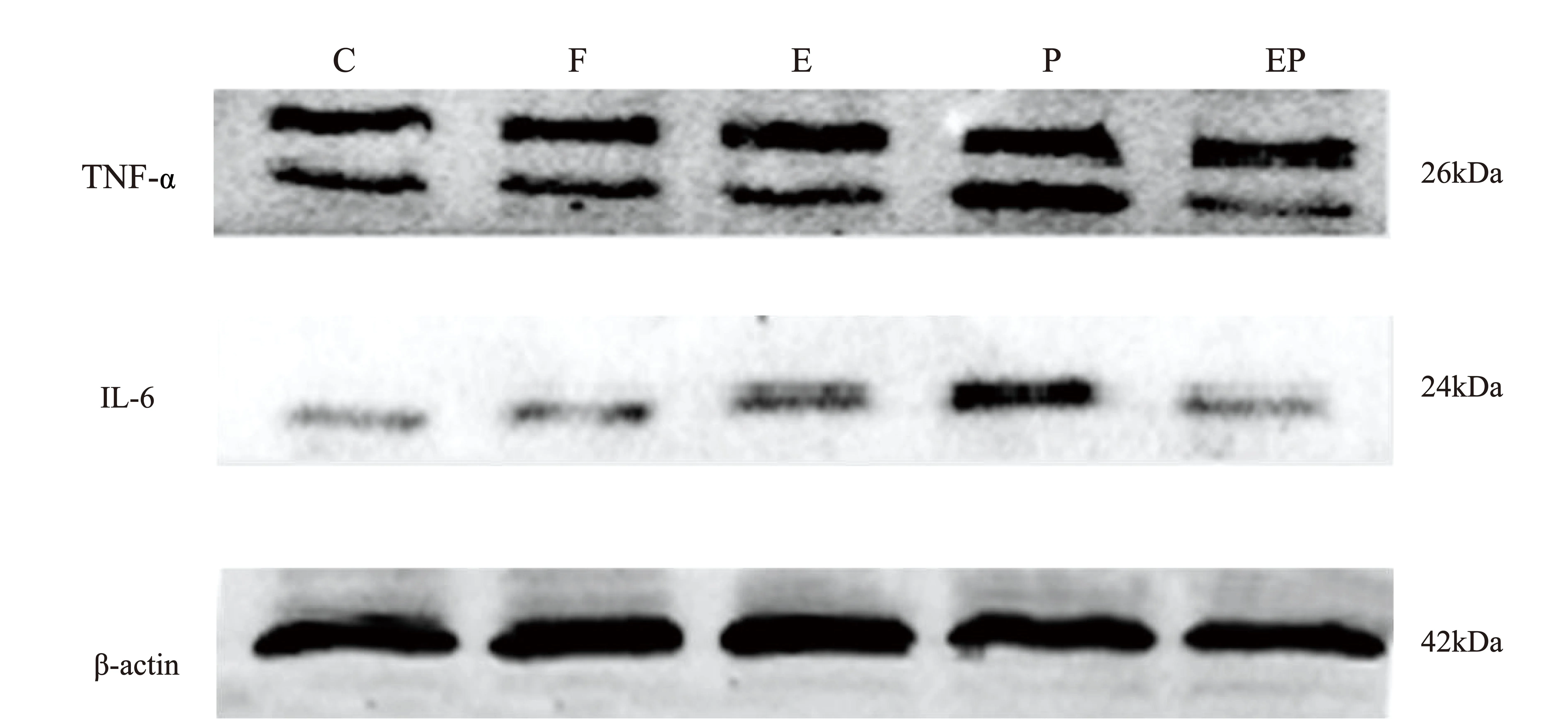
图3 电针对新生大鼠海马区炎症因子TNF-α、IL-6表达的影响
3 讨论
中医对“炎症”并无明确的概念[12]。汉字“炎”是二火重叠,根据中医理论中“取类比象”“推络演绎”的思维,火热之性燔灼,一般将“炎症”归于热证、实证病机范畴,通常治法为清热泻火,但临床效果不佳。电针作为近年来新兴的治疗手段,在临床上已有一定的效果。百会穴位于督脉,有通督调神、醒脑开窍之效[13]。有研究表明[14-16],针刺百会、大椎穴能够显著降低脑缺血再灌注损伤(Cerebral ischemia-reperfusion injury,CIRI)模型大鼠大脑的炎症反应,保护脑功能。故本实验选取百会和大椎穴进行电针干预。海马组织对于炎症反应极为敏感[17],在研究丙泊酚麻醉诱导的脑功能障碍中,研究者[18-19]一般通过海马组织观察中枢神经炎症反应。
在实验大鼠日龄的选择上,根据既往研究选择10日龄SD大鼠作为研究对象[20-21]。婴幼儿应用麻醉药物是否对发育期大脑产生影响一直是医学界存在争议的话题。Li Y等[22]的研究表明新生大鼠接受局麻手术和多次丙泊酚麻醉可在建模1 d后引起中枢炎症介质释放增多,海马组织中TNF-α浓度增加,天冬氨酸特异性半胱氨酸蛋白水解酶(Cysteine-containing aspartate-specific protease,Caspase)-3和原癌蛋白Fos(oncogene Fos,c-Fos)表达增多。
本研究显示反复丙泊酚暴露在短期内使新生大鼠海马组织中TNF-α、IL-6表达明显升高,加重神经炎症反应,与Cui Y等[23]的研究结果一致,即长时间、反复丙泊酚刺激可加重大脑神经炎症反应,而电针干预后海马组织中TNF-α、IL-6表达量较单纯丙泊酚组(P组)明显降低。既往临床试验研究[24]也表明电针督脉穴能够降低脑梗死恢复期患者炎症因子TNF-α、IL-1β水平,促进神经功能的恢复。
Iba-1是小胶质细胞活化的主要标志物,其表达量反映了小胶质细胞的活化程度[25]。小胶质细胞是中枢神经系统的巨噬细胞,主要生理功能包括免疫监视、吞噬异常细胞,调节神经元活动,调节突触可塑性[26]。同时,小胶质细胞能够对伤害性刺激做出反应[27]。当中枢神经系统产生创伤、缺血缺氧和神经退行性改变等病理损伤时,小胶质细胞可转变为M1、M2两种活化类型,M1型通过分泌蛋白酶、炎症因子等加剧炎症反应,诱导炎症细胞迁移至受损区域,而M2型可分泌抗炎因子从而减轻炎症反应[28]。Deng P等[29]发现电针干预能够抑制脑缺血诱导的小胶质细胞活化。刘欣媛等[30]的研究表明电针百会、肾俞穴能够抑制7月龄SAMP8小鼠海马的炎症反应,减少炎症因子的分泌,抑制小胶质细胞激活,有脑保护作用。本研究结果显示,与造模组(P组)比较,电针处理组(EP组)海马区小胶质细胞中Iba-1水平降低,且炎症因子TNF-α、IL-6表达降低,提示电针可能通过下调Iba-1表达水平,抑制小胶质细胞向M1型活化,从而减轻反复丙泊酚暴露大鼠的神经炎症反应。
HMGB1是一种典型的损伤相关分子模式蛋白[31],广泛存在于哺乳动物细胞核中,在大脑中由小胶质细胞主动分泌或受损、死亡的细胞被动分泌,作为细胞外信号分子促进免疫细胞向病变部位迁移产生炎症反应,调控氧化应激、炎症联级反应[32],同时也是细胞坏死性凋亡释放的关键因子[33]。有研究表明[34]在术后认知功能障碍(Postoperative cognitive dysfunction,POCD)模型中,小鼠海马细胞释放的HMGB1可增加Toll样受体(Toll-like receptor,TLR)2的表达,进而导致中枢神经炎症反应。本研究结果表明,反复丙泊酚暴露的新生大鼠通过电针干预后,海马小胶质细胞HMGB1表达水平降低,同时炎症因子TNF-α、IL-6表达量下降,提示电针减轻反复丙泊酚暴露神经炎症的部分机制可能是抑制小胶质细胞HMGB1表达、减少小胶质细胞坏死性凋亡的数量。
综上所述,电针能有效抑制反复丙泊酚暴露大鼠的神经炎症反应,其机制可能与下调细胞因子Iba-1、HMGB1的表达水平、抑制小胶质细胞的过度活化和坏死性凋亡有关。
