创伤后深静脉血栓形成遗传危险因素的全基因组关联分析
2024-04-22章文洁苏玉卢山陈玉莹曹翔宇刘蕾杨丽吴俊
章文洁,苏玉,卢山,陈玉莹,曹翔宇,刘蕾,杨丽,吴俊,
(1.首都医科大学附属北京积水潭医院医学检验中心,北京100035;2.北京大学第四临床医学院医学检验中心,北京100035;3.华中科技大学同济医学院附属梨园医院检验科,武汉430077;4.中国科学院重庆绿色智能技术研究院,重庆400714)
创伤是40岁以下年轻人死亡的主要原因之一,约占世界范围内死亡人数的1/10[1-2]。静脉血栓栓塞(venous thromboembolism,VTE)包括深静脉血栓形成(deep vein thrombosis,DVT)和肺栓塞,是创伤24 h后存活患者的第三大死亡原因[1,3]。研究发现,创伤性下肢骨折患者VTE发生率高,约为10%~60%[4-6]。然而,创伤性下肢骨折后DVT的发生机制尚不清楚,故阐明其机制对预测和诊断DVT具有重要意义。
创伤性下肢骨折后DVT的发生受环境因素和遗传因素的影响[7-8]。下肢骨折患者卧床时血流减慢,研究表明停滞血液中抗凝因子含量低于流动血液[9-10]。内皮细胞可释放纤溶酶原激活剂抑制物,抑制纤溶[11]。血液停滞导致静脉回流减少,带给内皮细胞的氧气和营养物质减少[12],在缺血缺氧条件下,内皮细胞坏死,加速血栓形成。此外,既往研究发现一些遗传变异与DVT密切相关[7],如蛋白C、蛋白S和抗凝血酶的遗传缺陷[13-15],FV Leiden突变[16],凝血酶原20210A突变[16]。ABO血型基因也与血栓易感性相关,非O型血人群比O型血人群具有更高的血栓风险[17]。尽管一些研究已明确了部分与DVT相关的基因缺陷,但尚无研究报道可能增加创伤性下肢骨折后DVT风险的特定基因变异。
随着适用于高通量和大数据的新型DNA分析技术的发展,全基因组关联分析(genome wide association study,GWAS)将流行病学研究设计与分子遗传分析技术相结合,用于发现与表型相关的基因组位点上的单核苷酸多态性或变异。本研究应用GWAS筛选创伤性下肢骨折后术前DVT的遗传危险因素。
1 对象与方法
1.1研究对象 本研究对创伤性下肢骨折患者进行巢式病例对照研究。纳入2019年5月至2019年9月北京积水潭医院382例创伤性下肢骨折患者。纳入标准为创伤性下肢骨折患者的年龄≥18岁;下肢骨折包括髋部骨折、股骨干骨折、股骨远端骨折、髌骨骨折、胫骨平台骨折、胫腓骨骨干骨折、踝关节骨折和足部骨折。排除标准为活动性炎症、癌症、妊娠、自身免疫病及未进行静脉造影检查。创伤性下肢骨折患者于术前行静脉造影检查,以诊断是否发生DVT;共50例创伤性下肢骨折患者发生DVT,进而在332例非DVT患者中随机选择50例与DVT患者的年龄、性别、骨折部位相匹配的对照。最后,将50例创伤性下肢骨折后发生DVT患者和50例未发生DVT患者纳入分析。自入院之日起,两组患者均每日皮下注射40 mg的依诺肝素。本研究已获得北京积水潭医院伦理委员会批准(批准文号:201904-06)。
1.2样本采集与处理 收集创伤性下肢骨折患者急诊入院时的血液样本。抽取患者静脉全血分别至含有EDTA-K2和0.109 mol/L枸橼酸钠的抗凝管(美国BD公司)中,轻轻颠倒混匀。将枸橼酸钠抗凝全血在室温下1 500×g离心15 min,上层血浆即为乏血小板血浆(platelet-poor plasma,PPP)。
1.3方法 用Sysmex XT4000i分析仪(日本Sysmex公司)检测EDTA-K2抗凝全血样本的血红蛋白浓度、红细胞计数、白细胞计数和血小板计数。用Sysmex CS2100i分析仪(日本Sysmex公司)检测PPP样本的D-二聚体浓度。
基因组DNA提取由北京艾吉泰康公司进行,按照QIAamp 全血DNA提取试剂盒(德国QIAGEN公司)说明书所示操作步骤,提取EDTA-K2抗凝全血中白细胞的基因组DNA。用Qubit 3.0检测提取后DNA样本的浓度,用Nanodrop检测提取后DNA样本的纯度。当浓度>20 ng/μL,且A260 nm/A280 nm为1.7~2.0、A260 nm/A230 nm>2.0,则视为DNA质量合格。通过Illumina高通量测序平台进行全外显子测序。测序后获得的原始数据通过质检、过滤、比对、注释,进行统计学分析。
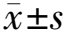
对于GWAS分析,用R语言分析表型数据,用Plink分析基因型数据。首先,分析兴趣基因区域的单核苷酸变异(single nucleotide variant,SNV)与表型之间的相关性。采用单因素统计分析比较DVT组和非DVT组的性别、年龄、创伤距离入院时间等因素的差异是否具有统计学意义。应用BCFtools过滤掉非双等位基因变异、有缺失的基因型变异、次等位基因频率(minor allele frequency,MAF)<5% 的 变 异。设定阈值为R2<0.8,采用Plink对基因型进行连锁不平衡(linkage disequilibrium,LD)剪切。但剪切后的基因型组中仍存在大量LD。继而,用RSpectra的eigs_sym函数对相关基因型矩阵进行特征分解,用correlateR的cor函数生成相关矩阵,采用R-rrBLUP进行GWAS及数据的可视化。
其次,分析兴趣基因与表型之间的相关性。从基于GFF3文件的hg19中查询兴趣基因位点。用BEDtools的intersect函数挑选位于上述兴趣基因区域的变异,并用SnpEff 预测每种变异对基因型的影响。为了评估基因型和表型之间的关系,本研究假设每个基因的变异效应一致。继而,采用广义线性混合模型(generalized linear mixed model,GLMM)分析基因型与表型之间的相关性。用lme4的glmer函数进行GLMM分析,并用pbkrtest的PBmodcomp函数评估完整模型与简化模型在GLMM分析中的效果。用ggplot2进行数据的可视化。
2 结果
2.1研究对象的人口学特征和临床数据 创伤性下肢骨折后发生DVT和未发生DVT患者的人口学特征和临床数据见表1。非DVT组仅高血压病史人数略多于DVT组(P=0.006),其他特征参数在两组之间的差异均无统计学意义(P均>0.05)。

表1 DVT患者和非DVT患者的人口学特征和临床数据
2.2SNVs与表型的相关性分析 为排除性别、年龄、创伤距离入院时间等因素对DVT的个体差异影响,入选上述因素相互匹配的DVT患者和非DVT患者,故只将创伤性下肢骨折后DVT发生和D-二聚体水平等表型性状进行GWAS。
首先,本研究共纳入分析2 662个SNVs,包括89个结构性变异和2 573个非结构性变异。其中,89个结构性变异被排除,不用于GWAS分析;2 573个非结构性变异中包含1 897个MAF<5%的罕见非结构变异,因其会对统计分析结果造成严重偏倚,故也被排除。最后,应用GWAS评估676个SNVs与表型之间的相关性。
如图1所示,应用GWAS评估676个SNVs与创伤性下肢骨折后DVT之间的相关性。结果表明,共27个SNVs与创伤性下肢骨折后DVT发生显著相关。其中,5个SNVs位于非基因区,其余22个SNVs位于10个基因区,分别为ARPC1A、KCND3、HLA-DPA2、KDM5A、C1org198、PTPRT、FAM13A、TMEM2556、AL365295、ZNF234。这22个SNVs中,8个SNVs位于假基因区,13个SNVs位于基因内含子区,仅chr19:44156472位于ZNF234的外显子区。
注:红点表示与创伤性下肢骨折后术前DVT发生显著相关的SNVs,每个点代表1个SNV,所有的点均根据其在基因组中位置而绘制。图中y轴数值是将P值转换为-lg计算而得。
进而,应用GWAS评估676个SNVs与创伤性下肢骨折后D-二聚体水平之间的相关性,如图2所示。结果发现,共21个SNVs与创伤性下肢骨折后D-二聚体水平显著相关。其中,10个SNVs位于非基因区,其余11个SNVs位于7个基因区,分别为ZAN、CES5A、LINC00661、LOC107986845、SLC01A2、RFX7、ZNF234。这11个SNVs中,8个SNVs位于基因内含子区,3个SNVs位于基因外显子区,分别是chr19:16023377和 chr19:16023464位于LINC00661的外显子区,chr19:44156472位于ZNF234的外显子区。

注:红点表示与创伤性下肢骨折后D-二聚体水平显著相关的SNVs,每个点代表1个SNV,所有的点均根据其在基因组中位置而绘制。图中y轴数值是将P值转换为-lg计算而得。
2.3兴趣基因与表型的相关性分析 上述分析的2 662个SNVs位于144个兴趣基因中,包括与血栓形成相关的基因和抗栓药物代谢相关的基因,其中1 614个SNVs位于92个与血栓形成相关的基因中。继而,本研究应用GWAS分别评估92个兴趣基因与创伤性下肢骨折后DVT发生和D-二聚体水平的相关性。
如表2所示,GWAS发现10个基因与创伤性下肢骨折后DVT发生显著相关,分别为F5(P=0.022)、THBD(P=0.040)、SERPIND1(P=0.020)、ITGA2(P=0.021)、CALU(P=0.021)、GGCX(P=0.022)、CYP3A4(P=0.039)、CYP2C19(P=0.020)、CYP1A1(P=0.020)、CYP2B6(P=0.023)。另外,GWAS结果表明6个基因与创伤性下肢骨折后D-二聚体水平显著相关,如表3所示,分别为FGB(P=0.021)、F13A1(P=0.021)、CALU(P=0.020)、GGCX(P=0.045)、NQO1(P=0.022)、CYP2D6(P=0.020)。

表2 与创伤性下肢骨折后DVT发生相关的基因

表3 与创伤性下肢体骨折后D-二聚体水平相关的基因
3 讨论
本研究发现THBD、F5、SERPIND1、ITGA2与创伤后DVT发生显著相关,表明止血机制辅因子可能是创伤性下肢骨折后DVT发生的重要影响因素。THBD编码的血栓调节蛋白(Thrombomodulin,TM)位于内皮细胞表面,与凝血酶形成复合物后,可将蛋白C转化为活化蛋白C(activated protein C,APC),发挥抗凝功能。TM功能受损或表达减低,可引起凝血功能异常,导致血栓栓塞性疾病[18]。Sugiyama等[19]报道THBD中含有2729>C和A455V错义的单倍型突变,会影响可溶性TM水平,可能与日本人群的DVT发生相关。F5编码的FⅤ是活化FⅩ的关键辅因子。研究表明,F5基因突变可导致APC对FⅤ的灭活能力减弱,抗凝活性下降,造成血液高凝状态[20]。SERPIND1编码的肝素辅因子Ⅱ(heparin cofactor Ⅱ,HCⅡ),在糖胺聚糖、肝素或硫酸皮肤素存在时,可取代抗凝血酶成为主要的凝血酶抑制剂。Blinder等[21]报道Arg-189突变可造成HCⅡ功能异常。Corral等[22]发现HCⅡ缺乏在血栓形成中发挥重要作用。ITGA2编码的整合素α2在血小板表面又称糖蛋白Ⅰa,是层粘连蛋白、胶原、胶原C-前肽、纤维连接蛋白和钙粘蛋白E的受体,在血小板和其他细胞与胶原的粘附中起重要作用[23],而胶原作为血小板活化的强诱导剂之一,参与血栓形成的发生和发展[24]。
本研究发现FGB和F13A1与创伤性下肢骨折后D-二聚体水平显著相关。F13A1和FGB分别编码FA链和纤维蛋白原β链。F被凝血酶和钙离子活化,催化纤维蛋白链中γ-谷氨酰-ε-赖氨酸交联的形成,从而稳定纤维蛋白凝块[25]。纤维蛋白原β链与α、γ链一起被凝血酶裂解为单体,成为血栓凝块的主要成分之一,在血栓形成中发挥重要作用。
VKD羧化对某些蛋白维持生理功能至关重要。目前数种凝血因子已被认定为VKD羧化蛋白,包括促凝蛋白(如FⅦ、FⅨ、FⅩ等)和抗凝蛋白(如蛋白C、蛋白S、蛋白Z)等[26]。本研究发现3个VKD羧化相关因子与创伤后DVT发生和D-二聚体水平显著相关,分别是GGCX、CALU、NQO1,分别编码VKD γ-羧化酶、网腔钙结合蛋白、NAD(P)H 醌氧化还原酶1。网腔钙结合蛋白参与对多个N端谷氨酸残基VKD羧化的调控,发挥抑制γ-羧化酶的作用[27]。NAD(P)H 醌氧化还原酶1参与解毒和生物合成过程中对苯二酚偶联反应,如合成凝血酶原时谷氨酸残基的VKD γ-羧化[28]。
本研究结果显示,部分细胞色素P450家族成员与创伤性下肢骨折后DVT发生和D-二聚体水平显著相关,分别为CYP1A1、CYP3A4、CYP2C19、CYP2B6、CYP2D6,分别编码细胞色素P450 1A1、P450 3A4、P450 2C19、P450 2B6、P450 2D6。上述分子均参与多种内源性物质的代谢,如花生四烯酸、二十碳五烯酸、类固醇激素、甾醇、类视黄醇和维生素等[29-31]。细胞色素P450 1A1可将花生四烯酸转化为环氧二十碳三烯酸的区域异构体,作为脂质代谢介质参与心血管系统的生理功能和病理变化[30]。细胞色素P450 2C19负责多种治疗药物的代谢,如氯吡格雷。细胞色素P450 2B6参与外源性物质的氧化代谢,如植物脂类和药物[32]。
创伤性下肢骨折患者具有较高的DVT发生风险,但其机制尚未被阐明。依据文献所述,遗传因素在创伤后DVT的发生和发展中起重要作用。结合本研究结果可知,创伤性下肢骨折后DVT发生可能受止血机制辅因子、VKD羧化相关因子和细胞色素P450家族成员的调控。本研究为创伤后深静脉血栓的遗传易感性提供了价值信息。
然而,本研究仍存在局限性。首先,需要纳入更大的样本人群,来验证本研究结果中与表型具有强相关性的变异,以便发现更多与表型具有中等强度相关性的变异。此外,本研究所纳入的创伤患者均为中国人。众所周知,遗传易感性与种族多样性密切相关,故本研究结论的推广仅限于中国人群。因此,本研究需要纳入其他种族人群,以进行下一步研究。
