计算机辅助精子分析用精液样本的稀释条件及标准化研究*
2024-04-22伍细言郝瑞龙李维娜
伍细言,郝瑞龙,李维娜
(1.湖南省妇幼保健院生殖医学中心,长沙410008;2.湖南师范大学附属光琇医院,长沙410205;3.中信湘雅生殖与遗传专科医院男科学部,长沙410221)
在男性生殖和不育诊疗中,精液常规检验扮演着关键角色,对于临床诊疗和患者满意度至关重要。然而,在日常工作中,医师经常遇到高浓度精液样本的挑战。根据WHO《人类精液检查和处理实验室手册》(第5版和第6版),当使用20 μm深计数板时,如果精子浓度超过50×106/mL,应使用自身精浆进行稀释,以确保计算机辅助精子分析(CASA)系统分析结果的准确性[1-2]。然而,国内调查显示高达76%(57/75)的实验室使用10 μm深计数板[3]且部分样本精液量较少,无法获取自身精浆进行稀释。
有学者建议,对于无法使用自身精浆稀释且精子浓度超过100×106/mL的样本,可以使用生理盐水1∶3稀释后检测[4]。国内生殖检验专家也推荐,当精子浓度高于100×106/mL时,可用生理盐水代替自身精浆稀释[5]。吴颖等[6]研究显示,健康男性精子浓度的第50百分位数(P50)为64×106/mL,即超过一半样本需要常规稀释。鉴于目前使用的计数板深度与WHO推荐存在差异,加之需要稀释的精液样本比例较高,制定符合中国国情的实验室标准迫在眉睫。因此,我们在使用10 μm深计数板的条件下,开展针对无法使用自身精浆稀释的高浓度精液样本,使用生理盐水稀释后进行CASA检测的研究,旨在为国内男科实验室准确检验高浓度精液样本提供依据和参考。
1 材料与方法
1.1样本来源 选取2022年4月于中信湘雅生殖与遗传专科医院就诊的男性患者,常规检测后剩余精液样本201例,所有样本精子浓度≥15×106/mL。
1.2样本采集 要求患者禁欲2~7天,采用手淫法将全部精液射于清洁干燥的取精杯中。将采集的精液样本及时送至实验室,置于37 ℃培养箱内利用温浴法使之液化。
1.3样本检测 采用赛司SAS-Ⅱ型精子质量分析仪检测精子浓度、前向运动精子百分率(PR)、非前向运动精子百分率(NP)、精子活动率(PR+NP)和不活动精子百分率(IM)等精液常规参数。仪器采用直线速率(straight-line velocity,VSL)对精子运动进行分类:VSL≥15 μm/s为前向运动(PR),5 μm/s≤VSL<15 μm/s为非前向运动(NP),VSL<5 μm/s为不活动(IM)。使用10 μm深度SC-Ⅳ一次性精子检测板(北京赛司公司)计数,经验证计数池深度误差≤1 μm,视野内无杂质,满足质量要求。
1.4精子浓度及活力检验 每日使用乳胶质控珠QC-BeadsTM(美国Bioscreen公司)进行2个不同水平精子浓度质控,变异系数均<5%。待精液充分液化后,用移液器吸取3 μL加样至一次性检测板。当精子浓度≤50×106/mL时,则不稀释,按WHO标准重复计数2次;当精子浓度(n)>50×106/mL时,按1∶[n/(50×106)]的比例用生理盐水稀释至<50×106/mL,即1份(100 μL)精液加n/(50×106)×100 μL生理盐水稀释,充分混匀后立即(1 min内)检验,尽可能减少对精子活力的影响。每份高浓度样本,稀释前后均检测精子浓度、PR+NP、PR、NP和IM等。

1.6统计学分析 使用SPSS 27.0软件进行数据处理。对精子浓度<50×106/mL(组1,未稀释组)、50×106/mL≤精子浓度<100×106/mL(组2)、精子浓度≥100×106/mL(组3)的精液参数(精子浓度、PR+NP、PR、NP、IM)进行正态性检验。利用改良Bland-Altman图评估稀释前后一致性,使用Kruskal-Wallis检验比较3组数据差异,P<0.05为差异有统计学意义。绘制ROC曲线,确定最佳稀释阈值。
2 结果
2.1稀释前后精液参数的分布情况 未稀释组(组1,精子浓度<50×106/mL)、50×106/mL≤浓度<100×106/mL组(组2)和浓度≥100×106/mL组(组3)均呈非正态分布,各组稀释前后精液参数的分布情况见表1、2。

表1 精液样本稀释前精液参数分布情况[M(P25,P75)]

表2 精液样本稀释后精液参数分布情况[M(P25,P75)]


注:A为精子浓度的一致性;B为精子活力参数的一致性。

表3 稀释前后精液参数可接受结果
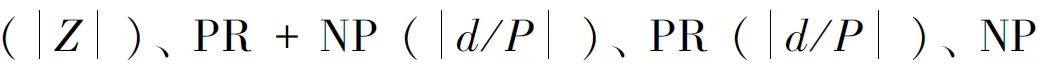

表4 精液参数Z或值与精液稀释前精子浓度的相关性
2.4ROC曲线分析 根据稀释前后精子浓度、PR+NP、PR、NP、IM的可接受度,绘制ROC曲线预测高浓度精液样本的最佳稀释阈值,见表5。5个指标单独判断时均具有一定预测价值(P均<0.05)。其中,精子浓度预测的ROC曲线下面积(AUCROC)为0.694(95%CI:0.582~0.806),最佳稀释阈值为133.05×106/mL,此时特异性最高(0.887);NP预测的AUCROC为0.742(95%CI:0.666~0.818),最佳稀释阈值为90.90×106/mL,此时敏感性最高(0.771)。精子浓度和NP两项联合预测价值最高,AUCROC为0.900(95%CI:0.796~1.000)。

表5 精液参数的可接受度判断高浓度精液样本最佳稀释阈值的价值
3 讨论
《医疗机构临床实验室管理办法》要求实验室检验结果须准确可靠。目前国内92%生殖检验实验室采用CASA进行精液检测[3],其合适检测范围应尽可能涵盖大部分临床样本。然而,CASA在检验高浓度样本时,由于精子重叠、碰撞等原因,CASA系统无法精确识别部分精子,导致检测结果低于实际值[7]。
与WHO第5版推荐使用20 μm深计数板不同,国内生殖检验实验室多采用10 μm深Makler计数板(50.67%)、10 μm深一次性计数板(25.33%),远高于使用20 μm深计数板(10.67%)[6]。理论上,使用10 μm深计数板时,其精子重叠和碰撞概率是20 μm计数板的1/2[7]。研究表明,当视野内精子数控制在50~150个时,CASA表现出较高的准确性[8]。

本研究考虑了计数板深度对CASA检测精子浓度范围的影响,解释了我们预测的稀释阈值与WHO第5版和第6版推荐的稀释标准存在差异的原因,结果有助于制定符合国情的精液检测标准。
