前列腺癌早期筛查风险预测模型的建立与验证研究
2024-04-18李宏基赵晓龙胡伟韩东晖王安辉秦卫军
李宏基 赵晓龙 胡伟 韩东晖 王安辉 秦卫军
【摘要】 背景 前列腺癌作為常见的恶性肿瘤,威胁中老年男性生命健康,其预后与初诊时肿瘤级别与分期密切相关。前列腺特异性抗原(PSA)是前列腺癌早期筛查的重要分子,但非肿瘤负荷的前列腺良性疾病或操作也会引起PSA升高,盲目穿刺常导致过度诊疗。依据患者穿刺活检前的临床指标构建前列腺癌风险预测模型,可以为早筛可疑患者是否进行穿刺活检提供重要参考。目的 寻找前列腺穿刺活检阳性的独立危险因素,构建前列腺癌发生的风险预测模型,预测前列腺癌发生风险。方法 选取2011年1月—2023年6月于空军军医大学第一附属医院泌尿外科住院并进行前列腺穿刺活检的患者1 138例,排除351例临床数据不完整病例后,剩余787例病例通过R语言split函数随机分为训练集(n=548)与验证集(n=239)(划分比例为7∶3)。收集患者的基本信息以及穿刺活检前生化检查指标,依据患者穿刺活检病理结果判断是否发生前列腺癌。应用LASSO回归筛选前列腺癌发生的独立危险因素,对独立危险因素进行多因素Logistic回归分析,利用分析结果构建前列腺癌早期筛查的风险预测模型并绘制列线图。依据训练集与验证集数据对模型进行验证。结果 使用LASSO回归分析筛选出6个预测变量,包括年龄、总PSA(tPSA)、碱性磷酸酶、总蛋白、钙、尿素。多因素Logistic回归分析结果显示,年龄≥60岁(OR=3.769,95%CI=2.393~5.937)、tPSA≥10 μg/L(OR=2.259,95%CI=1.419~3.596)、碱性磷酸酶≥45 U/L[45~<125 U/L:OR=20.136,95%CI=4.419~91.752;≥125 U/L:OR=45.691,95%CI=9.199~226.951]是前列腺癌的危险因素(P<0.05),总蛋白≥65 g/L(OR=0.086,95%CI=0.031~0.236)、钙≥2.11 mmol/L(OR=0.148,95%CI=0.054~0.403)、尿素≥9.5 mmol/L(OR=0.069,95%CI=0.019~0.252)是前列腺癌的保护因素(P<0.05)。依据有统计学差异的6个预测变量绘制列线图,建立预测模型。预测模型预测训练集前列腺癌发生的ROC曲线下面积(AUC)为0.778(95%CI=0.740~0.816),灵敏度为53.2%,特异度为85.5%,验证集前列腺癌发生的AUC为0.770(95%CI=0.708~0.832),灵敏度为61.2%,特异度为80.0%。拟合优度检验显示训练集P=0.543,验证集P=0.372,具有较好的拟合度。决策曲线分析(DCA)显示训练集高风险阈值<10%,验证集的高风险阈值约为15%,在临床实践中有一定的指导意义。结论 本研究建立了包含年龄、tPSA、碱性磷酸酶、总蛋白、钙、尿素共6项穿刺前指标的前列腺癌列线图风险预测模型,可用于预测早期筛查可疑患者的前列腺癌发生风险。
【关键词】 前列腺肿瘤;前列腺增生;筛查;危险因素;列线图
【中图分类号】 R 737.25 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2023.0862
Development and Validation of a Prediction Model for Prostate Cancer Early Screening
LI Hongji1,ZHAO Xiaolong1,HU Wei1,HAN Donghui1,WANG Anhui2*,QIN Weijun1*
1.Department of Urology,the First Affiliated Hospital of Air Force Medical University,Xi'an 710032,China
2.Department of Epidemiology,School of Preventive Medicine,Air Force Medical University,Xi'an 710032,China
*Corresponding authors:WANG Anhui,Associate professor;E-mail:wangah@fmmu.edu.cn
QIN Weijun,Chief physician/Doctoral supervisor;E-mail:qinwj@fmmu.edu.cn
【Abstract】 Background As a common malignant tumor,prostate cancer(PCa) poses a significant threat to the well-being of men worldwide. The prognosis of PCa is intricately linked to the grade and stage of the tumor at the time of initial detection. Prostate specific antigen(PSA) is a key biomarker for evaluating prostate health,yet lacks specificity for prostate cancer tumors. Elevated PSA levels can also be caused by benign prostate diseases. And the indiscriminate use of biopsy resulting in overdiagnosis. Hence,the development of a prostate cancer risk prediction model based on pre-biopsy clinical indicators in patients can serve as a valuable tool for early screening of individuals with suspicious findings warranting biopsy. Objective To examine the individual risk factors associated with positive prostate biopsy outcomes and develop a risk assessment model for predicting positive biopsy results in PCa screening. MethodsA total of 1 138 patients who underwent prostate biopsy in the Department of Urology,the First Affiliated Hospital of Air Force Medical University from January 2011 to June 2023 were gathered and organized. Following the exclusion of 351 cases with inadequate clinical data,the remaining 787 cases were randomly allocated into a training set and validation set in a 7∶3 ratio by R software. Patient demographics and routine biochemical test results prior to biopsy were compiled,with PCa diagnosis determined based on the outcomes of the biopsy. LASSO regression analysis in the R software was utilized to identify independent risk factors associated with the development of PCa based on biochemical indicators. Subsequently,multivariate logistic regression analysis in SPSS software was employed to construct an early screening and predictive model for PCa,with a Nomogram being generated. The model was validated according to the data of training set and validation set. Results The study utilized LASSO regression analysis to identify 6 independent risk factors associated with positive prostate biopsy results,including age,total PSA(tPSA),alkaline phosphatase,serum protein level,Ca2+,and urea. Multivariate Logistic regression analysis revealed that individuals aged 60 years or older(OR=3.769,95%CI=2.393-5.937),with tPSA levels of 10 μg/L or higher(OR=2.259,95%CI=1.419-3.596),and alkaline phosphatase levels exceeding 45 U/L(45-<125 U/L,OR=20.136,95%CI=4.419-91.752;≥125 U/L,OR=45.691,95%CI=9.199-226.951)were at increased risk for positive prostate biopsy outcomes(P<0.05). Conversely,higher levels of serum total protein(≥65 g/L,OR=0.086,95%CI=0.031-0.236),Ca2+(≥2.11 mmol/L,OR=0.148,95%CI=0.054-0.403),and urea(≥9.5 mmol/L,OR=0.069,95%CI=0.019-0.252)were found to be protective factors against positive prostate biopsy results(P<0.05). Based on the identification of 6 independent risk factors exhibiting statistically significant differences,a nomogram was constructed and a predictive model was developed. The predictive model yielded an Area under the receiver operating characteristic(ROC)curve(AUC) of 0.778(95%CI=0.740-0.816)for PCa in the training set,with a sensitivity of 53.2% and a specificity of 85.5%. In the validation cohort,the AUC for PCa was 0.770(95%CI=0.708-0.832),with a sensitivity of 61.2% and a specificity of 80.0%. The goodness of fit test indicated P=0.543 in the training set and P=0.372 in the validation set,demonstrating a satisfactory level of fit. The discriminant analysis(DCA) demonstrated that the high-risk threshold in the training set was below 10%,while in the validation set it was approximately 15%,indicating valuable implications for clinical practice. ConclusionThis study developed a PCa nomogram risk prediction model incorporating 6 biochemical indicators,namely age,tPSA,alkaline phosphatase,serum total protein,Ca2+,and urea,prior to prostate biopsy,to effectively forecast PCa risk in patients with favorable early screening outcomes.
【Key words】 Prostatic neoplasms;Prostatic hyperplasia;Screening;Risk factors;Nomogram
前列腺癌作为男性特有的肿瘤,在世界范围内严重威胁着男性的生命健康。2020年全球癌症统计数据显示前列腺癌以14.1%的发病率和6.8%的死亡率位居全球男性发病率第2位和死亡率第6位[1]。据美国癌症协会统计分析,2023年前列腺癌以29%的发病率和11%的死亡率位列美国男性肿瘤发病率第1位、死亡率第2位[2]。前列腺癌的预后主要取决于初诊时的肿瘤级别与分期:早期前列腺癌或临床局限性前列腺癌患者,其10年生存率可达99%以上,而初诊为肿瘤晚期或已发生远处转移的患者,5年生存率仅为30%[3]。与欧美国家相比我国前列腺癌患者發病率更低,但根据国内多中心研究资料显示,国内约2/3前列腺癌患者初诊时已进入中晚期,较欧美国家总体预后更差[4]。因此提高我国前列腺癌早期筛查和诊断检出率,可以有效改善患者预后,提高前列腺癌患者生存率。
根据欧洲泌尿学会(European Association of Urology,EAU)指南,前列腺癌的诊断及临床分期主要通过前列腺穿刺活检确诊,通常根据直肠指检或前列腺特异性抗原(prostate-specific antigen,PSA)的水平来确定患者是否进行穿刺活检[5]。前列腺上皮细胞分泌产生的PSA,是具有极高组织特异性的蛋白,但并非肿瘤特异性,前列腺良性疾病、泌尿系感染或前列腺相关检查均会不同程度引起PSA升高。EAU在2022年12月的指南中依然建议将PSA作为筛查前列腺癌的重要指标[6]。目前国内也将血清PSA检查作为前列腺癌筛查的专家共识[4]。PSA检测的筛查可以使筛查人群受益,但单一指标带来的假阳性常导致过度诊断和过度穿刺。作为最早开始血清PSA筛查的美国,其数据显示血清PSA筛查假阳性率为10%~15%[7]。过度穿刺不仅导致患者身体承受创伤和额外的感染风险,更带来了不必要的精神和经济压力。
因此,亟须筛选前列腺癌早期筛查过程中的其他危险因素以及生物标志物,并建立前列腺癌早期筛查的风险预测模型,提高前列腺癌早期筛查的准确性和特异性,为前列腺癌的临床诊断和预后风险判断提供重要参考价值。
1 对象与方法
1.1 研究对象
本研究所用数据来源于空军军医大学第一附属医院泌尿外科住院进行前列腺穿刺活检患者的临床数据。所用数据患者均知情同意。选取2011年1月—2023年6月进行前列腺穿刺活检患者1 138例,其中前列腺增生584例、前列腺癌449例、前列腺癌合并前列腺增生105例。本研究已通过空军军医大学第一附属医院伦理会审批(KY20223100-1号)。
1.2 纳入与排除标准
所有数据为真实病历数据,由于记录存在缺失、异常或不一致问题,根据以下标准对数据进行纳入或排除。纳入标准:(1)在本院行前列腺癌筛查,PSA>4 μg/L;(2)接受前列腺穿刺活检;(3)穿刺前临床资料完整;(4)穿刺后病理结果明确。排除标准:(1)入院前已明确诊断为前列腺癌;(2)病理检查结果不明确;(3)尿路感染、急性肾损伤、肾脏肿瘤、膀胱肿瘤等其他泌尿系统非前列腺疾病;(4)合并其他恶性肿瘤。
1.3 数据整合
原始数据中患者病理检查结果共有“前列腺癌”“前列腺增生”“前列腺增生合并前列腺癌”3种,本研究将预测结果重新定义分类为有或无前列腺癌,其中“前列腺癌”“前列腺增生合并前列腺癌”归为结局“前列腺癌组”,“前列腺增生”归为结局“非前列腺癌组”。
本研究建模所用患者数据主要为患者基本信息及临床检查指标。基本信息主要包括患者的年龄、BMI;临床检查指标主要包括:总PSA(tPSA)、天冬氨酸氨基转移酶、丙氨酸氨基转移酶、血清总蛋白、血清白蛋白、血清球蛋白、碱性磷酸酶、总胆红素、直接胆红素、间接胆红素、钾、钠、氯、钙、肌酐、尿酸、尿素和前列腺体积共18项指标。其中前列腺体积依据B超检查中的前列腺大小计算,前列腺体积=前列腺左右径×上下径×前后径×0.52。
所有数据资料整理后,录入R 4.0软件,使用caTools函数包中的split函数进行按7∶3比例随机划分(参数设置SplitRatio=0.7),分别归入训练集(70%)和验证集(30%)。
1.4 统计学方法
统计学分析通过SPSS 24.0和R 4.0软件实现。所有数据整理后为计数资料,以相对数表示。通过χ2检验进行训练集与验证集的基线资料比较。前列腺癌穿刺阳性的独立危险因素通过R语言LASSO回归筛选,并通过多因素Logistic回归分析验证,构建预测模型并绘制Nomogram(列线图)。训练集及验证集模型分别通过受试者工作(ROC)曲线、拟合优度检验、校准曲线以及决策曲线分析(DCA)评估。以P<0.05为差异有统计学意义。
2 结果
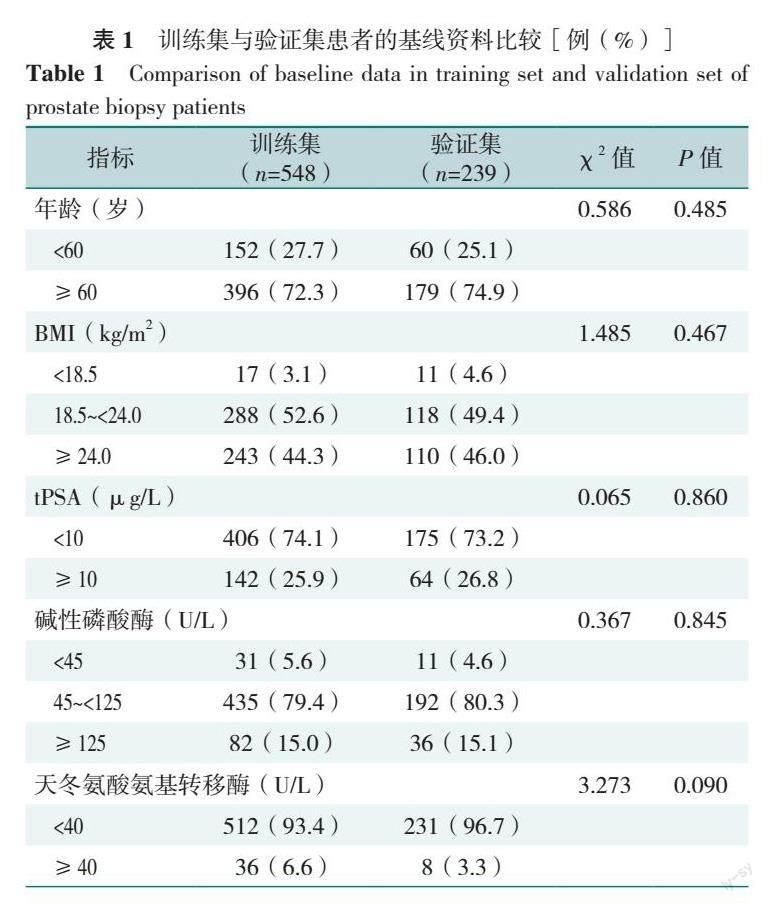
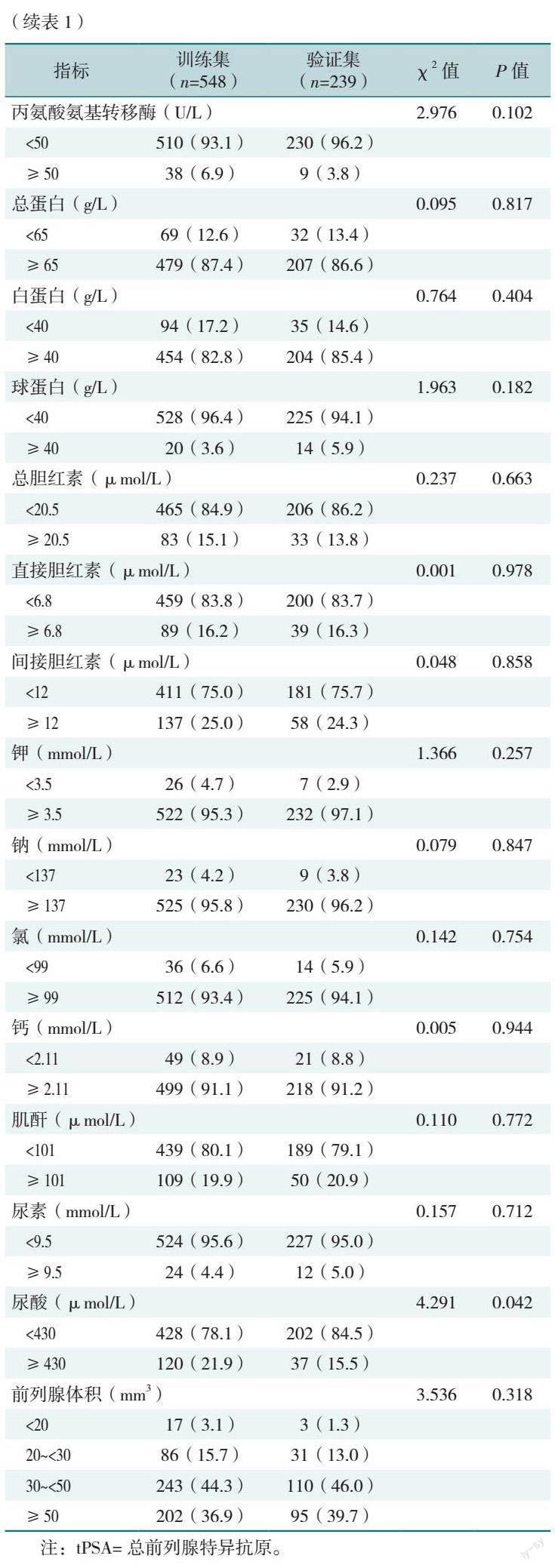
2.1 训练集和验证集患者的基线资料比较
训练集和验证集年龄、BMI、tPSA、碱性磷酸酶、天冬氨酸氨基转移酶、丙氨酸氨基转移酶、血清总蛋白、血清白蛋白、血清球蛋白、总胆红素、直接胆红素、间接胆红素、钾、钠、氯、钙、尿素、前列腺体积比较,差异均无统计学意义(P>0.05)。训练集尿酸≥430 μmol/L所占比例高于验证集,差异有统计学意义(P=0.042),见表1。
2.2 LASSO回归筛选变量
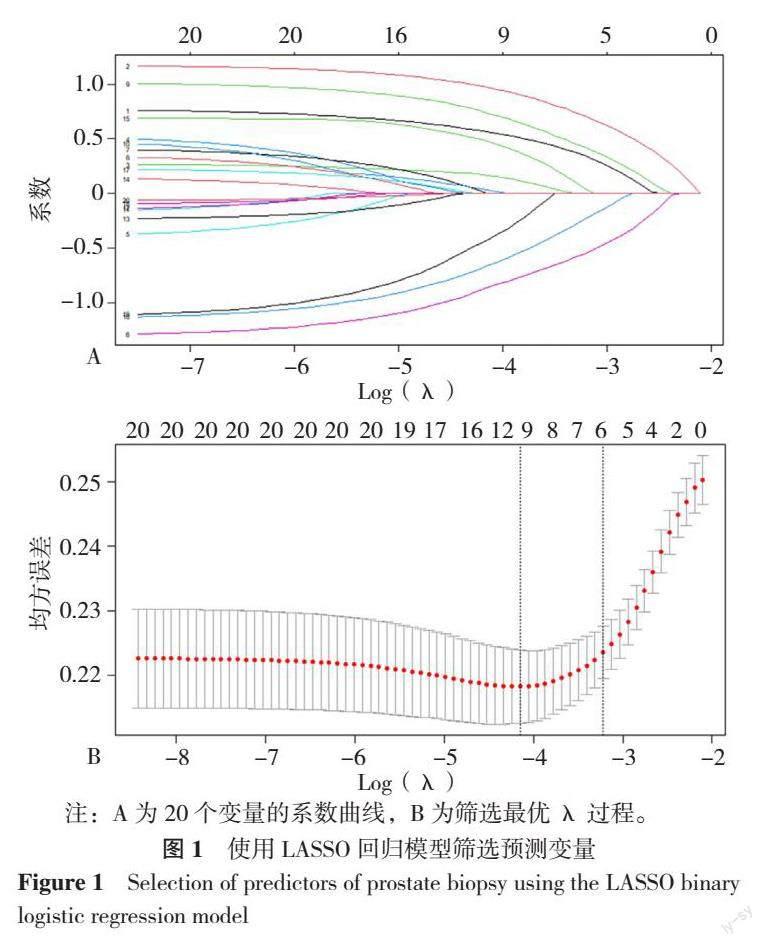
根据训练集患者的基本信息与临床检查指标,使用R语言LASSO回归在20个预测变量中进行独立危险因素筛选,系数为非零时具有意义。在λ=0.016时模型具有最小目标参量均值,在λ=0.040时λ最小值1个方差范围内得到最简单模型,此时Logλ=-3.219,认为回归模型最优(图1)。共有6个预测变量被纳入模型,包括年龄、tPSA、碱性磷酸酶、总蛋白、钙、尿素。
2.3 预测模型构建
以前列腺癌患者穿刺病理结果为因变量(赋值:前列腺癌=1,非前列腺癌=0),以上述筛选出的6个预测变量为自变量进行多因素Logistic回归分析(赋值见表2)。结果显示,前列腺穿刺活检前患者年龄≥60岁(OR=3.769,95%CI=2.393~5.937),tPSA≥10 ng/mL(OR=2.259,95%CI=1.419~3.596),碱性磷酸酶>45 U/L[45~<125 U/L:OR=20.136,95%CI=4.419~91.752;≥125 U/L:OR=45.691,95%CI=9.199~226.951]是前列腺癌的危险因素(P<0.05),总蛋白≥65 g/L(OR=0.086,95%CI=0.031~0.236),钙≥2.11 mmol/L(OR=0.148,95%CI=0.054~0.403),尿素≥9.5 mmol/L(OR=0.069,95%CI=0.019~0.252)是前列腺癌發生的保护因素(P<0.05),见表3。再次将数据录入R语言,绘制列线图(图2)。需进行穿刺活检患者可依据自身指标情况在列线图上进行评分,依据6项指标总分在概率直线上的投影,即可计算患者穿刺活检阳性的估计概率。
2.4 预测模型的验证
分别用训练集和验证集的数据对该模型进行内部评价和内部验证。ROC曲线用于评估该模型的区分度。结果显示,训练集的ROC曲线下面积(AUC)为0.778(95%CI=0.740~0.816),灵敏度为53.2%,特异度为85.5%(图3A);验证集的AUC为0.770(95%CI=0.708~0.832),灵敏度为61.2%,特异度为80.0%(图3B),表明该模型能较好地区分早期筛查中的前列腺癌与非前列腺癌。拟合优度检验用于评估该模型的拟合程度,结果显示训练集P=0.543,验证集P=0.372,表明该模型拟合良好。校准曲线用于评估模型拟合程度和预测精度,结果显示训练集与验证集中的校准-偏差曲线与实际曲线拟合良好,同时与理想曲线相差较小(图4)。通过3种评价与验证均表明该模型能够在穿刺前较好地区分前列腺癌与非前列腺癌,具有良好的预测能力。
2.5 临床应用
DCA用于评估该模型的临床应用价值。结果显示,训练集阈值概率>10%,验证集阈值概率>15%时,使用本模型的患者临床净收益大于全部进行穿刺或者全部不进行穿刺两种极端情况(图5)。
3 讨论
本研究中,训练集有54.56%的患者穿刺活检结果显示为前列腺癌,利用LASSO回归在20个预测变量中筛选出6个前列腺穿刺阳性的独立危险因素,即年龄、tPSA、碱性磷酸酶、血清总钙、血清总蛋白、尿素。通过多因素Logistic回归进行分析验证。随后建立前列腺早期筛查中穿刺活检阳性的风险列线图模型。通过训练集和验证集数据对模型进行内部评价和验证,ROC曲线表明本模型能较好区分前列腺癌和非前列腺癌(训练集/验证集AUC=0.778/0.770)。通过校准曲线与拟合优度检验表明本模型的预测诊断具有较好的一致性。最后通过DCA曲线证明本模型具有较好的临床应用价值。依据本预测模型,对于早期筛查可疑拟进前列腺穿刺患者,穿刺检查前患者年龄≥60岁,生化检查结果tPSA≥10 μg/L、碱性磷酸酶≥45 U/L、钙<2.11 mmol/L、尿素<9.5 mmol/L、总蛋白<65 g/L时,提示前列腺穿刺结果阳性风险大,有更加充分的证据支持进行穿刺,否则应进行更谨慎的评估,避免过度诊断给患者带来的经济和身体负担。
PSA作为主要的前列腺癌筛查指标,对于前列腺癌发生的风险提示至关重要。DE VOS等[8]对欧洲前列腺癌筛查数据的研究结果显示,预期寿命>10年的男性非常有必要进行基于PSA的前列腺筛查。尽管PSA水平升高(>4 μg/L)常被认为是前列腺癌的危险因素,但前列腺良性疾病也会导致PSA升高,而确诊时PSA低水平常意味预后不良[9-11]。本模型中提高了PSA的预警阈值,当PSA≥10 μg/L时,前列腺穿刺活检阳性风险提高2.259倍。
前列腺癌的发病风险随年龄增长而升高。尸检数据显示,60岁以上未经筛查男性40%患有前列腺癌,而80岁以上男性该比例为60%以上[6]。2020年全球癌症患病数据显示60岁以后男性前列腺癌患病风险逐年提高[12]。目前针对前列腺癌的早期筛查大多建议从40~45岁开始,期待在疾病的更早期发现并治疗前列腺癌[13-15],但同时带来的过度诊疗问题易被忽视。本研究结果为我国60岁以上男性加强前列腺筛查提供了证据。本模型囿于病例数量及流行病资料本身限制,未能提出更加精确的年龄分层,尚需更多研究完善该指标。
碱性磷酸酶是一种主要由肝脏和骨骼产生的酶。前列腺癌,尤其是去势抵抗性前列腺癌,经常发生骨转移,较高的碱性磷酸酶水平与前列腺癌的总体生存率较低相关,可能反映了骨转移肿瘤负荷[16]。LI等[17]通过检测碱性磷酸酶水平预测前列腺癌发生骨转移的风险。ROMERO-LAORDEN等[18]通过前瞻性研究分析169例骨转移性去势抵抗性前列腺癌患者数据指出,高水平的碱性磷酸酶是唯一与生存相关的指标。GAO等[19]的研究通过联合碱性磷酸酶和PSA双指标进行早期筛查,明显提高了前列腺癌早期筛查的灵敏度。本研究结果也提示,在进行穿刺检查前患者碱性磷酸酶水平升高(45~<125 U/L,≥125 U/L),前列腺癌发生风险分别升高了20.136倍和45.691倍,患者有更充分的理由进行穿刺活检。
骨转移是前列腺癌最常见的转移部位,也是晚期前列腺癌患者死亡的主要原因。血清钙的水平在一定程度上能够预测前列腺癌的患病风险及预后。ZHOU等[20]研究指出钙通路激活与前列腺癌骨转移有关。而对英国生物银行的前瞻性分析指出,膳食钙与前列腺癌风险正相关[21]。DAVID等[22]通过检测前列腺癌患者雄激素剥夺治疗后血清钙水平,预测患者骨折风险。KUMAR等[23]针对前列腺癌放疗后患者的研究则提示患者易发生低钙血症。本研究结果提示,穿刺前高血清钙是前列腺癌发生的保护因素,可能反映了患者未受骨转移肿瘤负荷。
血液生化檢测中的血清总蛋白主要由白蛋白和球蛋白组成,血清总蛋白水平反映了肝脏蛋白合成功能和肾脏滤过功能平衡。血清白蛋白占血清总蛋白的40%~60%,除维持机体渗透压和营养外,还是体内重要的内源性抗氧化剂。肿瘤的发生、发展伴随着体内氧化水平的变化。LIN等[24]通过NHANES数据库分析饮食和血清抗氧化剂与PSA的关系,发现在中老年男性中血清白蛋白水平与PSA水平呈负相关。ZHU等[25]通过孟德尔随机化分析多种抗氧化剂与肿瘤发病率的关系,指出较高水平的血清白蛋白与降低前列腺癌风险有显著因果关系。血清球蛋白主要为免疫球蛋白、补体或多种糖蛋白,参与多种免疫反应。路帅等[26]研究显示球蛋白是前列腺癌发生的独立危险因素(OR=1.112,95%CI=1.044~1.185),其水平升高可能与前列腺癌进展中的免疫炎症反应有关。目前有关血清总蛋白水平与前列腺癌发病率的影响暂无明确结论,本研究结果显示高水平血清总蛋白是前列腺癌发生的保护因素,较高的血清总蛋白水平可能反映了患者较好的营养状态。
SUN等[27]通过孟德尔随机化的方法分析欧洲数据表明血清尿素与女性的肾细胞癌呈负相关,而与男性肾细胞癌、前列腺癌并无明显关系。PEREZ-CORNAGO等[28]通过前瞻性队列研究分析提示前列腺癌发病率与尿素呈正相关。另外两项研究也同样指出血清尿素与前列腺癌的发生呈正相关[29-30]。而本研究中高水平尿素是前列腺癌发生的保护因素(OR=0.069,P<0.001)。尚需更多研究来证实尿素水平与前列腺癌发生风险之间的联系。
本研究不足之处:首先,本研究将“前列腺癌”和“前列腺增生合并前列腺癌”均归为“前列腺癌组”,但两组人群可能存在同质性不一问题,不能简单合并;其次,本研究为单中心回顾性研究,病例来源较为简单,尚需包含多地区、多民族、多层次的数据进行更加充分的外部验证,尤其是大样本的队列研究;最后,前列腺癌的发病潜在风险多样,本研究仅针对患者进行穿刺活检前的临床指标进行分析,并未包含患者的生活习惯、饮食结构、家族史等情况。
综上所述,本研究构建了一个包含年龄、tPSA、碱性磷酸酶、总蛋白、钙和尿素6个预测指标的前列腺癌早期筛查风险预测模型,通过验证集验证显示其具有较好的预测性能,可以为前列腺癌早筛可疑患者是否进行穿刺活检提供指导依据,避免过度活检带来的身体创伤和经济压力。
作者贡献:李宏基负责临床数据收集、整理、分析,并撰写论文初稿;赵晓龙负责统计分析、绘制图表质量把控;胡伟负责临床资料质量把控;韩东晖提出研究思路,设计研究方案;王安辉、秦卫军负责文章的质量控制及审校,对文章整体负责。
本文无利益冲突。
李宏基:https://orcid.org/0009-0005-7694-1880
参考文献
SUNG H,FERLAY J,SIEGEL R L,et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2021,
71(3):209-249. DOI:10.3322/caac.21660.
SIEGEL R,MILLER K,WAGLE N S,et al. Cancer statistics,2023[J]. CA A Cancer J Clin,2023,73:17-48.
REBELLO R J,OING C,KNUDSEN K E,et al. Prostate cancer[J]. Nat Rev Dis Primers,2021,7:9. DOI:10.1038/s41572-020-00243-0.
中国抗癌协会泌尿男生殖系统肿瘤专业委员会前列腺癌学组. 前列腺癌筛查中国专家共识(2021年版)[J]. 中国癌症杂志,2021,31(5):435-440.
MOTTET N,CORNFORD P,VAN DEN BERGH R C N,et al. EAU-EANM-ESTRO-ESUR-ISUP-SIOG guidelines on prostate cancer[Z]. ISBN 978-94-92671-19-6. EAU Annual Congress Milan 2023,2023.
BERGENGREN O,PEKALA K R,MATSOUKAS K,et al. 2022 update on prostate cancer epidemiology and risk factors-a systematic review[J]. Eur Urol,2023,84(2):191-206. DOI:10.1016/j.eururo.2023.04.021.
CARLSSON S V,VICKERS A J. Screening for prostate cancer[J]. Med Clin N Am,2020,104(6):1051-1062. DOI:10.1016/j.mcna.2020.08.007.
DE VOS I I,REMMERS S,HOGENHOUT R,et al. Prostate cancer mortality among elderly men after discontinuing organised screening:long-term results from the European randomized study of screening for prostate cancer Rotterdam[J]. Eur Urol,2024,
85(1):74-81. DOI:10.1016/j.eururo.2023.10.011.
FANKHAUSER C D,PARRY M G,ALI A,et al. A low prostate specific antigen predicts a worse outcome in high but not in low/intermediate-grade prostate cancer[J]. Eur J Cancer,2023,181:70-78. DOI:10.1016/j.ejca.2022.12.017.
KIM D W,CHEN M H,WU J,et al. Prostate-specific antigen levels of ≤4 and >4 ng/mL and risk of prostate cancer-specific mortality in men with biopsy Gleason score 9 to 10 prostate cancer[J]. Cancer,2021,127(13):2222-2228. DOI:10.1002/cncr.33503.
MAHAL B A,KWAK L,XIE W L,et al. Mortality risk for docetaxel-treated,high-grade prostate cancer with low PSA levels:a meta-analysis[J]. JAMA Netw Open,2023,6(11):e2340787. DOI:10.1001/jamanetworkopen.2023.40787.
ZHENG R S,WANG S M,ZHANG S W,et al. Global,regional,and national lifetime probabilities of developing cancer in 2020[J]. Sci Bull,2023,68(21):2620-2628. DOI:10.1016/j.scib.2023.09.041.
CICCONE G,LUCA S D,ODERDA M,et al. Patient and context factors in the adoption of active surveillance for low-risk prostate cancer[J]. JAMA Netw Open,2023,6(10):e2338039. DOI:10.1001/jamanetworkopen.2023.38039.
BOSCHHEIDGEN M,ALBERS P,SCHLEMMER H P,et al. Multiparametric magnetic resonance imaging in prostate cancer screening at the age of 45 years:results from the first screening round of the PROBASE trial[J]. Eur Urol,2024,85(2):105-111. DOI:10.1016/j.eururo.2023.09.027.
KRILAVICIUTE A,BECKER N,LAKES J,et al. Digital rectal examination is not a useful screening test for prostate cancer[J]. Eur Urol Oncol,2023,6(6):566-573. DOI:10.1016/j.euo.2023.09.008.
ZHANG Z X,JUNG J,KIM A,et al. A scalable approach to characterize pleiotropy across thousands of human diseases and complex traits using GWAS summary statistics[J]. Am J Hum Genet,2023,110(11):1863-1874. DOI:10.1016/j.ajhg.2023.09.015.
LI M,DING C P,ZHANG D,et al. Distinguishable colorimetric biosensor for diagnosis of prostate cancer bone metastases[J]. Adv Sci,2023,10(32):e2303159. DOI:10.1002/advs.202303159.
ROMERO-LAORDEN N,LORENTE D,VELASCO G D,et al. Prospective assessment of bone metabolism biomarkers and survival in metastatic castration-resistant prostate cancer patients treated with Radium-223:the PRORADIUM study[J]. Eur Urol Oncol,2023:S2588-S9311(23)00207-9. DOI:10.1016/j.euo.2023.09.015.
GAO Y T,WU Y,HUANG P C,et al. Colorimetric and photothermal immunosensor for sensitive detection of cancer biomarkers based on enzyme-mediated growth of gold nanostars on polydopamine[J]. Anal Chim Acta,2023,1279:341775. DOI:10.1016/j.aca.2023.341775.
ZHOU Q H,CHEN X,YAO K,et al. TSPAN18 facilitates bone metastasis of prostate cancer by protecting STIM1 from TRIM32-mediated ubiquitination[J]. J Exp Clin Cancer Res,2023,
42(1):195. DOI:10.1186/s13046-023-02764-4.
WATLING C Z,KELLY R K,DUNNERAM Y,et al. Associations of intakes of total protein,protein from dairy sources,and dietary calcium with risks of colorectal,breast,and prostate cancer:a prospective analysis in UK Biobank[J]. Br J Cancer,2023,129(4):636-647. DOI:10.1038/s41416-023-02339-2.
DAVID K,DEVOS G,NARINX N,et al. Changes in bone and mineral homeostasis after short-term androgen deprivation therapy with or without androgen receptor signalling inhibitor - substudy of a single-centre,double blind,randomised,placebo-controlled phase 2 trial[J]. EBioMedicine,2023,97:104817. DOI:10.1016/j.ebiom.2023.104817.
KUMAR S,CRUMBAKER M,HARVEY C,et al. The Tyr phenomenon:a hypocalcemic response in high-volume treatment responders to 177Lu-prostate-specific membrane antigen therapy[J]. J Nucl Med,2023,64(9):1412-1416. DOI:10.2967/jnumed.123.265759.
LIN H Y,ZHU X D,AUCOIN A J,et al. Dietary and serum antioxidants associated with prostate-specific antigen for middle-aged and older men[J]. Nutrients,2023,15(15):3298. DOI:10.3390/nu15153298.
ZHU J H,LIAN J,WANG X,et al. Role of endogenous and exogenous antioxidants in risk of six cancers:evidence from the Mendelian randomization study[J]. Front Pharmacol,2023,14:1185850. DOI:10.3389/fphar.2023.1185850.
路帥,李文杰,徐紫薇,等. 前列腺癌风险预测模型的构建与验证[J]. 重庆医科大学学报,2023,48(3):328-334. DOI:10.13406/j.cnki.cyxb.003180.
SUN Y D,LI J J,QU Z H,et al. Causal associations between serum urea and cancer:a Mendelian randomization study[J]. Genes,2021,12(4):498. DOI:10.3390/genes12040498.
PEREZ-CORNAGO A,FENSOM G K,ANDREWS C,et al. Examination of potential novel biochemical factors in relation to prostate cancer incidence and mortality in UK Biobank[J]. Br J Cancer,2020,123(12):1808-1817.
QADER G,AALI M,SMAIL S W,et al. Cardiac,hepatic and renal dysfunction and IL-18 polymorphism in breast,colorectal,and prostate cancer patients[J]. Asian Pac J Cancer Prev,2021,22(1):131-137. DOI:10.31557/APJCP.2021.22.1.131.
FARAHANI H,ALAEE M,AMRI J,et al. Serum and saliva concentrations of biochemical parameters in men with prostate cancer and benign prostate hyperplasia[J]. Lab Med,2020,51(3):243-251. DOI:10.1093/labmed/lmz053.
(收稿日期:2023-11-10;修回日期:2024-02-20)
(本文编辑:贾萌萌)
