肠侵袭性大肠埃希菌噬菌体DK-13 的生物学特性及应用
2024-04-17王梦雅刘家齐姜海霖李菁华赵春燕黄红兰
王梦雅 刘家齐 姜海霖 李菁华 赵春燕 黄红兰
(吉林大学基础医学院病原生物学系,长春 130021)
大肠埃希菌(Escherichia coli, E.coli)属于革兰氏阴性杆菌,广泛存在于自然界中,绝大多数属于正常菌群,但其在具有某些特定毒力因子时具有致病性,能引起人和动物共同感染[1]。且可通过污染被屠宰动物或其他动物源性食品等途径从食物链感染人体[2],可引起腹部绞痛,带血和黏液的腹泻等症状[3]。抗生素一直是抗菌的重要手段之一,但由于抗生素的滥用,耐药菌株的大量出现,导致了未来没有针对耐药菌的药物可用的情况[4]。因此迫切需要开发具有替代作用的新的抗菌策略[5]。
噬菌体在自然界中种类繁多,具有高度多样化,基本感染现存的所有细菌[6]。其基因组编码的蛋白质可用于食品安全防治、耐药菌株引起的感染治疗等[7]。噬菌体还被发现在对养殖场饲养的牲畜的杀菌方面有较好的效果,从而限制病原体进入食物链的风险,还可用于检测动物源性食品中的病原体[8]。例如,噬菌体产品SalmoFreshTM和EcoShiledTM已被开发并批准用于食品工业,以抑制食源性微生物[9-10]。噬菌体裂解细菌的功效已经在各种研究中得到证实,使用噬菌体成为用于食品安全防治的有效方法[11-12]。由于多数噬菌体裂解宿主菌的专一性,需筛选并分离新的噬菌体以扩增噬菌体库以增加宿主范围,为未来鸡尾酒噬菌体制剂应用提供数据参考[13]。
本研究分离得到一株特异性较强的能裂解肠侵袭性大肠埃希菌的噬菌体,是一种潜伏期短、裂解效率高、耐高温以及耐酸碱的烈性噬菌体,具有应用于食品安全防治的潜力,为以后解决食品污染问题提供了一种新的解决策略。另外本研究还进行全基因组测序并分析预测了裂解宿主菌的相关基因,为进一步研究噬菌体应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和污水样品 宿主菌肠侵袭性大肠埃希菌D1 从污染肉制品分离,由吉林大学基础医学院病原生物学系保存,经PCR 鉴定为肠侵袭性大肠埃希菌,实验所用其他大肠埃希菌,蜡样芽孢杆菌,金黄色葡萄球菌均由吉林大学基础医学院病原生物学系保存[14]。污水样品采集于吉林大学第一医院污水处理中心。
1.1.2 培养基、主要试剂和仪器 营养琼脂(NA)、营养肉汤(NB)、改良克氏双糖铁培养基管,青岛高科园海博技术有限公司;聚乙二醇(PEG8000),Beijing Biotopped Science; DNaseI 酶,RNaseA 酶,大连TaKaRa 公司;SM 缓冲液,武汉卡诺斯科技有限公司;乙二胺四乙酸(EDTA)、Tris 碱,北京康为世纪生物科技有限公司;无水乙醇、冰醋酸,天津市化学试剂有限公司;硫酸,锦州古城化学试剂有限公司;氢氧化钠,湖北鑫润德化工有限公司。
1.2 方法
1.2.1 宿主菌的分离与鉴定 吸取20 μL EIEC 冻干粉溶解液加入10 mL NB 中,37℃,160 r/min 培养5 h 后,用无菌接种环蘸取菌液进行分区划线,过夜37℃培养,第2 天观察形态,挑取单菌落加入NB中培养后保存。挑取EIEC 单菌落进行PCR 确认试验以鉴定。
1.2.2 裂解性噬菌体的初步筛选 将未经处理的医院污水取出300 mL 加入1.8 g 固体CaCl2(0.6%)静置30 min,5 000 r/min 离 心10 min,取100 mL 的污水上清液和100 mL NB,并与5 mL EIEC 的新鲜菌液混合,37℃培养过夜。次日5 000 r/min 离心3 min,经0.45 μm 滤器过滤后得到噬菌体初提液。取500 μL EIEC 菌液加入试管中,再加入5 mL 半固体培养基(50℃左右),凝固后在表面中心处滴加2-3滴噬菌体初提液,晾干后倒置放入培养箱,37℃培养过夜。次日观察平板中心是否出现噬菌斑。
1.2.3 噬菌体的分离纯化及测定滴度 挑出形态最好的噬菌斑加入宿主菌液中培养8 h,5 000 r/min 离心3 min,所得上清液用0.45 μm 滤器过滤,得到噬菌体纯化液。取100 μL 噬菌体液倍比稀释液与100 μL 宿主菌液混合于试管中,再加入5 mL 半固体培养基(50℃左右),混匀后倒在琼脂平板上,凝固后37℃倒置培养过夜。次日观察平板上的噬菌斑形态,挑取单个噬菌斑重复上述操作7-10 次,最终得到纯化后的纯种噬菌体。
将纯化后的噬菌体液进行倍比稀释,重复一次纯化的步骤,37℃恒温培养过夜后,次日观察并记录各稀释梯度平板上噬菌斑的数量,依据公式算出噬菌体的滴度。
1.2.4 噬菌体形态观察 参考《分子克隆实验指南》[15]中关于噬菌体颗粒的PEG/NaCl 沉淀提取法进行噬菌体纯化颗粒制备,噬菌体颗粒溶于SM 缓冲液中,4℃保存备用;用负染色法对噬菌体颗粒进行染色,取20 μL 噬菌体颗粒与20 μL 浓度为0.5%的戊二醛混合,滴在铜网上静置15 min,使噬菌体颗粒固定。用2%的磷钨酸对噬菌体颗粒进行负染色1-2 min,用滤纸吸干多余液体,用透射电镜在80 kV 电压下观察。拍照并储存。
1.2.5 噬菌体最佳感染复数(multiplicity of infection,MOI)测定 将培养至对数期,OD600nm≈0.2,菌液浓度约为1×109CFU/mL 的宿主菌液,与已知滴度的噬菌体液(2×109CFU/mL)倍比稀释,按照噬菌体滴度与宿主菌浓度的比值分别为100、10、1、0.1、0.01、0.001、0.000 1 的比例混匀,37℃,160 r/min培养4 h,取出后用0.45 μm 滤器过滤,滤液倍比稀释后测定各体系下的噬菌体滴度,滴度最高的体系的比值即噬菌体的最佳感染复数,重复3 次。
1.2.6 噬菌体一步生长曲线及爆发量测定 取最佳MOI 对应的宿主菌液和噬菌体液各500 μL,放入培养箱,37℃培养10 min,将混合液8 000 r/min 离心30 s,吸弃上清液,然后加入1 mL NB 吹打使沉淀重悬,重复两次。在锥形瓶中加入此悬液,再加19 mL 营养肉汤,放入摇床,37℃,160 r/min,开始每5 min 取样1 mL,30 min 后,每10 min 取样1 mL,至100 min 停止取样。每次取样都需用0.45 μm 滤器过滤,然后暂时放入4℃保存,待全部取样完成后,统一取出进行倍比稀释,测定噬菌体滴度,重复3 次。
1.2.7 噬菌体的热稳定性和pH 稳定性试验
(1)噬菌体热稳定性。将噬菌体液分成4 组,每组6 mL,分别放入50℃、60℃、70℃、80℃的水浴中,每隔10 min 取1 mL 噬菌体液稀释10 倍,防止高温影响实验结果,暂时放入4℃保存,待全部取样完成后,统一取出进行倍比稀释,测定噬菌体滴度,重复3 次。
(2)噬菌体pH 稳定性。取1 mL 的噬菌体液加入9 mL 不同pH(1-14)的营养肉汤中,37℃恒温培养1 h,取出后进行倍比稀释,用上文的方法测定噬菌体滴度,重复3 次。
1.2.8 噬菌体宿主范围测定 将实验室保存的其他大肠埃希菌、蜡样芽孢杆菌、金黄色葡萄球菌全部复苏并培养至对数期,取500 μL 菌液加入小试管中,再加入5 mL 半固体培养基(50℃左右),混匀后使半固体培养基平铺在琼脂平板上,凝固后在中心处滴加2-3 滴噬菌体液,晾干后37℃倒置培养过夜。次日观察各个平板中心是否出现噬菌斑。
1.2.9 噬菌体DK‑13 全基因组测序及分析 按1.2.4方法获得的500 μL 噬菌体浓缩液,加入2.5 μL DNase I(1 mg/mL) 和0.5 μL RNase A(1 mg/mL),之 后 加 入25 μL EDTA,25 μL 蛋 白 酶K 和20 μL SDS,56℃水浴1 h,裂解噬菌体。随后使用苯酚-氯仿-异戊醇(25∶24∶1)提取噬菌体DNA,送至杭州联川生物技术股份有限公司进行全基因组测序。使用在线软件tRNAscan‑SE 预测噬菌体中是否含有tRNA;CG view 展示序列中GC skew‑ 和GC skew+等特性情况的圆形基因图。
使用ORFs Finder 预测噬菌体DK‑13 的开放阅读 框(ORF);使 用BLAST(Basic Local Alignment Search Tool)预测并注释每个开放阅读框的功能;使用VFDB(Virulence Factors of Pathogenic Bacteria)数据预测噬菌体DK‑13 是否含有毒力基因;使用CARD(The Comprehensive Antibiotic Resistance Database)数据库检索预测噬菌体DK‑13 是否含有耐药基因。
选取噬菌体DK‑13 的保守基因DNA 连接酶进行BLASTP(http://www.ncbi.nlm.nih.gov/BLAST/),寻找同源性蛋白,再使用MEGA6(https://www.megasoftware.net/)软件邻域连接构建噬菌体DNA 连接酶的系统发育进化树进行进化关系分析。
1.2.10 细菌污染猪肉模型制备及不同温度下噬菌体DK‑13 对污染猪肉的杀菌效果 参考Li 等[16]的实验方法,将从超市购买的猪里脊肉部分用无菌刀片切成边长约为2 cm 的正方形薄片,用1 mL PBS 缓冲液冲洗,紫外灭菌2 h,使肉片充分灭菌。滴加100 μL 浓度为1×107CFU/mL 的宿主菌液滴在肉片表面,使其充分接触,静置10 min,得到浓度为1×106CFU/sample 的EIEC 污染的猪肉样品,放入4℃冰箱保存。
取最佳感染复数的宿主菌液的噬菌体液滴在猪肉样品表面,使其与样品充分接触进行杀菌,对照组则滴加等体积的PBS 缓冲液,分别放入4℃冰箱和37℃恒温培养箱培养6 h。每隔1 h 取样一次,加入装有PBS 缓冲液的离心管中,充分震荡后在相应温度下,5 000 r/min 离心1 min,吸弃上清后再加1 mL PBS 缓冲液,重悬后在相应温度下5 000 r/min 离心1 min,重复两次。将最后一次悬液梯度稀释,取100 μL 菌液均匀涂布在平板上,37℃倒置培养过夜。次日对平板上菌落进行计数。重复3 次。
2 结果
2.1 噬菌体的分离及其滴度测定
从医院未经处理的污水中分离出了一株烈性噬菌体,命名为DK‑13,采用双层平板法纯化后,得到了纯化后的单一噬菌体,噬菌体DK‑13 的噬菌斑为圆形,透明且无晕环,直径约为1-2 mm。结果如图1‑A 所示。

图1 噬菌体DK-13 的形态特征Fig.1 Morphological characteristics of phage DK-13
通过计算可以得出噬菌体DK‑13 的滴度约为2×109PFU/mL。
2.2 噬菌体形态学观察
如图1‑B 所示,噬菌体DK‑13 呈典型的蝌蚪状外形,包含一个直径约为100 nm 的正二十面体的头部和一个可收缩的螺旋对称的尾部,根据ICTVdb 数据库的规则分类,噬菌体DK‑13 属于有尾噬菌体目(Caudovirales)肌尾噬菌体科(Myoviridae)T4 噬菌体亚科(Tevenvirinae)噬菌体。
2.3 噬菌体最佳感染复数的测定
噬菌体DK‑13 与宿主菌EIEC 的感染复数为0.01时,产生子代噬菌体的数量最多,效价为2.8×1010PFU/mL, 说明噬菌体DK‑13 的最佳感染复数为0.01(图2‑A)。
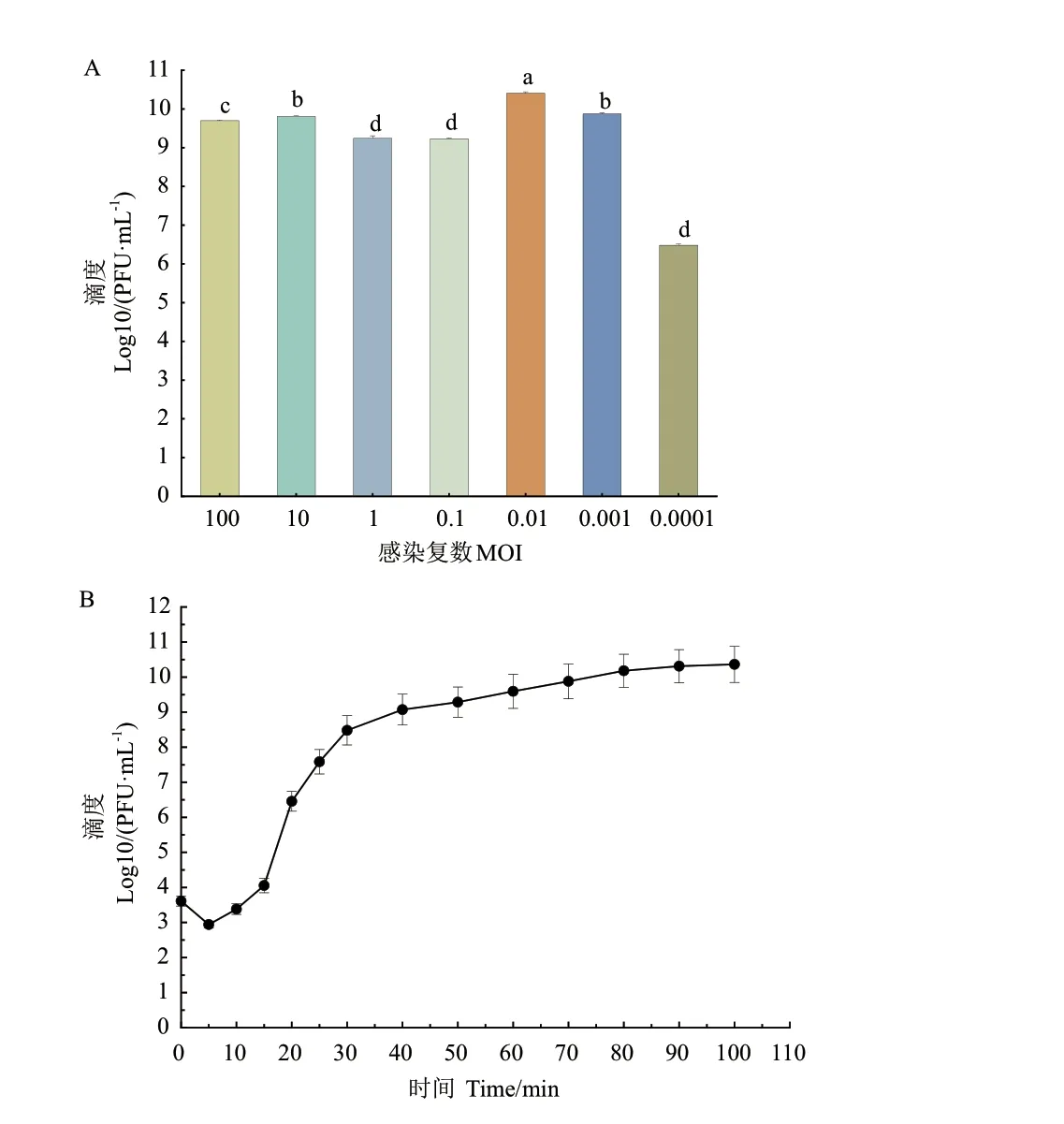
图2 噬菌体DK-13 的生物学特性Fig.2 Biological characters of phage DK-13
2.4 噬菌体一步生长曲线及爆发量的测定
取最佳感染复数0.01 对应的宿主菌液和噬菌体液各500 μL,测定不同时间噬菌体的滴度。以时间为横轴,噬菌体滴度的对数为纵轴,绘制一部生长曲线。结果如图2‑B 所示,噬菌体DK‑13 的潜伏期约为10 min,裂解期约为70 min,平均爆发量为164 PFU/cell。
2.5 噬菌体稳定性的测定
2.5.1 噬菌体在不同温度下的稳定性 本试验测试了噬菌体DK‑13 在50℃、60℃、70℃和80℃的条件下,1 h 之内的活性情况。结果如图3‑A 所示,在50℃和60℃时,噬菌体的活性几乎不发生变化;70℃下噬菌体活性下降,20 min 后完全失活;温度升高至80℃,噬菌体10 min 后完全失活。结果表明噬菌体DK‑13 受温度影响较小。

图3 噬菌体DK-13 的生物学特性Fig.3 Biological characteristics of phage DK-13
2.5.2 噬菌体在不同pH 下的稳定性 噬菌体DK‑13在pH 1-14 的环境下,1 h 之内的存活情况测试结果如图3‑B 所示:在pH 5-10 的条件下,对噬菌体DK‑13 的活性并没有很大的影响,噬菌体均体现了较高的活性;在pH 4 或pH 11 的条件下,噬菌体的活性略有下降,但依然有大量噬菌体存活;在pH<4或pH>11 的条件下,几乎检测不到存活的噬菌体。
2.6 噬菌体宿主范围的测定
将实验室保存的其他15 株大肠埃希菌,2 株蜡样芽孢杆菌,3 株金黄色葡萄球菌全部复苏并培养至对数期,用噬菌体DK‑13 进行裂解测定,结果显示噬菌体DK‑13 不能裂解以上任何细菌,只能裂解宿主菌EIEC。说明噬菌体DK‑13 的特异性非常强。详细结果见表1。

表1 噬菌体DK-13 宿主范围Table 1 Host range of DK-13 phage
2.7 噬菌体全基因组分析
测序结果显示:噬菌体DK‑13 基因组全长172 275 bp,GC 含量为40.18%。tRNAscan‑SE 分析结果显示:噬菌体DK‑13 基因组中含有tRNAMet、tRNAArg。噬菌体DK‑13 的全基因组信息已上传至GenBank,登录号为MT611523。
2.8 噬菌体功能注释
目前在VFDB 中尚未检索到噬菌体DK‑13 存在毒力基因;在CRAD 数据库中也尚未检索到噬菌体DK‑13 存在耐药基因。使用ORFs Finder 和BLAST预测噬菌体DK‑13 的开放阅读框并注释其功能,预测其共有293 个开放阅读框(ORF),其中已知功能的ORFs 共有125 个,可分为6 个模块:复制/重组模块、包装基因模块、结构基因模块、核苷酸代谢基因模块、转录/翻译模块和其他功能模块,使用DNAMAN 绘制噬菌体DK‑13 的基因组注释图谱(图4)。具体包括:(1)复制/重组模块:DNA 聚合酶(ORF73)在催化合成DNA 中有着重要作用,相关基因还有DNA 连接酶(ORF47)、DNA 解旋酶(ORF92、140、167)。(2)包装基因模块:末端酶小亚基(ORF3)和末端酶大亚基(ORF13)。在噬菌体复制过程中,需要对DNA 进行包装这需要ATP 引导的末端酶蛋白负责将DNA 切成大小序列。T holin 溶解介体(ORF101)是DK‑13 参与裂解宿主菌的相关基因,在裂解宿主菌的过程中起着重要作用。(3)结构基因模块:与结构相关的蛋白编码基因包括主要头部蛋白(ORF22)、小外衣壳蛋白(ORF152)及短尾纤维蛋白(ORF7),它们在噬菌体吸附或感染起到重要作用。(4)核苷酸代谢基因模块:包括还原酶小亚基(ORF76),核苷三磷酸焦磷酸水解酶(ORF155)等核苷酸代谢所需的相关酶类。(5)转录/翻译模块:与噬菌体的转录和翻译有关的基因有转录修饰子(ORF135)和翻译阻遏蛋白(ORF175)等7 个噬菌体基因在噬菌体合成相关蛋白过程中发挥作用。(6)其他功能基因:这一模块主要是一些目前对其在噬菌体内的功能尚不可知的蛋白。

图4 噬菌体DK-13 基因组注释图谱Fig.4 Annotation diagram of the genome of DK-13 phage
2.9 噬菌体进化分析
基于噬菌体DK‑13 的DNA 连接酶序列,使用MEGA6 软件,对噬菌体DK‑13 做进化关系分析。在GenBank 中BLAST 同源蛋白建立系统发育树。结果如图5 所示,噬菌体DK‑13 与大肠埃希菌噬菌体vB_EcoM_VR20 具有较近的亲缘关系。

图5 噬菌体DK-13 的进化关系分析Fig.5 Phylogenetic analysis of phage DK-13
2.10 噬菌体DK‑13在不同温度下对污染猪肉杀菌效果的评价
实验在4℃和37℃的条件下使用噬菌体DK‑13处理被EIEC 污染的猪肉样品。结果如图6 所示,在4℃条件下,对照组的EIEC 数量在6 h 内几乎没有变化,实验组在噬菌体DK‑13 的作用下,EIEC 数量第1 小时后减少了约1.5 个数量级,随后保持稳定;在37℃条件下,对照组的EIEC 数量在6 h 内不断增加,共增长了约2 个数量级,实验组在噬菌体DK‑13 的作用下,EIEC 数量第1 小时后减少了约1.5个数量级,6 h 后增长了0.5 个数量级。从结果中可以看出,噬菌体DK‑13 在处理被EIEC 污染的猪肉样品时,4℃的杀菌效果好于37℃。

图6 不同温度下噬菌体DK-13 对污染猪肉的杀菌效果Fig.6 Sterilization effect of phage DK-13 at different temperatures on contaminated pork
3 讨论
食源性疾病是常见的全球公共卫生问题,引起腹泻,腹痛等症状,主要因烹饪时生熟不分,食品保存不当或厨师不注意卫生所致[17]。EIEC 很容易通过污染的水源和食物进行传播。研究发现,耐碳青霉烯类肠杆菌科细菌在动物源、零售肉制品源及人源等3 种样本中传播,且大肠埃希菌耐药率最高[18]。由于病原体对食品的污染,食品类行业每年都遭受巨大损失[19]。噬菌体类生物制剂的出现对于食品安全的防治起到了重要作用。
噬菌体是地球上最丰富的生物体,约是全球细菌数量的10 倍[20],噬菌体是所有新鲜食物中正常微生物中的一部分,已从各种食物中分离出来并且数量通常很多[21]。由于常见的食品灭菌法,如巴氏杀菌法和食品高压加工法等会影响食品的外观及营养价值[22],且因此噬菌体可被用作食品安全的生物防治剂,且噬菌体具有高度安全性,能够特异性针对某些细菌的感染,并且保留一些食品原有特性和营养价值[23-25]。Perera 等[26]的研究表明,使用ListShieldTM——一种专门针对单核细胞增生李斯特菌的市售噬菌体混合物,处理污染的生菜和烟熏鲑鱼等食物后细菌数量显著降低的同时没有改变食物的感官特性(包括味觉、视觉和嗅觉)。
本研究从污水中分离一株EIEC 噬菌体DK‑13,根据其透射电镜形态及进化分析表明是一株新的噬菌体,国际病毒分类委员会将其归类为有尾噬菌体目(Caudovirales)肌尾噬菌体科(Myoviridae)T4噬菌体亚科(Tevenvirinae)噬菌体。噬菌体DK‑13潜伏期很短(10 min),暴发期较短(30 min),暴发量适中(164 PFU/cell),表明DK‑13 在短时间内就可以开始繁殖,在较短时间内就可完成裂解细菌的过程,因此在未来的应用实践中可较快地发挥作用;DK‑13 属于窄谱噬菌体,与Yuan 等[27]的大肠杆菌噬菌体DY1 同样特异性较高。一方面专门针对宿主菌,对微生物群影响较小,然而另一方面却限制了噬菌体的治疗范围[28]。因此,未来使用“鸡尾酒疗法”噬菌体组合可以更广泛地覆盖不同种属的细菌[29];DK‑13 酸碱耐受性和温度稳定性较强,具有较宽的工作范围,对环境要求低。通过生物信息学对DK‑13 进行全基因组及进化树分析,发现噬菌体DK‑13 与大肠埃希菌vB_EcoM_VR20 进化关系较为相近,同属T4 样噬菌体[30],有功能的编码区具有一定程度上的一致性,但没有明显的重排。噬菌体DK‑13 在4℃下6 h 内对于污染猪肉的EIEC 的杀菌效果比37℃较好。噬菌体可能具有不同的生理特性,在低温下比高温更有效,同时也证明噬菌体能够显著降低肉制品中大肠埃希菌的污染[31]。噬菌体DK‑13 基因组不存在毒力基因与耐药基因,用于污染肉制品的防治是安全有效的,未来作为生物防治剂,具有应用前景。
当前在食品卫生防治领域,针对几种主要的食源性致病菌,目前已生产出了相对应的噬菌体制剂:一种针对李斯特的商用单噬菌体制剂可以有效降低切片火腿中李斯特菌的水平,且效果优于乳酸链球菌素和乳酸钠[32];另一种针对志贺氏菌的噬菌体鸡尾酒制剂ShigaShieldTM可以将生菜、鸡胸肉和鲑鱼等食物中志贺氏菌的水平显著降低[33]。然而,仍需确定噬菌体对人体的作用及影响,对其生物学特性,免疫特性及基因分析进行更深层次的探究。随着生物技术的发展,在未来噬菌体将很快被用于食品安全的防治[34]。
4 结论
从医院污水中新分离的EIEC 噬菌体DK‑13,裂解性强,特异性强,对温度及酸碱稳定性良好,在污染的猪肉样品中具有较好的杀菌效果。
