瘤胃源粪臭素降解菌的分离鉴定及其降解特性研究
2024-04-17王璐刘梦雨张富源纪守坤王云张英杰段春辉刘月琴严慧
王璐 刘梦雨 张富源 纪守坤 王云 张英杰 段春辉 刘月琴严慧
(1.河北农业大学动物科技学院,保定 071000;2.河北农业大学食品科技学院,保定 071000)
随着畜禽集约化生产的发展和生态环保养殖模式转型升级的需求,畜禽粪便中臭味物质的降解成为了人们广泛关注的问题。其中,粪臭素排放量仅次于氨气和硫化氢,但刺激性气味更强,嗅阈值更低,不到0.003 mg/m3[1]。粪便堆肥处空气中的粪臭素含量为0.1-335 μg/m3[2],均远高于其嗅阈值,且粪浆中的粪臭素浓度可能随时间的推移而累积[3]。据统计,反刍动物瘤胃、粪便和猪粪便中的粪臭素浓度分别可达10 mg/L 与10 mg/kg[4-6]和1-100 mg/kg[7];另外,粪臭素具有强毒性,可通过瘤胃壁被吸收,极易沉积在肺部,是诱发反刍动物肺水肿和肺气肿的主要因素[8],其致突变性也是引发牛羊肺部癌变的原因之一[9]。由于其亲脂性,粪臭素还易被肉羊脂肪组织吸附,是引发羊肉膻味的因素[10]。此外,粪臭素能抑制细菌生长,高浓度的粪臭素可损伤细菌生物膜[11],这可能是粪臭素降解菌株资源获取较少的原因之一。因此,在反刍动物生产中,降低粪臭素产生量和排放量对改善牧场环境、降低牛羊肺气肿发病率、改善羊肉风味等方面均有重要意义。
生物降解法防治畜禽臭气具有低成本、无污染的优势,迄今为止已有10 余株粪臭素降解细菌被报道,来源包括海底沉积物[12]、红树林底泥[13]、土壤[14]、粪便[15-16]及污水[17-19]。在前人研究中,张宗源等[19]分离的红球菌YKSW‑6 表现出了最高的粪臭素降解率,14 h 可完全降解100 mg/L 的粪臭素;其次是Fukuoka 等[14]分离的贪铜菌KK10,24 h 可完全降解100 mg/L 的粪臭素,但目前已有菌株均不在饲料添加剂品种目录中,难以应用于动物生产。
反刍动物的粪臭素生成与吸收主要在瘤胃中进行[5],推测反刍动物瘤胃中可能存在着粪臭素降解细菌。基于这一假设,本研究从湖羊瘤胃液中富集、分离细菌并进行鉴定,测定其生长曲线和粪臭素降解效率,以期获得适用于反刍动物的高效的可饲粪臭素降解菌株。
1 材料与方法
1.1 材料
1.1.1 细菌分离来源 2022 年6 月使用河北农业大学动物房瘘管羊(湖羊,体重为(49.74±2.51)kg,n=3)采集瘤胃液。
1.1.2 培养基 (1)MSM 基础培养基(g/L)[20]:K2HPO40.8;KH2PO40.2;CaCl20.05;MgCl20.5;FeCl20.01;(NH4)2SO41.0;NaCl 5.0。(2) 富 集培养基:在MSM 培养基基础上额外添加终浓度为131.18 mg/L、196.77 mg/L 或262.36 mg/L 的粪臭素。(3)活化培养基:MSM 培养基中补充1 g/L 酵母粉和终浓度100 mg/L 的粪臭素。(4)降解培养基:在MSM 培养基基础上额外添加终浓度为100 mg/L 的粪臭素。
1.2 方法
1.2.1 粪臭素降解菌的富集及分离 通过瘘管采集绵羊瘤胃内容物,四层纱布过滤,80℃水浴处理20 min。接种10 mL 水浴后的瘤胃液到100 mL 含有131.18 mg/L 粪臭素的富集培养基中,于140 r/m、30℃振荡培养2 d;吸取1 mL 富集液加到粪臭素终浓度196.77 mg/L 的富集培养基中,同样条件培养3 d;吸取1 mL 富集液加到粪臭素终浓度262.36 mg/L的富集培养基中,同样条件培养4 d。富集培养基的粪臭素浓度每提升65.58 mg/L,细菌的培养时间相应增加1 d。
富集结束后,进行平板稀释涂布,稀释梯度为10-1-10-5,每个梯度设置3 个重复,挑取单菌落,分区划线纯化细菌3-4 次,直至得到单一形态菌落。
1.2.2 粪臭素降解菌的鉴定 使用通用引物27F(5'‑AGAGTTTGATCCTGGCTCAG‑3') 和1492R(5'‑GGTTACCTTGTTACGACTT‑3') 扩 增16S rRNA基因。PCR 反应体系(25 μL):菌液2 μL,上下游引物各1 μL,Mix 12.5 μL,ddH2O 8.5 μL。PCR 扩增程序:95℃ 10 min;(94℃ 1 min,47℃ 1 min,72℃1.5 min)30 个循环;72℃ 10min。将PCR 产物送至上海生工生物工程股份有限公司测序,在NCBI 上比对测序结果,使用MEGA 7.0 构建系统发育树。
1.2.3 粪臭素降解菌的生长曲线及降解速率测定 (1)菌株活化:接种细菌到40 mL 活化培养基中,于140 r/m、30℃的摇床中振荡培养。(2)生长曲线和降解速率测定:细菌活化12 h 后,以5%(OD600=0.30)的接种量将菌液接种到降解培养基中,于140 r/m、30℃的摇床中振荡培养。在第0、4、8、12、16、24、32、40 和48 小时采集菌液样品,测定菌液的OD600值(生长曲线)和粪臭素浓度(降解曲线)。(3)粪臭素测定:菌液加入等体积甲醇,5 000 r/min 离心10 min,取上清液经0.22 μm滤膜过滤后使用液相色谱法检测粪臭素浓度。色谱柱及色谱条件参考已有研究[18]:柱温为室温,检测波长254 nm,流动相为甲醇∶水(9∶1),流速1 mL/min,进样量20 μL,每个样品测量3 次。(4)粪臭素标准曲线:使用乙醇溶解粪臭素,配制成高浓度的储备液,将储备液稀释为0、1、5、10、15、20、25 mg/L 的标准溶液,所有液体均使用0.22 μm过滤膜过滤除菌,使用液相色谱法测定粪臭素含量。以标准溶液的浓度为横坐标、峰面积为纵坐标,建立粪臭素浓度标准曲线。
1.2.4 数据统计与分析 使用Excel 计算平均值和标准差,使用Graphpad Prism 8 软件作图。
2 结果
2.1 瘤胃源粪臭素降解菌的分离
共分离出25 株瘤胃源粪臭素降解菌,根据菌落形态特征将其分为11 个型,每个型选取一株菌作为代表菌株,分别命名为MSML1-11,菌株形态见图1。
图1 代表性瘤胃源粪臭素降解菌株菌落形态Fig.1 Colony morphology of representative rumen skatole-degrading bacteria
2.2 16S rRNA基因扩增、测序及系统发育树构建
电泳结果显示16S rRNA 基因扩增产物均在1 500 bp 左 右。如 图2 所 示,MSML2、MSML6 与枯草芽孢杆菌(Bacillus subtilis)IAM 12118T的序列相似性最高,分别为99.8%和99.9%,MSML4、MSML5、MSML7 和MSML10 与阿氏普里斯特氏菌(Priestia aryabhattai)B8W22T的 序 列 相 似 性 均 为99.9%,MSML3 和MSML11 与污染伯克霍尔德氏菌(Burkholderia contaminans)J2956T的序列相似性分别 为99.9% 和99.8%,MSML1、MSML8 和MSML9与成都假单胞菌(Pseudomonas chengduensis)AL 15‑21T的序列相似性均为99.9%。

图2 瘤胃源粪臭素降解菌的系统进化树Fig.2 Phylogenetic tree of rumen skatole-degrading bacteria
2.3 瘤胃源粪臭素降解菌的生长曲线
如图3‑A 所示,根据生长曲线可将菌株分为三大类:第一大类菌株包括MSML2、MSML4、MSML5、MSML6、MSML7 和MSML10,生长速度最快,OD 值能达到0.2 左右,0-4 h 为迟缓期,4 h 后进入对数期,8-16 h 进入平台期,其中MSML5 生长速度最快,在8 h 进入平台期,且菌株终OD 值最高;第二大类菌包括MSML1 和MSML9,生长速度适中,OD 终值也能达到0.2,0-16 h 为迟缓期,16-40 h 为对数期;第三大类菌包括MSML3 和MSML8,前期生长速度缓慢,OD 值仅能达到0.1,0-8 h 为迟缓期,8-32 h 为对数期。

图3 粪臭素降解菌生长和降解曲线Fig.3 Growth and skatole degradation curves of skatole-degrading isolates
2.4 瘤胃源粪臭素降解菌的粪臭素降解率
粪臭素标准品的出峰时间是3.47 min,粪臭素浓度与峰面积的标准曲线为y = 17 359x + 57 152(R2=0.997 5)。
瘤胃源粪臭素降解菌菌株的粪臭素降解曲线见图3‑B,其48 h 粪臭素降解率见图4。结果显示,MSML2 的粪臭素降解率最高,其48 h 粪臭素降解率达到23.03%;其次为MSML7、MSML8 和MSML10,粪臭素降解率均为20%以上。菌株MSML3 在48 h内的粪臭素降解率最低,为13.14%。
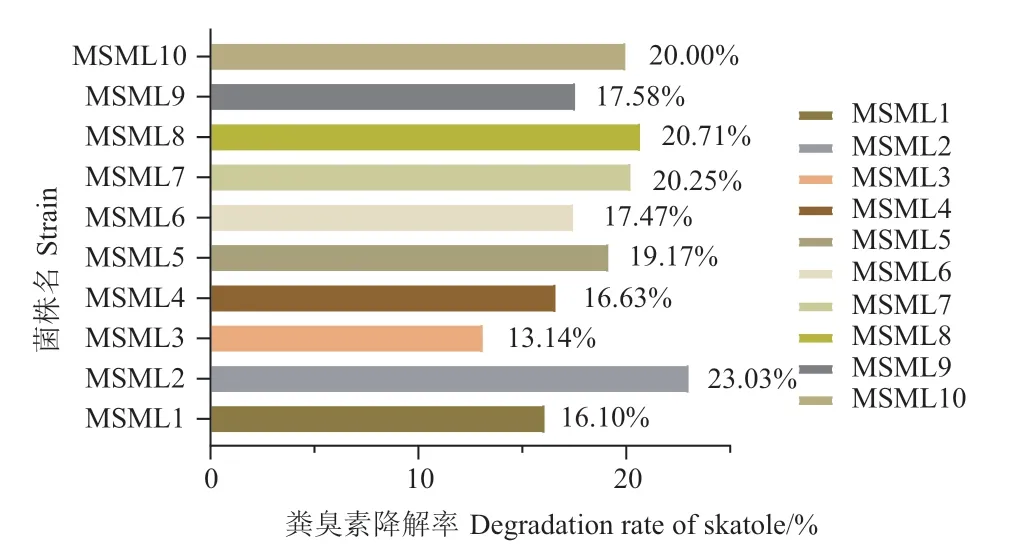
图4 不同菌株48 h 粪臭素降解率Fig.4 Skatole degradation rate by different isolates at 48 h
3 讨论
生物降解法除臭具有无污染和成本低的优点,已报道的粪臭素降解菌只有十余株,包括假单胞菌属、红假单胞菌属、贪铜菌属、不动杆菌属、红球菌属和伯克霍尔德菌属[2,15,18-19],大部分菌株来源于污水或粪便,且不在饲料添加剂目录中,能够用于动物养殖除臭的菌株资源十分稀缺。本研究从绵羊瘤胃液中分离获得11 株粪臭素降解菌,包括2 株枯草芽孢杆菌、4 株阿氏普里斯特氏菌、2 株污染伯克霍尔德氏菌和3 株成都假单胞菌,其中具有粪臭素降解能力的枯草芽孢杆菌、阿氏普里斯特氏菌和成都假单胞菌为本研究首次报道;枯草芽孢杆菌可作为畜禽饲料添加剂[21-22],为粪臭素生成的源头减排提供了菌株资源和新解决思路。
粪臭素对大多数微生物具有毒害作用。前人研究表明,30 mg/L 粪臭素即可抑制沙门氏菌和大肠杆菌的生长[23]。对于粪臭素利用菌也有相似研究结果,吴玉洪等[18]研究发现粪臭素降解菌红球菌RP3 在粪臭素含量为50 mg/L 的条件下菌株的平台期OD 值可达1.0,粪臭素含量提高到250 mg/L 以上时,菌株的平台期OD 值仅约0.3 左右;张宗源等[19]研究发现粪臭素利用菌红球菌YKSW‑6 在低浓度粪臭素(50 mg/L)条件下平台期的菌体浓度显著高于高浓度粪臭素(150 mg/L)条件下的菌体浓度。这一现象可能是由于粪臭素可通过促进内源型氧化应激影响细菌生物膜的形成,进而影响微生物存活和生长[24],也提示菌株对粪臭素耐受性是其粪臭素高效利用的基础。本研究中使用逐步提升粪臭素浓度的富集培养方案,最终培养基中粪臭素含量提升到262.36 mg/L,且大部分微生物可以在10 h 内达到生长平台期,所筛选粪臭素利用微生物天然具有良好的粪臭素耐受能力。
目前已报道的不同粪臭素降解菌降解效率差异较大,且与粪臭素浓度密切相关。Ma 等[25]研究发现,粪臭素初始浓度为150 mg/L 时,伯克氏菌IDO3在40 h 的粪臭素降解率为100%,当粪臭素浓度提升到180 mg/L 时,其对粪臭素的降解率几乎为0%;沼 泽 红 假 单 胞 菌 WKU‑KDNS3 在21 d 内 对13.18 mg/L 的粪臭素降解率为93%[26];淡色芽孢杆菌X3对10 mg/L 粪臭素的24 h 降解率为44%[27]。前人也对潜在可饲用益生菌的粪臭素降解能力进行了测定,但其粪臭素降解能力均较低,如乳酸菌在48 h 时的粪臭素降解率为5%-15%[15],短乳杆菌在24 h 内对1 mg/L 的粪臭素降解率为17%[28]。本研究分离到的菌株48 h 内对100 mg/L 的粪臭素降解率为13%-23%,其中可饲用枯草芽孢杆菌(MSML2)在48 h内的粪臭素降解率达到23.03%。同时本研究所使用粪臭素初始浓度高于肉羊瘤胃中的常见粪臭素浓度[4-5,29],且在可饲用微生物中粪臭素降解能力最高,在畜牧生产中具有良好的应用潜力。
目前对于不同菌株对粪臭素的降解途径尚不完全清楚[4]。Gu 等[12]发现硫酸盐还原条件下粪臭素的C2 被氧化,吡咯环断开生成邻氨基苯乙酸;Yin等[13]研究表明在有氧条件下,粪臭素的C3 被氧化,从而提出邻氨基苯甲酸降解途径。铜绿假单胞菌 Gs和恶臭假单胞菌 LPC24 降解粪臭素的代谢产物分别为吲哚‑3‑羧酸、3‑羟基-吲哚啉和3‑甲氧基吲哚、甲酰氨基苯乙酮和2‑氨基苯乙酮[13,30],Li 等[30]通过分析粪臭素的降解产物,推测粪臭素的降解途径为:粪臭素-3‑甲基氧化吲哚-甲酰氨基苯乙酮-2‑氨基乙酰苯途径。Fukuoka 等[14]共鉴定出14 种降解产物,提出另一个粪臭素降解途径——吲哚‑3‑羧酸和苯环加氧途径。多项研究也证实在粪臭素降解时邻苯二酚双加氧酶的相关基因表达上调[31-33],因而推测邻苯二酚途径可能广泛存在于粪臭素菌中并发挥作用。这些研究结果提示,不同菌株可能通过不同途径或多种途径共同实现粪臭素降解。在后续工作中,对比不同菌株粪臭素降解能力,进一步解析提高粪臭素降解效率的基因调控机制,通过遗传或进化手段对可饲用的枯草芽孢杆菌的粪臭素降解能力进行改造,获取粪臭素降解能力优化的可饲菌株,对通过饲喂微生物的方式降低养殖臭气排放具有重要意义。
4 结论
本试验成功从绵羊瘤胃液中分离获得了11 株粪臭素降解代表菌株,其中2 株为枯草芽孢杆菌,4 株为阿氏普里斯特氏菌,2 株为污染伯克霍尔德氏菌,3 株为成都假单胞菌。可饲用枯草芽孢杆菌MSML2 的粪臭素降解率最高,48 h 内对100 mg/L 粪臭素降解率可达23.03%。
